人教版高二化学选修四4-1:原电池(38张PPT)
文档属性
| 名称 | 人教版高二化学选修四4-1:原电池(38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-15 00:00:00 | ||
图片预览








文档简介
(共38张PPT)
4.1原电池
知识目标
(1)原电池原理、构成条件、电极名称的判断。
(2)电极反应方程式的书写。
(3)金属腐蚀、电化腐蚀、吸氧腐蚀、析氢腐蚀的一般概念。
(4)生活中常见的化学电源的认识。
(5)利用原电池概念理解金属腐蚀跟防腐的联系。
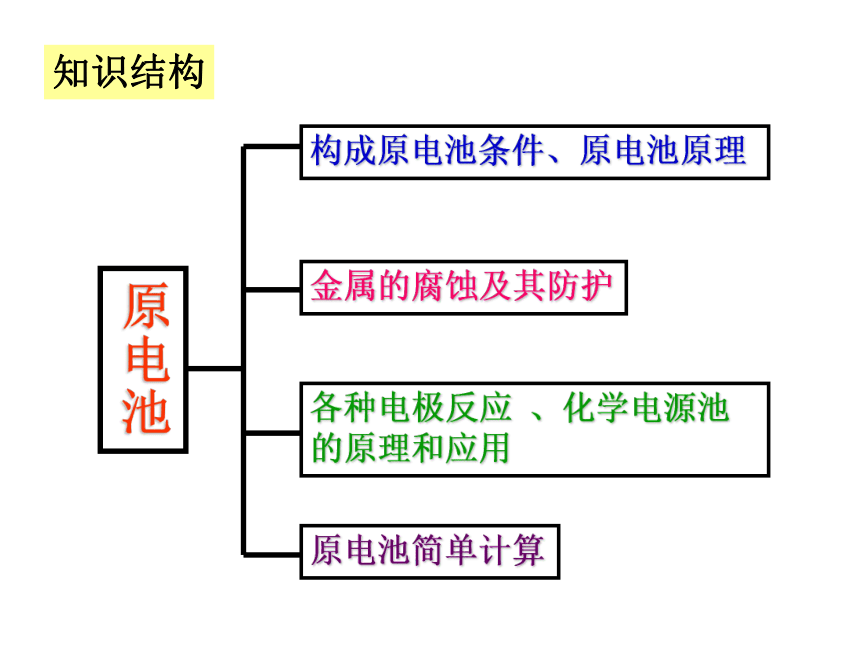
原电池
原电池简单计算
各种电极反应
、化学电源池的原理和应用
金属的腐蚀及其防护
构成原电池条件、原电池原理
知识结构
一、原电池
1、概念:
将化学能转化成电能的装置叫做原电池。
原电池与普通氧化还原反应的差异
原电池将化学能转变为电能
不同点
原电池反应快
反应部位
反应速率
能量变化
负极失去电子发生氧化反应
正极得到电子发生还原反应
2、构成原电池的条件
(1)必须自发进行氧化还原反应;
(3)两个电极必须插入电解质溶液中或熔融的电
解质中;
(4)两个电极必须相连并形成闭合回路。
(2)必须有两种活泼性不同的导电材料作电极;
两种活泼不同的金属。
一种金属与一种非金属(如石墨)。
两电极都是其它材料。
电极材料
3、原电池工作原理
e-
I
-:Zn-2e-=Zn2+
+:2H++2e-=H2↑
溶液中
离子流向
电子流向
电极反应
阴离子
负极
氧化反应
电子经外导线
正极
阳离子
还原反应
1、原电池的反应原理
发生氧化还原反应
化学能转化为电能
阳离子
正极
阴离子
负极
3、溶液内部无电子流动,通过阴阳离子定向移动实现内电路的电流
注意
2、离子移动方向
4、正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。
4、原电池电极的判断
特性
负极
电子流出
相对活泼
失电子
发生氧化反应
正极
电子流入
相对不活泼
得电子
发生还原反应
1、根据定义来判断:电子流出的一极是负极;电子流入的一极是正极。
2、根据反应类型来判断:发生氧化反应的一极是负极;发生还原反应的一极是正极。
3、根据电极活泼性来判断:一般来说,较活泼的一极是负极;较不活泼的一极是正极。
4、根据离子流向来判断:阴离子移向的一极是负极;阳离子移向的一极是正极。
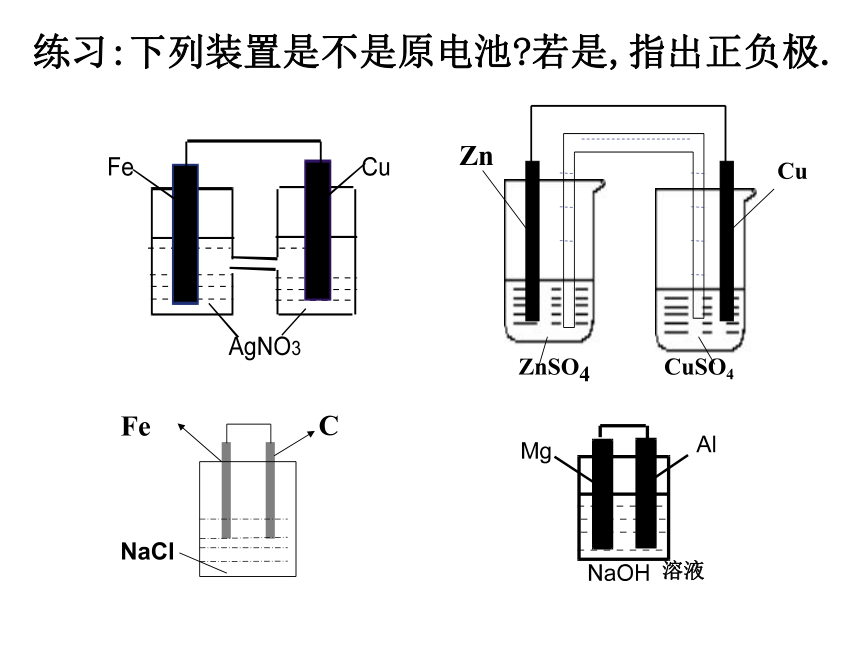
练习:下列装置是不是原电池?若是,指出正负极.
CuSO4
Zn
Cu
ZnSO4
溶液
Fe
C
NaCl
用铜片、银片、Cu
(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是(
)
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②
B.②③
C.②④
D.③④
C
[拓展]请结合组成原电池的条件,将氧化还原反应:
(1)Fe
+
Cu2+
=
Cu
+
Fe2+
(2)4A1+3O2+6H2O=4A1(OH)3
设计成一个原电池(注意有盐桥的设计)。
1、电解液:
。
2、电极材料:
正极
,负极
。
3、电极反应式
:
负极:
。
正极:
。
[归纳]
原电池的设计方法:
①怎样选择确定原电池的负极、正极材料?
②怎样选择确定原电池的电解质溶液?
③画原电池的装置图时要注意什么问题?
④怎样书写原电池的电极反应及总反应式?
5、原电池的应用
(1)制作干电池、蓄电池、高能电池等。
(2)比较金属活动性强弱。
(3)比较反应速率。
(4)比较金属腐蚀的快慢。
(5)判断溶液pH值变化。
例2:下列制氢气的反应速率最快的是(
)
A.纯锌和1mol/L
硫酸
B.纯锌和18
mol/L
硫酸
C.粗锌和
1mol/L
硫酸
D.粗锌和1mol/L
硫酸的反应中加入几滴CuSO4溶液
例1:下列叙述中,可以说明金属甲比乙活泼性强的是(
)
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2放出
B.在氧化还原反应中,甲比乙失去的电子多
C.将甲乙作电极组成原电池时甲是负极
D.同价态的阳离子,甲比乙的氧化性强
C
D
例3:下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(5)
(2)
(1)
(3)
(4)
例4:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)
(2)
(1)
(3)
例5:在Cu-Zn原电池中,200mLH2SO4
溶液的浓度为0.125mol/L
,
若工作一段时间后,从装置中共收集到
0.168L升气体,则流过导线的电子为
mol,溶液的pH值为_________?(溶液体积变化忽略不计)
0.2
解得:
y
=0.015
(mol)
x
=0.015
(mol)
=
=3.75×
10﹣
4(mol/L
)
∴pH
=-lg3.75
×10-4
=4
-lg3.75
-0.015
根据电极反应:
正极:
负极:
Zn-2e-=Zn2+
2H++2e-
=H2↑
得:
2
2
22.4
x
y
0.168
解:
0.2×0.125×2
c(H+)余
∴
2H+
——
2e——H2↑
4
-lg3.75
0.015
二、金属的腐蚀及其防护
1、概念:
金属或合金跟周围接触到的气体或液体进行化学反应(氧化还原反应)而腐蚀损耗的过程,即为金属的腐蚀。
2、本质:
3、分类:
化学腐蚀
电化腐蚀
析氢腐蚀
吸氧腐蚀
金属腐蚀
金属阳离子
失e-
氧化反应
金属原子
化学腐蚀
电化腐蚀
条件
金属跟非金属单质
直接接触
不纯金属或合金
跟电解质溶液接触
现象
无电流产生
有微弱电流产生
本质
金属被氧化
较活泼金属被氧化
图例
联系
两者往往同时发生,电化腐蚀更普遍
(1)化学腐蚀与电化腐蚀
析氢腐蚀
吸氧腐蚀
条件
水膜呈酸性
水膜呈中性或酸性很弱
电极反应
负极Fe
Fe—2e=Fe2+
2Fe—4e=2Fe2+
正极C
2H++2e=H2↑
O2+2H2O+4e=4OH—
总反应
Fe+2H+=Fe2+↑
2Fe+2H2O+O2=
2
Fe(OH)2
示意图
联系
通常两种腐蚀同时存在,但以后者更普遍。
(2)析氢腐蚀与吸氧腐蚀
(3)钢铁腐蚀的防护
1、改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。
2、金属表面覆盖保护层:如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化物薄膜)作保护层。
原理:隔绝金属与外界空气、电解质溶液的接触。
3、电化学保护法——牺牲阳极的阴极保护法
原理:形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
练
习
1。
如图,
水槽中试管内有一枚铁钉,放置数天观察:
(1)
若液面上升,则溶液呈
性,发生
腐蚀,电极反应式为:负极:
,
正极:
;
若液面下降,则溶液呈
性,发生
腐蚀,电极反应式为:负极:
正极:
。
(2)
中性或碱性
吸氧
Fe–2e-=Fe2+
O2+2H2O+4e-=4OH-
酸性
析氢
Fe–2e-=Fe2+
2H++2e-=H2↑
2、
分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、
镍—镉可充电电池可发生如下反应:
Cd+2NiO(OH)+2H2O
由此可知,该电池的负极材料是
Cd(OH)2+2Ni(OH)2
放电
充电
A.
Cd,
(
D
)
B.
NiO(OH),
D.
Ni(OH)2
C.
Cd(OH)2
2Fe+2H2O+O2=
2
Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
O2+2H2O+4e-=4OH-
2Fe–4e-=2Fe2+
4.盐酸与锌片反应时,若加入可溶性醋酸铜
〔(CH3COO)2Cu〕,将产生两种影响生成速率的因素,其
一是:
,
其二是:
;
5.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。
H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率。
Zn置换出Cu形成了原电池,从而加快了反应速率
三、电极反应式的判断和书写
1.
原电池两极的判断:先分析电池反应中有关物质元素化合价的变化,确定原电池的正极和负极,然后根据两极的变化分析其他指定物质的变化。
2.
书写电极反应时,要将总化学反应与正、负极反应
联系在一起考虑,它们具有加和性:
化学反应方程式=正极反应方程式+负极反应方程式。
3.
在原电池反应中,必须遵循得失电子守恒。
4.
介质参与电极反应的原则:原电池的两极反应若均在一定介质中进行,介质常常参与电极反应。在酸性介质中,H+可能反应,在碱性介质中,OH—可能反应。
(08宁夏卷)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是(
)
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
C
例题1
稀H2SO4
总反应为:Mg+H2SO4=MgSO4+H2↑
Mg为负极,电极反应:Mg-2e-=Mg2+
Al为正极,电极反应:2H++2e-=H2↑
NaOH溶液
思考:若把电解质溶液换为NaOH溶液,写出电极反应式。
总反应为:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al为负极
氧化反应,为负极
还原反应,为正极
Mg为正极,电极反应:6H2O+6e-=3H2↑+6OH-
2Al-6e-+8OH-=2AlO2-+4H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑
负极电极反应:
Mg为负极
请写出下列电极反应式:
例题2
负极(锌筒):
正极(石墨):
总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH
1、锌-锰干电池(碱性)
常用电池的电极反应和电池总反应式书写
2、铅蓄电池
负极Pb:
Pb+
SO42-
-2e-
=
PbSO4
正极PbO2:
PbO2+4H+
+
SO42-
+2e-
=PbSO4+2H2O
总反应:
钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,已知电池内Zn的氧化产物为ZnO。
3、银-锌电池
负极:Zn+
2OH-
-2e-
=ZnO+H2O
正极:Ag2O+
H2O
+2e-
=2Ag+
2OH-
总反应:Ag2O+
Zn
=ZnO+
2Ag
4、燃料电池
(1)写出正确的燃烧反应化学方程式并找出两极放电的物质,负氧正还;
(2)根据电解液(如溶液的酸碱性)改写燃料电池总反应;
(3)写出正极的电极反应式;
(4)由燃料电池总反应式减去正极的电极反应式得到负极的电极反应式。
练习1、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出图中甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式
。
KOH溶液
CH4
O2
H2O
a
b
CH4+10OH-
-
8e-=CO32-
+7H2O
CH4+2O2+2KOH=K2CO3+3H2O
练习2、熔融盐燃料电池具有高的发电效率,因而受到重视.可用Li2CO3和Na2CO3的熔融盐混合物用电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在6500℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:
,
正极反应式:O2+2CO2+4e=2CO32-
总电池反应
式:
.
2CO+2CO32--4e-
=4CO2
2CO+O2=2CO2
解析:本题中CO为还原剂,空气中O2为氧化剂,电池总反应式为:2CO+O2==2CO2。用总反应式减去电池负极(即题目指的阳极)反应式,就可得到电池正极(即题目指的阴极)反应式:O2+2CO2+4e-==
2CO32-
。
练习3:有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是(
)
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式:
CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为:
O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
A.①②
B.①③
C.①④
D.③④
A
5、海水电池(电解质溶液为海水)
负极:4Al-12e—=4Al3+
正极:3O2+6H2O+12e—=12OH—
总反应:4Al+3O2+6H2O=4Al(OH)3
跟相同质量的其它金属作负极相比,使用寿命延长,高能、质轻、电压高、工作效率高、储存寿命长。
4.1原电池
知识目标
(1)原电池原理、构成条件、电极名称的判断。
(2)电极反应方程式的书写。
(3)金属腐蚀、电化腐蚀、吸氧腐蚀、析氢腐蚀的一般概念。
(4)生活中常见的化学电源的认识。
(5)利用原电池概念理解金属腐蚀跟防腐的联系。
原电池
原电池简单计算
各种电极反应
、化学电源池的原理和应用
金属的腐蚀及其防护
构成原电池条件、原电池原理
知识结构
一、原电池
1、概念:
将化学能转化成电能的装置叫做原电池。
原电池与普通氧化还原反应的差异
原电池将化学能转变为电能
不同点
原电池反应快
反应部位
反应速率
能量变化
负极失去电子发生氧化反应
正极得到电子发生还原反应
2、构成原电池的条件
(1)必须自发进行氧化还原反应;
(3)两个电极必须插入电解质溶液中或熔融的电
解质中;
(4)两个电极必须相连并形成闭合回路。
(2)必须有两种活泼性不同的导电材料作电极;
两种活泼不同的金属。
一种金属与一种非金属(如石墨)。
两电极都是其它材料。
电极材料
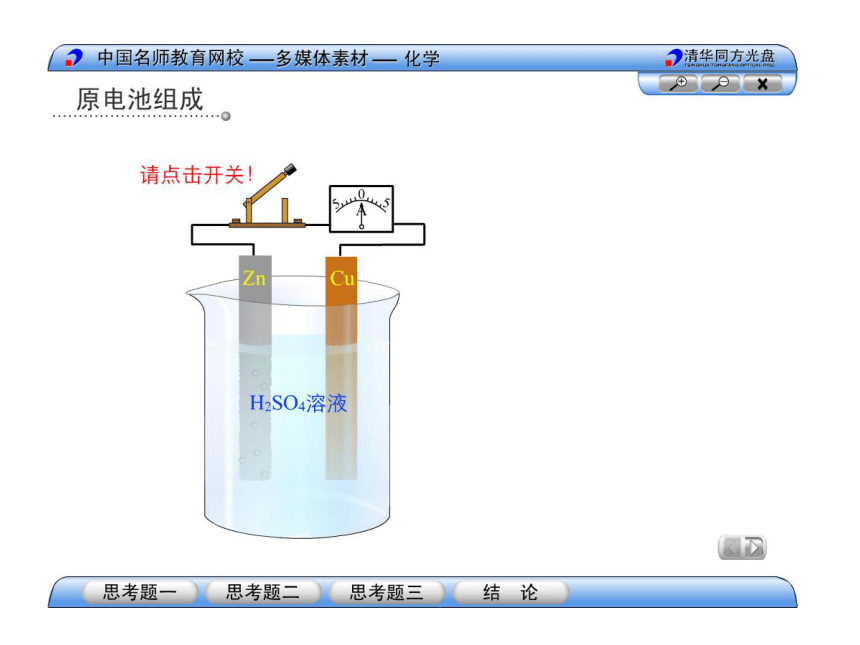
3、原电池工作原理
e-
I
-:Zn-2e-=Zn2+
+:2H++2e-=H2↑
溶液中
离子流向
电子流向
电极反应
阴离子
负极
氧化反应
电子经外导线
正极
阳离子
还原反应
1、原电池的反应原理
发生氧化还原反应
化学能转化为电能
阳离子
正极
阴离子
负极
3、溶液内部无电子流动,通过阴阳离子定向移动实现内电路的电流
注意
2、离子移动方向
4、正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。
4、原电池电极的判断
特性
负极
电子流出
相对活泼
失电子
发生氧化反应
正极
电子流入
相对不活泼
得电子
发生还原反应
1、根据定义来判断:电子流出的一极是负极;电子流入的一极是正极。
2、根据反应类型来判断:发生氧化反应的一极是负极;发生还原反应的一极是正极。
3、根据电极活泼性来判断:一般来说,较活泼的一极是负极;较不活泼的一极是正极。
4、根据离子流向来判断:阴离子移向的一极是负极;阳离子移向的一极是正极。
练习:下列装置是不是原电池?若是,指出正负极.
CuSO4
Zn
Cu
ZnSO4
溶液
Fe
C
NaCl
用铜片、银片、Cu
(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是(
)
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②
B.②③
C.②④
D.③④
C
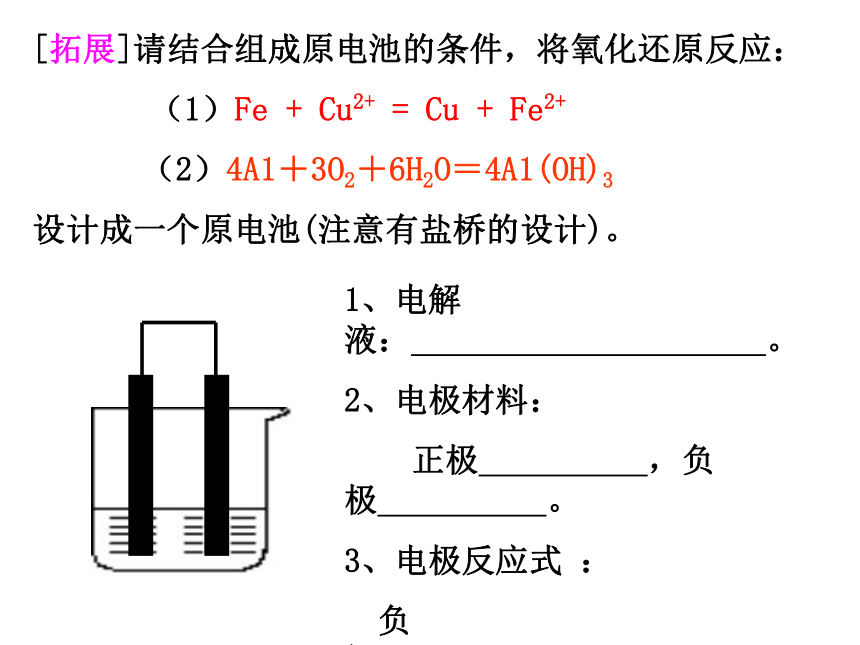
[拓展]请结合组成原电池的条件,将氧化还原反应:
(1)Fe
+
Cu2+
=
Cu
+
Fe2+
(2)4A1+3O2+6H2O=4A1(OH)3
设计成一个原电池(注意有盐桥的设计)。
1、电解液:
。
2、电极材料:
正极
,负极
。
3、电极反应式
:
负极:
。
正极:
。
[归纳]
原电池的设计方法:
①怎样选择确定原电池的负极、正极材料?
②怎样选择确定原电池的电解质溶液?
③画原电池的装置图时要注意什么问题?
④怎样书写原电池的电极反应及总反应式?
5、原电池的应用
(1)制作干电池、蓄电池、高能电池等。
(2)比较金属活动性强弱。
(3)比较反应速率。
(4)比较金属腐蚀的快慢。
(5)判断溶液pH值变化。
例2:下列制氢气的反应速率最快的是(
)
A.纯锌和1mol/L
硫酸
B.纯锌和18
mol/L
硫酸
C.粗锌和
1mol/L
硫酸
D.粗锌和1mol/L
硫酸的反应中加入几滴CuSO4溶液
例1:下列叙述中,可以说明金属甲比乙活泼性强的是(
)
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2放出
B.在氧化还原反应中,甲比乙失去的电子多
C.将甲乙作电极组成原电池时甲是负极
D.同价态的阳离子,甲比乙的氧化性强
C
D
例3:下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(5)
(2)
(1)
(3)
(4)
例4:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)
(2)
(1)
(3)
例5:在Cu-Zn原电池中,200mLH2SO4
溶液的浓度为0.125mol/L
,
若工作一段时间后,从装置中共收集到
0.168L升气体,则流过导线的电子为
mol,溶液的pH值为_________?(溶液体积变化忽略不计)
0.2
解得:
y
=0.015
(mol)
x
=0.015
(mol)
=
=3.75×
10﹣
4(mol/L
)
∴pH
=-lg3.75
×10-4
=4
-lg3.75
-0.015
根据电极反应:
正极:
负极:
Zn-2e-=Zn2+
2H++2e-
=H2↑
得:
2
2
22.4
x
y
0.168
解:
0.2×0.125×2
c(H+)余
∴
2H+
——
2e——H2↑
4
-lg3.75
0.015
二、金属的腐蚀及其防护
1、概念:
金属或合金跟周围接触到的气体或液体进行化学反应(氧化还原反应)而腐蚀损耗的过程,即为金属的腐蚀。
2、本质:
3、分类:
化学腐蚀
电化腐蚀
析氢腐蚀
吸氧腐蚀
金属腐蚀
金属阳离子
失e-
氧化反应
金属原子
化学腐蚀
电化腐蚀
条件
金属跟非金属单质
直接接触
不纯金属或合金
跟电解质溶液接触
现象
无电流产生
有微弱电流产生
本质
金属被氧化
较活泼金属被氧化
图例
联系
两者往往同时发生,电化腐蚀更普遍
(1)化学腐蚀与电化腐蚀
析氢腐蚀
吸氧腐蚀
条件
水膜呈酸性
水膜呈中性或酸性很弱
电极反应
负极Fe
Fe—2e=Fe2+
2Fe—4e=2Fe2+
正极C
2H++2e=H2↑
O2+2H2O+4e=4OH—
总反应
Fe+2H+=Fe2+↑
2Fe+2H2O+O2=
2
Fe(OH)2
示意图
联系
通常两种腐蚀同时存在,但以后者更普遍。
(2)析氢腐蚀与吸氧腐蚀
(3)钢铁腐蚀的防护
1、改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。
2、金属表面覆盖保护层:如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化物薄膜)作保护层。
原理:隔绝金属与外界空气、电解质溶液的接触。
3、电化学保护法——牺牲阳极的阴极保护法
原理:形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。
练
习
1。
如图,
水槽中试管内有一枚铁钉,放置数天观察:
(1)
若液面上升,则溶液呈
性,发生
腐蚀,电极反应式为:负极:
,
正极:
;
若液面下降,则溶液呈
性,发生
腐蚀,电极反应式为:负极:
正极:
。
(2)
中性或碱性
吸氧
Fe–2e-=Fe2+
O2+2H2O+4e-=4OH-
酸性
析氢
Fe–2e-=Fe2+
2H++2e-=H2↑
2、
分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、
镍—镉可充电电池可发生如下反应:
Cd+2NiO(OH)+2H2O
由此可知,该电池的负极材料是
Cd(OH)2+2Ni(OH)2
放电
充电
A.
Cd,
(
D
)
B.
NiO(OH),
D.
Ni(OH)2
C.
Cd(OH)2
2Fe+2H2O+O2=
2
Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
O2+2H2O+4e-=4OH-
2Fe–4e-=2Fe2+
4.盐酸与锌片反应时,若加入可溶性醋酸铜
〔(CH3COO)2Cu〕,将产生两种影响生成速率的因素,其
一是:
,
其二是:
;
5.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。
H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率。
Zn置换出Cu形成了原电池,从而加快了反应速率
三、电极反应式的判断和书写
1.
原电池两极的判断:先分析电池反应中有关物质元素化合价的变化,确定原电池的正极和负极,然后根据两极的变化分析其他指定物质的变化。
2.
书写电极反应时,要将总化学反应与正、负极反应
联系在一起考虑,它们具有加和性:
化学反应方程式=正极反应方程式+负极反应方程式。
3.
在原电池反应中,必须遵循得失电子守恒。
4.
介质参与电极反应的原则:原电池的两极反应若均在一定介质中进行,介质常常参与电极反应。在酸性介质中,H+可能反应,在碱性介质中,OH—可能反应。
(08宁夏卷)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是(
)
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
C
例题1
稀H2SO4
总反应为:Mg+H2SO4=MgSO4+H2↑
Mg为负极,电极反应:Mg-2e-=Mg2+
Al为正极,电极反应:2H++2e-=H2↑
NaOH溶液
思考:若把电解质溶液换为NaOH溶液,写出电极反应式。
总反应为:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al为负极
氧化反应,为负极
还原反应,为正极
Mg为正极,电极反应:6H2O+6e-=3H2↑+6OH-
2Al-6e-+8OH-=2AlO2-+4H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑
负极电极反应:
Mg为负极
请写出下列电极反应式:
例题2
负极(锌筒):
正极(石墨):
总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH
1、锌-锰干电池(碱性)
常用电池的电极反应和电池总反应式书写
2、铅蓄电池
负极Pb:
Pb+
SO42-
-2e-
=
PbSO4
正极PbO2:
PbO2+4H+
+
SO42-
+2e-
=PbSO4+2H2O
总反应:
钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,已知电池内Zn的氧化产物为ZnO。
3、银-锌电池
负极:Zn+
2OH-
-2e-
=ZnO+H2O
正极:Ag2O+
H2O
+2e-
=2Ag+
2OH-
总反应:Ag2O+
Zn
=ZnO+
2Ag
4、燃料电池
(1)写出正确的燃烧反应化学方程式并找出两极放电的物质,负氧正还;
(2)根据电解液(如溶液的酸碱性)改写燃料电池总反应;
(3)写出正极的电极反应式;
(4)由燃料电池总反应式减去正极的电极反应式得到负极的电极反应式。
练习1、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出图中甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式
。
KOH溶液
CH4
O2
H2O
a
b
CH4+10OH-
-
8e-=CO32-
+7H2O
CH4+2O2+2KOH=K2CO3+3H2O
练习2、熔融盐燃料电池具有高的发电效率,因而受到重视.可用Li2CO3和Na2CO3的熔融盐混合物用电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在6500℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:
,
正极反应式:O2+2CO2+4e=2CO32-
总电池反应
式:
.
2CO+2CO32--4e-
=4CO2
2CO+O2=2CO2
解析:本题中CO为还原剂,空气中O2为氧化剂,电池总反应式为:2CO+O2==2CO2。用总反应式减去电池负极(即题目指的阳极)反应式,就可得到电池正极(即题目指的阴极)反应式:O2+2CO2+4e-==
2CO32-
。
练习3:有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是(
)
①每消耗1molCH4可以向外电路提供8mole-
②负极上CH4失去电子,电极反应式:
CH4+10OH--8e-=CO32-+7H2O
③负极上是O2获得电子,电极反应式为:
O2+2H2O+4e-=4OH-
④电池放电后,溶液PH不断升高
A.①②
B.①③
C.①④
D.③④
A
5、海水电池(电解质溶液为海水)
负极:4Al-12e—=4Al3+
正极:3O2+6H2O+12e—=12OH—
总反应:4Al+3O2+6H2O=4Al(OH)3
跟相同质量的其它金属作负极相比,使用寿命延长,高能、质轻、电压高、工作效率高、储存寿命长。
