人教版高中化学选修五第1节:醇 酚 课件(28张PPT)
文档属性
| 名称 | 人教版高中化学选修五第1节:醇 酚 课件(28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 546.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-15 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
烃的含氧衍生物
烃分子里的氢原子被含有
的原子团取代衍生而成的化合物
种类:
按所含官能团的不同可分为醇、酚、醛、羧酸和酯等
性质:
由官能团决定
氧原子
第一节
醇
酚
醇:
羟基与
或苯环侧链上的碳原子
相连的化合物
酚:
羟基与苯环直接相连的化合物
烃基
CH3CHCH3
OH
CH2OH
OH
CH3
①
②
③
一、醇
(一)
醇的分类
饱和一元醇的通式:
CnH2n+2O
或
CnH2n+1OH
根据分子里羟基的数目
一元醇
二元醇
多元醇
根据烃基种类不同
饱和醇
不饱和醇
。。。。。。
(二)命名:
①选主链:
选含有-OH的最长碳链
从离-OH最近的一端编起
③写名称:
取代基位置—取代基名称—羟基位置
—母体名称
同分异构体:
碳链异构
官能团(-OH)位置异构
种类异构
(
醚
)
②编号:
例:写出C4H10O的同分异构体,并命名。
CH3—CH—CH2—OH
CH3
2—甲基—1—丙醇
(三)
物理性质:
①甲醇、乙醇、丙醇为无色中性液体,与水以任意比互溶;
(Cn)4~11
:油状液体,可部分溶于水;
(Cn)
12个C以上:无色、无味的蜡状固体,
不溶于水。
②醇的沸点随分子里碳原子数的递增而逐渐升高
③M相近的醇与烷烃,醇的沸点远高于烷烃
④同C时,随羟基数目增多,沸点也随着升高
思考与交流:
教材P49
分析:
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃,是由于醇分子中氧原子吸引电子的能力很强,使分子具有较强的极性,醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着氢键。同时,低碳醇分子与水分子间也存在着氢键,所以具有良好的水溶性。
HF、H2O、NH3之间存在氢键
学与问:
教材P49
分析:
由于羟基数目增多,使分子间形成的氢键就增多、增强,所以沸点就升高。
(四)
乙醇
1.
物理性质
①无色、透明、特殊香味的液体;密度比水小
②能溶于水,与水以任意比互溶,能溶解多种有机物和无机物。
③沸点78℃,熔点-117.3℃;易挥发。
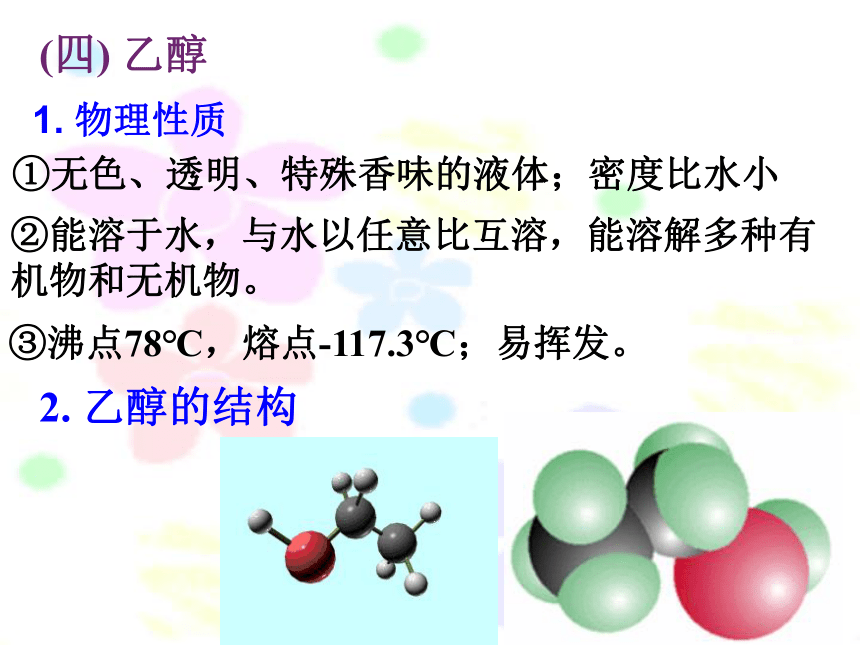
2.
乙醇的结构
3.
化学性质
思考:前面学习了乙醇的哪些化学性质?
(1)取代反应
a.
乙醇与金属钠的反应
c.
乙醇与HBr的反应
d.
乙醇分子间的脱水反应
b.
酯化反应
(2)氧化反应
a.乙醇的燃烧
b.乙醇的催化氧化
(3)消去反应
(1)
取代反应
a.
乙醇与金属钠的反应
c.
乙醇与HBr的反应
C2H5-OH
+
H-Br
→
C2H5-Br
+
H2O
△
d.
乙醇分子间的脱水反应
2CH3CH2OH
CH3CH2OCH2
CH3+
H2O
浓H2SO4
1400C
b.
酯化反应
2C2H5OH+2Na
→
2C2H5ONa+H2↑
CH3—C—OH+H—O—C2H5
CH3—C—O—C2H5
+
H2O
浓H2SO4
=
=
O
O
(2)氧化反应
a.乙醇的燃烧
b.乙醇的催化氧化
2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
Cu或Ag
催化氧化的条件:
同C有H
练习:写出2—丙醇的催化氧化反应的方程式
c.被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化
K2Cr2O7
(有氧化性)
橙色
Cr2(SO4)3
绿色
乙醇
CH3CH2
OH
乙醇
CH3CHO
乙醛
CH3COOH
乙酸
氧化
氧化
氧化过程:
实验3-1:
仪器、装置、操作
NaOH
H2SO4
注意事项:
1、配制混合液的方法
2、放碎瓷片的原因
3、温度计水银球的位置
4、气体的净化
(3)消去反应
浓H2SO4
1700C
H
C
C
H
CH2=CH2
+H2O
H
H
H
OH
消去反应的条件:
邻C有H
浓硫酸的作用:脱水剂、催化剂
1.混合乙醇和浓硫酸的比例、顺序如何?
2.为什么要用温度计?温度计水银球是否 应插入液面以下,为什么?
3.为什么在反应液中放入碎瓷片?
4.为什么反应需迅速升高到1700C?
5.反应过程中烧瓶中液体颜色有无改变?
浓硫酸与乙醇的体积比为3:1,混合时应将浓硫酸缓缓加入乙醇中并不断搅拌。
资料卡片:有机物的氧化、还原反应
氧化反应:有机物分子中失去
原子
或加入
原子的反应.
还原反应:有机物分子中加入
原子
或失去
原子的反应.
氢
氢
氧
氧
(2)二元醇:乙二醇
①
物性:无色、粘稠、有甜味的液体;易溶于水和乙醇。
②用途:常作内燃机的冷冻剂;是重要的化工原料。
5、
几种重要的醇
(1)一元醇:甲醇、乙醇
甲醇俗称木精,是无色透明液体,有毒
(3)三元醇:丙三醇
②用途:作甜味添加剂;作防冻剂和制冷剂;用于配制化妆品。
①
物性:无色、粘稠、有甜味的液体;易溶于水和乙醇;
吸湿性强。
1、等质量的铜片灼热后,立即插入下列溶液中,放置片刻后铜片质量增加的是(
)
A.
硝酸
B.
无水乙醇
C.
石灰水
D.
盐酸
C
练习:
2、在常压和100℃条件下把乙醇气化为蒸气,然后和乙烯以任意比混合,其混合气体为V
L,将其完全燃烧,需消耗相同条件下的氧气的体积是(
)
A.
2V
L
B.
2.5V
L
C.
3V
L
D.
无法计算
C
3、已知在浓硫酸存在并加热至140℃的条件下,2个醇分子发生分子间脱水反应生成醚。用浓硫酸跟乙醇和丙醇的混合液反应,可得到醚的种类有(
)
A.
1种
B.
3种
C.
5种
D.
6种
D
4、现有下列一元醇
可发生消去反应的是(
),可发生催化氧化的是(
)
A.
B.
C.
D.
BC
ACD
二、酚
1、酚的概念
2、苯酚
(1)物理性质
纯净的苯酚是没有颜色的晶体,具有特殊的气味,熔点是43℃,露置在空气中因小部分发生氧化而显粉红色。常温时,苯酚在水中溶解度不大,当温度高于65℃时,能跟水以任意比互溶。苯酚易溶于乙醇,乙醚等有机溶剂。苯酚有毒,其浓溶液对皮肤有强烈的腐蚀性,使用时要小心!如果不慎沾到皮肤上,应立即用酒精洗涤。
(2)分子结构
分子式:
结构式:
结构简式:
C6H6O
比例模型:
(3)化学性质
①苯酚的弱酸性
实验3-3:
实验
现象
1、向盛有少量苯酚晶体的试管中加入2mL蒸馏水,振荡试管.
2、向试管中逐滴加入5%的NaOH溶液,并振荡试管。
3、再向试管中加入盐酸
形成了浑浊的液体
浑浊的液体变澄清
澄清的液体又变浑浊
OH
ONa
+
NaOH
+
H2O
OH
ONa
+
HCl
+
NaCl
OH
ONa
+
H2O
+CO2
+
NaHCO3
醋酸
>
碳酸
>
苯酚
>
HCO3-
②苯酚的取代反应
实验3-4:
向盛有少量苯酚稀溶液的试管里滴入过量的浓溴水
现象:
立即有白色沉淀产生
反应方程式:
※
此反应用于苯酚的定性和定量检验
OH
+3Br2
+3HBr
Br
—Br
OH
Br—
③苯酚的加成反应
OH
+3H2
?
OH
④苯酚的显色反应
步骤:
现象:
向盛有苯酚溶液的试管里滴入几滴FeCl3溶液,振荡
立即形成紫色溶液
结论:
苯酚与FeCl3
反应,溶液变紫色
※
此反应用于苯酚的定性检验
⑤苯酚的氧化反应
苯酚
空气
粉红色物质
苯酚
点燃
CO2和H2O
苯酚能被酸性KMnO4溶液等氧化
④苯酚的显色反应
苯酚与FeCl3
反应,溶液变紫色
⑤苯酚的氧化反应
苯酚能被氧气、酸性KMnO4溶液等氧化
③苯酚的加成反应
OH
+3H2
?
OH
小结:苯酚的化学性质
①苯酚的弱酸性
醋酸
>
碳酸
>
苯酚
>
HCO3-
酸性:
②苯酚的取代反应
OH
+3Br2
+3HBr
Br
—Br
OH
Br—
学与问:
教材P54
分析:
由于苯酚羟基氧上的孤电子对与苯环之间的相互作用,使得羟基氧上的孤电子的电子云向苯环转移,其结果是增强了苯环的活性,尤其是苯酚的邻对位电子云密度增加比间位多,邻对位的活性较大;同时也使苯酚羟基易电离出H+,增强了酸性。
(4)苯酚的用途
①制酚醛树脂、合成纤维、医药、染料、农药
②可用于环境消毒
③可制成洗剂和软膏,有杀菌、止痛作用
④是合成阿司匹林的原料
小结:
苯酚的化学性质:
弱酸性、取代反应、加成反应显色反应、氧化反应
苯酚与苯取代反应的比较:
苯酚
苯
反应物
反应条件
取代苯环上氢原子数
结论
原因
溴
水与苯酚反应
液溴与纯苯
不用催化剂
Fe作催化剂
一次取代苯环上
三个氢原子
一次取代苯环上
一个氢原子
苯酚与溴取代反应比苯容易
酚羟基对苯环影响,使苯环上氢原子变得活泼
2、丁香油酚的结构简式为
从它的结构简式推测它不可能有的化学性质是(
)
A
既可燃烧,也可使酸性KMnO4溶液褪色
B
可与NaHCO3溶液反应放出CO2气体
C
可与FeCl3溶液发生显色反应
D
既可与Br2发生加成反应又可发生取代反应
HO—
—CH2—CH=CH2
OCH3
1、用一种(
)试剂,可以把苯酚、乙醇、NaOH、KSCN四种溶液鉴别开来?现象分别是(
)
FeCl3溶液
紫色溶液、无现象、红褐色沉淀、血红色溶液
练习:
B
烃的含氧衍生物
烃分子里的氢原子被含有
的原子团取代衍生而成的化合物
种类:
按所含官能团的不同可分为醇、酚、醛、羧酸和酯等
性质:
由官能团决定
氧原子
第一节
醇
酚
醇:
羟基与
或苯环侧链上的碳原子
相连的化合物
酚:
羟基与苯环直接相连的化合物
烃基
CH3CHCH3
OH
CH2OH
OH
CH3
①
②
③
一、醇
(一)
醇的分类
饱和一元醇的通式:
CnH2n+2O
或
CnH2n+1OH
根据分子里羟基的数目
一元醇
二元醇
多元醇
根据烃基种类不同
饱和醇
不饱和醇
。。。。。。
(二)命名:
①选主链:
选含有-OH的最长碳链
从离-OH最近的一端编起
③写名称:
取代基位置—取代基名称—羟基位置
—母体名称
同分异构体:
碳链异构
官能团(-OH)位置异构
种类异构
(
醚
)
②编号:
例:写出C4H10O的同分异构体,并命名。
CH3—CH—CH2—OH
CH3
2—甲基—1—丙醇
(三)
物理性质:
①甲醇、乙醇、丙醇为无色中性液体,与水以任意比互溶;
(Cn)4~11
:油状液体,可部分溶于水;
(Cn)
12个C以上:无色、无味的蜡状固体,
不溶于水。
②醇的沸点随分子里碳原子数的递增而逐渐升高
③M相近的醇与烷烃,醇的沸点远高于烷烃
④同C时,随羟基数目增多,沸点也随着升高
思考与交流:
教材P49
分析:
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃,是由于醇分子中氧原子吸引电子的能力很强,使分子具有较强的极性,醇分子中羟基的氧原子与另一醇分子中羟基的氢原子间存在着氢键。同时,低碳醇分子与水分子间也存在着氢键,所以具有良好的水溶性。
HF、H2O、NH3之间存在氢键
学与问:
教材P49
分析:
由于羟基数目增多,使分子间形成的氢键就增多、增强,所以沸点就升高。
(四)
乙醇
1.
物理性质
①无色、透明、特殊香味的液体;密度比水小
②能溶于水,与水以任意比互溶,能溶解多种有机物和无机物。
③沸点78℃,熔点-117.3℃;易挥发。
2.
乙醇的结构
3.
化学性质
思考:前面学习了乙醇的哪些化学性质?
(1)取代反应
a.
乙醇与金属钠的反应
c.
乙醇与HBr的反应
d.
乙醇分子间的脱水反应
b.
酯化反应
(2)氧化反应
a.乙醇的燃烧
b.乙醇的催化氧化
(3)消去反应
(1)
取代反应
a.
乙醇与金属钠的反应
c.
乙醇与HBr的反应
C2H5-OH
+
H-Br
→
C2H5-Br
+
H2O
△
d.
乙醇分子间的脱水反应
2CH3CH2OH
CH3CH2OCH2
CH3+
H2O
浓H2SO4
1400C
b.
酯化反应
2C2H5OH+2Na
→
2C2H5ONa+H2↑
CH3—C—OH+H—O—C2H5
CH3—C—O—C2H5
+
H2O
浓H2SO4
=
=
O
O
(2)氧化反应
a.乙醇的燃烧
b.乙醇的催化氧化
2CH3CH2OH
+
O2
2CH3CHO
+
2H2O
Cu或Ag
催化氧化的条件:
同C有H
练习:写出2—丙醇的催化氧化反应的方程式
c.被酸性高锰酸钾溶液或酸性重铬酸钾溶液氧化
K2Cr2O7
(有氧化性)
橙色
Cr2(SO4)3
绿色
乙醇
CH3CH2
OH
乙醇
CH3CHO
乙醛
CH3COOH
乙酸
氧化
氧化
氧化过程:
实验3-1:
仪器、装置、操作
NaOH
H2SO4
注意事项:
1、配制混合液的方法
2、放碎瓷片的原因
3、温度计水银球的位置
4、气体的净化
(3)消去反应
浓H2SO4
1700C
H
C
C
H
CH2=CH2
+H2O
H
H
H
OH
消去反应的条件:
邻C有H
浓硫酸的作用:脱水剂、催化剂
1.混合乙醇和浓硫酸的比例、顺序如何?
2.为什么要用温度计?温度计水银球是否 应插入液面以下,为什么?
3.为什么在反应液中放入碎瓷片?
4.为什么反应需迅速升高到1700C?
5.反应过程中烧瓶中液体颜色有无改变?
浓硫酸与乙醇的体积比为3:1,混合时应将浓硫酸缓缓加入乙醇中并不断搅拌。
资料卡片:有机物的氧化、还原反应
氧化反应:有机物分子中失去
原子
或加入
原子的反应.
还原反应:有机物分子中加入
原子
或失去
原子的反应.
氢
氢
氧
氧
(2)二元醇:乙二醇
①
物性:无色、粘稠、有甜味的液体;易溶于水和乙醇。
②用途:常作内燃机的冷冻剂;是重要的化工原料。
5、
几种重要的醇
(1)一元醇:甲醇、乙醇
甲醇俗称木精,是无色透明液体,有毒
(3)三元醇:丙三醇
②用途:作甜味添加剂;作防冻剂和制冷剂;用于配制化妆品。
①
物性:无色、粘稠、有甜味的液体;易溶于水和乙醇;
吸湿性强。
1、等质量的铜片灼热后,立即插入下列溶液中,放置片刻后铜片质量增加的是(
)
A.
硝酸
B.
无水乙醇
C.
石灰水
D.
盐酸
C
练习:
2、在常压和100℃条件下把乙醇气化为蒸气,然后和乙烯以任意比混合,其混合气体为V
L,将其完全燃烧,需消耗相同条件下的氧气的体积是(
)
A.
2V
L
B.
2.5V
L
C.
3V
L
D.
无法计算
C
3、已知在浓硫酸存在并加热至140℃的条件下,2个醇分子发生分子间脱水反应生成醚。用浓硫酸跟乙醇和丙醇的混合液反应,可得到醚的种类有(
)
A.
1种
B.
3种
C.
5种
D.
6种
D
4、现有下列一元醇
可发生消去反应的是(
),可发生催化氧化的是(
)
A.
B.
C.
D.
BC
ACD
二、酚
1、酚的概念
2、苯酚
(1)物理性质
纯净的苯酚是没有颜色的晶体,具有特殊的气味,熔点是43℃,露置在空气中因小部分发生氧化而显粉红色。常温时,苯酚在水中溶解度不大,当温度高于65℃时,能跟水以任意比互溶。苯酚易溶于乙醇,乙醚等有机溶剂。苯酚有毒,其浓溶液对皮肤有强烈的腐蚀性,使用时要小心!如果不慎沾到皮肤上,应立即用酒精洗涤。
(2)分子结构
分子式:
结构式:
结构简式:
C6H6O
比例模型:
(3)化学性质
①苯酚的弱酸性
实验3-3:
实验
现象
1、向盛有少量苯酚晶体的试管中加入2mL蒸馏水,振荡试管.
2、向试管中逐滴加入5%的NaOH溶液,并振荡试管。
3、再向试管中加入盐酸
形成了浑浊的液体
浑浊的液体变澄清
澄清的液体又变浑浊
OH
ONa
+
NaOH
+
H2O
OH
ONa
+
HCl
+
NaCl
OH
ONa
+
H2O
+CO2
+
NaHCO3
醋酸
>
碳酸
>
苯酚
>
HCO3-
②苯酚的取代反应
实验3-4:
向盛有少量苯酚稀溶液的试管里滴入过量的浓溴水
现象:
立即有白色沉淀产生
反应方程式:
※
此反应用于苯酚的定性和定量检验
OH
+3Br2
+3HBr
Br
—Br
OH
Br—
③苯酚的加成反应
OH
+3H2
?
OH
④苯酚的显色反应
步骤:
现象:
向盛有苯酚溶液的试管里滴入几滴FeCl3溶液,振荡
立即形成紫色溶液
结论:
苯酚与FeCl3
反应,溶液变紫色
※
此反应用于苯酚的定性检验
⑤苯酚的氧化反应
苯酚
空气
粉红色物质
苯酚
点燃
CO2和H2O
苯酚能被酸性KMnO4溶液等氧化
④苯酚的显色反应
苯酚与FeCl3
反应,溶液变紫色
⑤苯酚的氧化反应
苯酚能被氧气、酸性KMnO4溶液等氧化
③苯酚的加成反应
OH
+3H2
?
OH
小结:苯酚的化学性质
①苯酚的弱酸性
醋酸
>
碳酸
>
苯酚
>
HCO3-
酸性:
②苯酚的取代反应
OH
+3Br2
+3HBr
Br
—Br
OH
Br—
学与问:
教材P54
分析:
由于苯酚羟基氧上的孤电子对与苯环之间的相互作用,使得羟基氧上的孤电子的电子云向苯环转移,其结果是增强了苯环的活性,尤其是苯酚的邻对位电子云密度增加比间位多,邻对位的活性较大;同时也使苯酚羟基易电离出H+,增强了酸性。
(4)苯酚的用途
①制酚醛树脂、合成纤维、医药、染料、农药
②可用于环境消毒
③可制成洗剂和软膏,有杀菌、止痛作用
④是合成阿司匹林的原料
小结:
苯酚的化学性质:
弱酸性、取代反应、加成反应显色反应、氧化反应
苯酚与苯取代反应的比较:
苯酚
苯
反应物
反应条件
取代苯环上氢原子数
结论
原因
溴
水与苯酚反应
液溴与纯苯
不用催化剂
Fe作催化剂
一次取代苯环上
三个氢原子
一次取代苯环上
一个氢原子
苯酚与溴取代反应比苯容易
酚羟基对苯环影响,使苯环上氢原子变得活泼
2、丁香油酚的结构简式为
从它的结构简式推测它不可能有的化学性质是(
)
A
既可燃烧,也可使酸性KMnO4溶液褪色
B
可与NaHCO3溶液反应放出CO2气体
C
可与FeCl3溶液发生显色反应
D
既可与Br2发生加成反应又可发生取代反应
HO—
—CH2—CH=CH2
OCH3
1、用一种(
)试剂,可以把苯酚、乙醇、NaOH、KSCN四种溶液鉴别开来?现象分别是(
)
FeCl3溶液
紫色溶液、无现象、红褐色沉淀、血红色溶液
练习:
B
