人教版高中化学选修4-3.1弱电解质的电离(21张PPT)
文档属性
| 名称 | 人教版高中化学选修4-3.1弱电解质的电离(21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 675.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-16 20:59:12 | ||
图片预览






文档简介
(共21张PPT)
第三章
水溶液中的离子平衡
第一节
弱电解质的电离
学习目的和要求
认识强电解质和弱电解质的概念。
理解电解质的电离平衡概念,加深对动态平衡的认识。
理解导电性强弱与电解质强弱的关系。
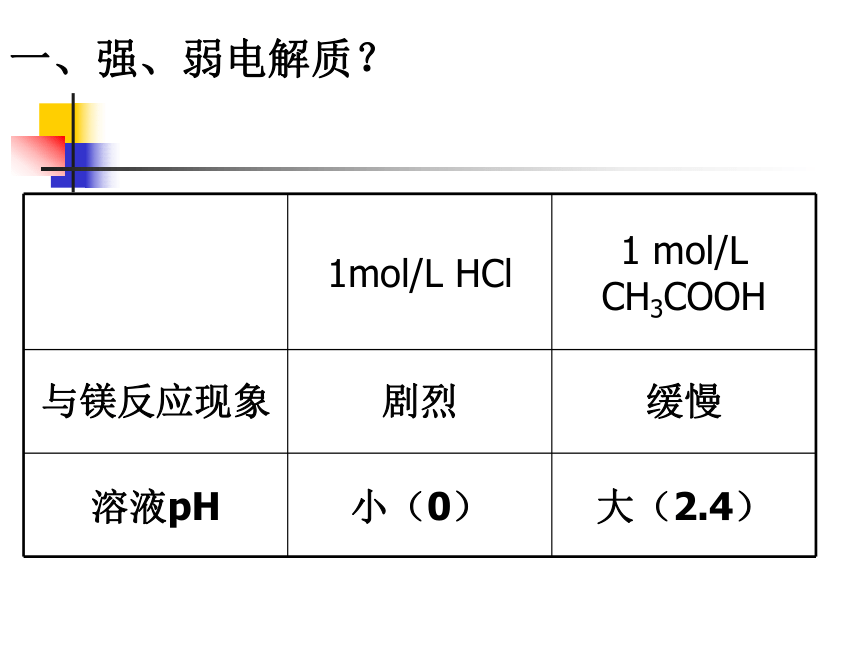
一、强、弱电解质?
1mol/L
HCl
1
mol/L
CH3COOH
与镁反应现象
剧烈
缓慢
溶液pH
小(0)
大(2.4)
试验结果分析
离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要用活化能来引发的反应。
反应速率不同,pH不同,说明盐酸和醋酸中的H+浓度是不同的。
相同体积、相同浓度的盐酸和醋酸中H+浓度却不同,说明HCl和CH3COOH的电离程度不同。
强电解质:
弱电解质:
在水溶液里或熔融状态下全部电离成离子的电解质(其离子无
分子化倾向)。包括大多数盐类、强酸、强碱。
在水溶液里部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O)、水。
NaCl
=
Na++Cl-
HAc
H++Ac-
练习1
下列物质属于强电解质的是__
_,属于弱电解质的是__
_,属于非电解质的是
_
.
a.铜丝
b.金刚石
c.石墨
d.NaCl
e.盐酸
f.蔗糖
g.CO2
h.Na2O
i.硬脂酸
j.醋酸
k.碳酸
l.碳酸氢铵
m.氢氧化铝
n.氯气
o.
BaSO4
d.h.l.o
i.j.k.m.
f.g.
练习2
可以证明醋酸是弱电解质的是(
)
A、0.1mol/L的醋酸溶液pH约为2
B、醋酸能与水以任意比互溶
C、溶液的导电能力比盐酸弱
D、溶液中存在醋酸分子
BD
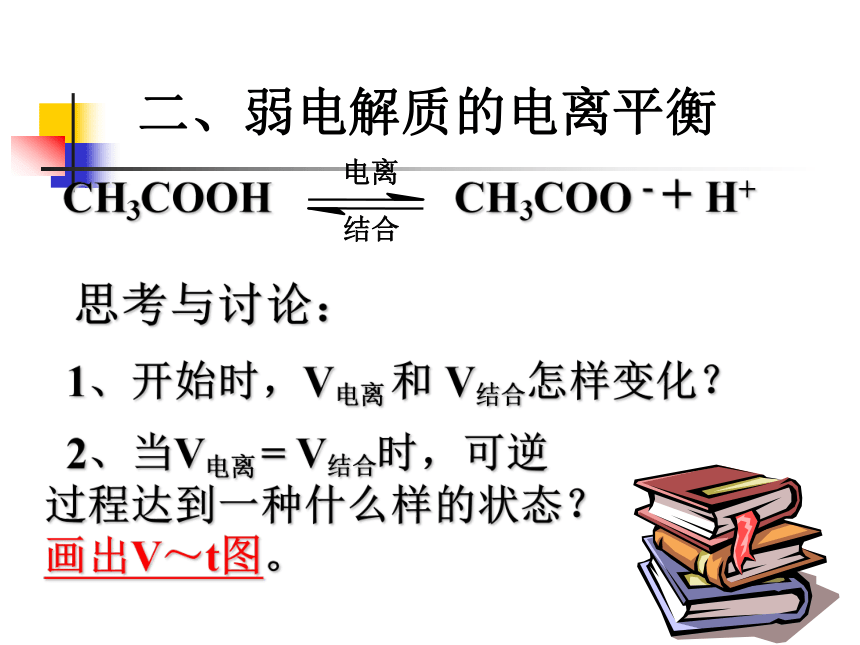
二、弱电解质的电离平衡
思考与讨论:
1、开始时,V电离
和
V结合怎样变化?
2、当V电离
=
V结合时,可逆
过程达到一种什么样的状态?
画出V~t图。
CH3COOH
CH3COO
-
+
H+
电离
结合
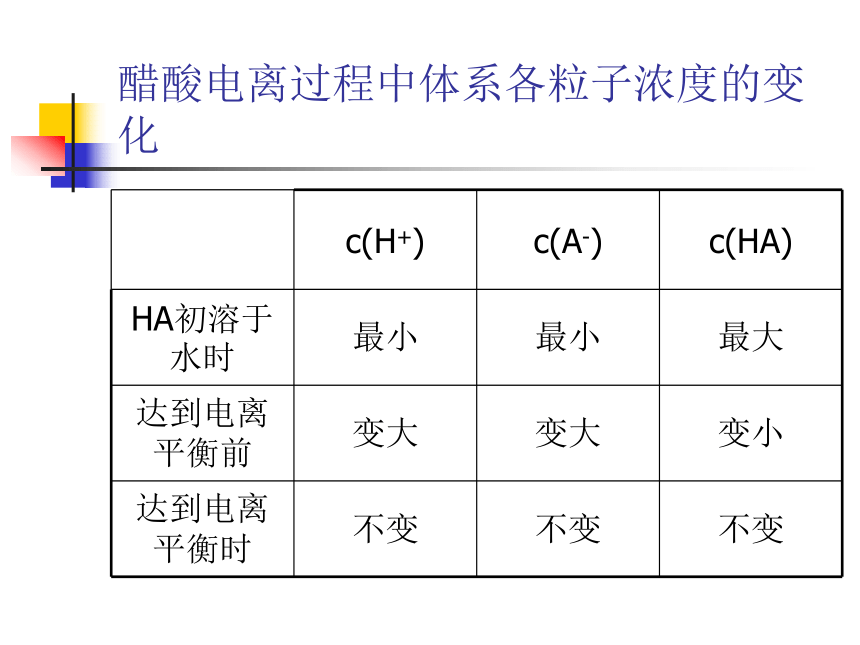
醋酸电离过程中体系各粒子浓度的变化
c(H+)
c(A-)
c(HA)
HA初溶于水时
最小
最小
最大
达到电离平衡前
变大
变大
变小
达到电离平衡时
不变
不变
不变
弱电解质电离的V-t图像
V电离
V结合
0
t1
t2
V电离=
V结合
平衡状态Ⅰ
t
V
电离平衡
在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——
思考与讨论:
例1,
在氨水中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、NH4Cl溶液以及大量的水,对平衡有什么影响?
NH3·H2O
NH4
+
+
OH
-
加入
物质
盐
酸
NaOH溶
液
NH4Cl溶
液
加大量水
平衡移动方向
右
左
左
右
影响电离平衡有哪些因素
(1)温度
电离过程是吸热过程,平衡温度升高向电离方向移动。
(2)浓度
浓度越大,电离程度越小。
(3)其他因素
问题探讨
1.弱电解质加水稀释时,电离程度_____,离子浓度______?
(填变大、变小、不变或不能确定)
变大
不能确定
画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。
练习
3.有H+浓度相同、体积相等的三种酸:a、盐酸
b、硫酸
c、醋酸,同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量_________。(用<、=、>
表示)
a=b=c
a=b问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
三、电离平衡常数(K)
看课本自学相关内容并思考:
(1)什么叫电离平衡常数?
(2)电离平衡常数的化学含义是什么?
(3)怎样用电离平衡常数比较弱电解质的相对强弱?
(4)影响电离平衡常数的因素是什么?
弱电解质电离程度相对大小的参数一
电离平衡常数(K)
对于一元弱酸
HA
H++A-,平衡时
Ka=
c
(
H+)
.c(
A-)
c(HA)
对于一元弱碱
MOH
M++OH-,平衡时
Kb=
c
(
M+).c(
OH-
)
c(MOH)
意义:K值越大,电离程度越大,相应酸
(或碱)的酸(或碱)性越强。K值只随温度变化。
已知多元弱酸在水溶液中的电离是分步的。
例:H2CO3
H++HCO3-
一(1)
HCO3-
H++CO32-
一(2)
每一步的电离程度是不一样的。
对于多元酸:
多元弱酸是分步电离的,K1》K2(一般要相差105)。
多元弱酸的酸性由第一步电离决定。
练习5
已知室温时,0.1
mo1/L
某一元酸HA在水中有0.1%发生电离,下列叙述
错误的是
(
)
A.该溶液的pH=4?
B.升高温度,溶液的pH增大?
C.此酸的电离平衡常数约为1×10-7??
D.由HA电离出的c(H+)约为水电离出的c(H+)的
106倍
答案
B
解析
根据HA在水中的电离度可算出c(H+)=0.1×
0.1%
mol/L=10-4
mol/L,所以pH=4;因HA在水中有电离平衡,升高温度促进平衡向电离的方向移动,所以c(H+)将增大,pH值会减小;C选项可由平衡常数表达式算出K=
=1×10-7,所以C无错误;D选项由水电离出的c(H+)=
10-10
mol/L。
再见
祝同学们学习进步
第三章
水溶液中的离子平衡
第一节
弱电解质的电离
学习目的和要求
认识强电解质和弱电解质的概念。
理解电解质的电离平衡概念,加深对动态平衡的认识。
理解导电性强弱与电解质强弱的关系。
一、强、弱电解质?
1mol/L
HCl
1
mol/L
CH3COOH
与镁反应现象
剧烈
缓慢
溶液pH
小(0)
大(2.4)
试验结果分析
离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要用活化能来引发的反应。
反应速率不同,pH不同,说明盐酸和醋酸中的H+浓度是不同的。
相同体积、相同浓度的盐酸和醋酸中H+浓度却不同,说明HCl和CH3COOH的电离程度不同。
强电解质:
弱电解质:
在水溶液里或熔融状态下全部电离成离子的电解质(其离子无
分子化倾向)。包括大多数盐类、强酸、强碱。
在水溶液里部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O)、水。
NaCl
=
Na++Cl-
HAc
H++Ac-
练习1
下列物质属于强电解质的是__
_,属于弱电解质的是__
_,属于非电解质的是
_
.
a.铜丝
b.金刚石
c.石墨
d.NaCl
e.盐酸
f.蔗糖
g.CO2
h.Na2O
i.硬脂酸
j.醋酸
k.碳酸
l.碳酸氢铵
m.氢氧化铝
n.氯气
o.
BaSO4
d.h.l.o
i.j.k.m.
f.g.
练习2
可以证明醋酸是弱电解质的是(
)
A、0.1mol/L的醋酸溶液pH约为2
B、醋酸能与水以任意比互溶
C、溶液的导电能力比盐酸弱
D、溶液中存在醋酸分子
BD
二、弱电解质的电离平衡
思考与讨论:
1、开始时,V电离
和
V结合怎样变化?
2、当V电离
=
V结合时,可逆
过程达到一种什么样的状态?
画出V~t图。
CH3COOH
CH3COO
-
+
H+
电离
结合
醋酸电离过程中体系各粒子浓度的变化
c(H+)
c(A-)
c(HA)
HA初溶于水时
最小
最小
最大
达到电离平衡前
变大
变大
变小
达到电离平衡时
不变
不变
不变
弱电解质电离的V-t图像
V电离
V结合
0
t1
t2
V电离=
V结合
平衡状态Ⅰ
t
V
电离平衡
在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态——
思考与讨论:
例1,
在氨水中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、NH4Cl溶液以及大量的水,对平衡有什么影响?
NH3·H2O
NH4
+
+
OH
-
加入
物质
盐
酸
NaOH溶
液
NH4Cl溶
液
加大量水
平衡移动方向
右
左
左
右
影响电离平衡有哪些因素
(1)温度
电离过程是吸热过程,平衡温度升高向电离方向移动。
(2)浓度
浓度越大,电离程度越小。
(3)其他因素
问题探讨
1.弱电解质加水稀释时,电离程度_____,离子浓度______?
(填变大、变小、不变或不能确定)
变大
不能确定
画出用水稀释冰醋酸时离子浓度随加水量的变化曲线。
练习
3.有H+浓度相同、体积相等的三种酸:a、盐酸
b、硫酸
c、醋酸,同时加入足量的锌,则开始反应时速率______,反应完全后生成H2的质量_________。(用<、=、>
表示)
a=b=c
a=b
三、电离平衡常数(K)
看课本自学相关内容并思考:
(1)什么叫电离平衡常数?
(2)电离平衡常数的化学含义是什么?
(3)怎样用电离平衡常数比较弱电解质的相对强弱?
(4)影响电离平衡常数的因素是什么?
弱电解质电离程度相对大小的参数一
电离平衡常数(K)
对于一元弱酸
HA
H++A-,平衡时
Ka=
c
(
H+)
.c(
A-)
c(HA)
对于一元弱碱
MOH
M++OH-,平衡时
Kb=
c
(
M+).c(
OH-
)
c(MOH)
意义:K值越大,电离程度越大,相应酸
(或碱)的酸(或碱)性越强。K值只随温度变化。
已知多元弱酸在水溶液中的电离是分步的。
例:H2CO3
H++HCO3-
一(1)
HCO3-
H++CO32-
一(2)
每一步的电离程度是不一样的。
对于多元酸:
多元弱酸是分步电离的,K1》K2(一般要相差105)。
多元弱酸的酸性由第一步电离决定。
练习5
已知室温时,0.1
mo1/L
某一元酸HA在水中有0.1%发生电离,下列叙述
错误的是
(
)
A.该溶液的pH=4?
B.升高温度,溶液的pH增大?
C.此酸的电离平衡常数约为1×10-7??
D.由HA电离出的c(H+)约为水电离出的c(H+)的
106倍
答案
B
解析
根据HA在水中的电离度可算出c(H+)=0.1×
0.1%
mol/L=10-4
mol/L,所以pH=4;因HA在水中有电离平衡,升高温度促进平衡向电离的方向移动,所以c(H+)将增大,pH值会减小;C选项可由平衡常数表达式算出K=
=1×10-7,所以C无错误;D选项由水电离出的c(H+)=
10-10
mol/L。
再见
祝同学们学习进步
