人教版高中化学选修四第三节:化学反应热的计算(24张PPT)
文档属性
| 名称 | 人教版高中化学选修四第三节:化学反应热的计算(24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-16 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
如何测定C(s)+1/2O2(g)==CO(g)的反应热△H1
①能直接测定吗?如何测
②若不能直接测,怎么办
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算,为方便反应热计算,我们来学习盖斯定律。
不管化学反应是一步完成或分几步完成,其反应热是相同。
注:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
一
盖斯定律
1、内容:
⒉盖斯定律直观化:
山的高度与上山的途径无关
海拔400m
一
盖斯定律
一
盖斯定律
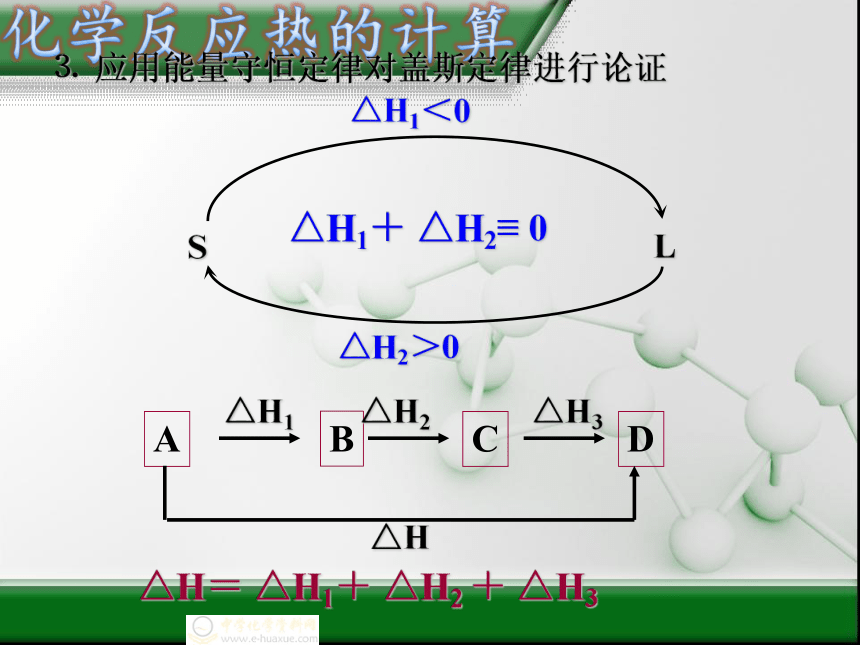
⒊
应用能量守恒定律对盖斯定律进行论证
S
L
△H1<0
△H1+
△H2≡
0
△H2>0
结论:反应过程中,反应物与生成物相反时,反应热数值不变,符号相反。
⒊
应用能量守恒定律对盖斯定律进行论证
S
L
△H1<0
△H2>0
△H1+
△H2≡
0
A
B
C
D
△H1
△H2
△H3
△H
△H=
△H1+
△H2
+
△H3
一
盖斯定律
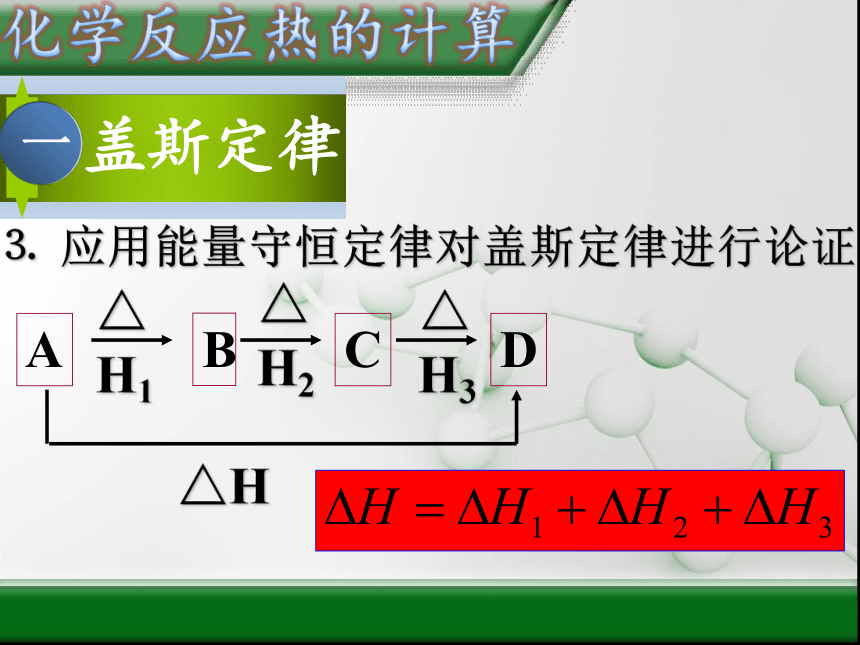
⒊
应用能量守恒定律对盖斯定律进行论证
A
B
C
D
△H1
△H2
△H3
△H
如何测定C(s)+1/2O2(g)=CO(g)的反应热△H1
1.
C(s)+O2(g)=CO2(g)
△H
=-
393.5
kJ/mol
2.CO(g)+1/2O2(g)=CO2(g)
△H2=-283.0
kJ/mol
3.C(s)+1/2O2(g)=CO(g)
△H1=?
△H1
+
△H2
=
△H
△H1
=
△H
-
△H2
=
-393.5
kJ/mol
-(-283.0
kJ/mol)
=
-110.5
kJ/mol
⒋
应用:测定某些化学反应的反应热
下列数据表示H2的燃烧热吗?为什么?
H2(g)
+
O2(g)
=
H2O
(g)
△H1=-241.8kJ/mol
H2O(g)
=
H2O
(l)
△H2=-44
kJ/mol
1
2
H2(g)
+
O2(g)
=
H2O
(l)
1
2
△H=-285.8kJ/mol
+)
一
盖斯定律
1.
已知:
①
C?s?+O2?g?=CO2?g?
?H=?393?5
kJ·mol?1
②
2CO?g?+O2?g?=2CO2?g?
?H=?566
kJ·mol?1
③
TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g?
?H=+141kJ·mol?1
则:TiO2?s?
+
2Cl2?g?
+
2C?s?
=
TiCl4?s?
+
2CO?g?
的?H=
。
?80
kJ·mol
-1
课堂练习
2.
写出石墨变成金刚石的热化学方程式(25℃,101kPa时)
查燃烧热表知:
①C(s
,石墨)+O2(g)
=
CO2(g)
△H1=
-
393.5kJ/mol
②C(s
,金刚石)+O2(g)
=
CO2(g)
△H2=
-
395.0kJ/mol
△H=
+
1.5kJ/mol
课堂练习
3.
已知
①
CO(g)
+
1/2
O2(g)
=
CO2(g)
ΔH1=
-283.0
kJ/mol
②
H2(g)
+
1/2
O2(g)
=
H2O(l)
ΔH2=
-285.8
kJ/mol
③
C2H5OH(l)
+
3
O2(g)
=
2CO2(g)
+
3
H2O(l)
ΔH3=
-1370
kJ/mol
计算:
2CO(g)+
4
H2(g)=
H2O(l)+
C2H5OH(l)
的ΔH
2CO(g)+
4
H2(g)=
H2O(l)+
C2H5OH(l)
ΔH
=-339.2
kJ/mol
课堂练习
二
反应热的计算
常考题型训练
1.
有关热化学反应方程式的的含义及书写.
2.
反应热的判断和求算.
3.
利用键能计算反应热
题型1:4
g硫粉完全燃烧时放出37
kJ热量,该反应的热
化学方程式是:
S(s)
+
O2(g)
=
SO2(g)
△H=-296kJ/mol
二
反应热的计算
0.5
mol
C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收65.65KJ热量,该反应的热化学方程式为:
C(s,石墨)
+
H2O
(g)
=
CO(g)
+
H2(g)
△H=+131.3kJ/mol
课堂练习
题型2:25℃、101KPa时,将1.0g钠与足量氯气反应生成氯化钠晶体并放出17.87KJ的热量,求生成1mol
NaCl
的反应热。
-411kJ/mol
二
反应热的计算
乙醇的燃烧热为1366.8kJ/mol,在
25℃、101KPa时,
1kg乙醇充分燃烧后放出多少热量?
29714kJ
课堂练习
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?
2240
L
CH4(标准状况)燃烧后所产生的热量为多少?
答:CH4的燃烧热为-890
kJ/mol,2240
L
CH4
(标况)完全燃烧产生的热量为
8.9×104kJ。
课堂练习
已知:
2H2(g)+O2(g)=2H2O(l)
△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比。
n
(H2)∶
n
(CO)
=1∶
1
课堂练习
H2、CO、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);
△H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.3kJ/mol
相同质量的H2、CO、辛烷、甲烷完全燃烧时放出热量最少的是
A
H2(g)
B
CO(g)
C
C8H18(l)
D
CH4(g)
B
CO(g)
课堂练习
例4:
已知下列反应的反应热为:
(1)
CH3COOH(l)+
2O2(g)=2CO2(g)+
2H2O(l)
△H=-870.3KJ/mol
(2)
C(s)+O2(g)=CO2(g)
△H=-393.5KJ/mol
(3)
H2(g)+1/2O2(g)=H2O(l)
△H=-285.8KJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)
=CH3COOH(l)
课堂练习
Zn
(
s
)+1/2O2
(
g
)
=
ZnO
(
s
)
ΔH
=
-351.1
kJ/mol
Hg
(
l)
+1/2O2
(
g
)
=
Hg
O
(
s
)
ΔH
=
-90.7
kJ/mol
Zn
(
s
)
+
Hg
O
(
s
)
=
ZnO
(
s
)
+
Hg
(
l)
ΔH
3=
?
则
ΔH
3为多少?
课堂练习
已知:CH3CH3→CH2=CH2+H2;
有关化学键的键能如下。
化学键
C-H
C=C
C-C
H-H
键能
414.4
615.3
347.4
435.3
(kJ/mol)
试计算该反应的反应热。
ΔH
=+125.6
kJ/mol
二
反应热的计算
如何测定C(s)+1/2O2(g)==CO(g)的反应热△H1
①能直接测定吗?如何测
②若不能直接测,怎么办
在化学科研中,经常要测量化学反应所放出或吸收的热量,但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,也需要反应热计算,为方便反应热计算,我们来学习盖斯定律。
不管化学反应是一步完成或分几步完成,其反应热是相同。
注:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
一
盖斯定律
1、内容:
⒉盖斯定律直观化:
山的高度与上山的途径无关
海拔400m
一
盖斯定律
一
盖斯定律
⒊
应用能量守恒定律对盖斯定律进行论证
S
L
△H1<0
△H1+
△H2≡
0
△H2>0
结论:反应过程中,反应物与生成物相反时,反应热数值不变,符号相反。
⒊
应用能量守恒定律对盖斯定律进行论证
S
L
△H1<0
△H2>0
△H1+
△H2≡
0
A
B
C
D
△H1
△H2
△H3
△H
△H=
△H1+
△H2
+
△H3
一
盖斯定律
⒊
应用能量守恒定律对盖斯定律进行论证
A
B
C
D
△H1
△H2
△H3
△H
如何测定C(s)+1/2O2(g)=CO(g)的反应热△H1
1.
C(s)+O2(g)=CO2(g)
△H
=-
393.5
kJ/mol
2.CO(g)+1/2O2(g)=CO2(g)
△H2=-283.0
kJ/mol
3.C(s)+1/2O2(g)=CO(g)
△H1=?
△H1
+
△H2
=
△H
△H1
=
△H
-
△H2
=
-393.5
kJ/mol
-(-283.0
kJ/mol)
=
-110.5
kJ/mol
⒋
应用:测定某些化学反应的反应热
下列数据表示H2的燃烧热吗?为什么?
H2(g)
+
O2(g)
=
H2O
(g)
△H1=-241.8kJ/mol
H2O(g)
=
H2O
(l)
△H2=-44
kJ/mol
1
2
H2(g)
+
O2(g)
=
H2O
(l)
1
2
△H=-285.8kJ/mol
+)
一
盖斯定律
1.
已知:
①
C?s?+O2?g?=CO2?g?
?H=?393?5
kJ·mol?1
②
2CO?g?+O2?g?=2CO2?g?
?H=?566
kJ·mol?1
③
TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g?
?H=+141kJ·mol?1
则:TiO2?s?
+
2Cl2?g?
+
2C?s?
=
TiCl4?s?
+
2CO?g?
的?H=
。
?80
kJ·mol
-1
课堂练习
2.
写出石墨变成金刚石的热化学方程式(25℃,101kPa时)
查燃烧热表知:
①C(s
,石墨)+O2(g)
=
CO2(g)
△H1=
-
393.5kJ/mol
②C(s
,金刚石)+O2(g)
=
CO2(g)
△H2=
-
395.0kJ/mol
△H=
+
1.5kJ/mol
课堂练习
3.
已知
①
CO(g)
+
1/2
O2(g)
=
CO2(g)
ΔH1=
-283.0
kJ/mol
②
H2(g)
+
1/2
O2(g)
=
H2O(l)
ΔH2=
-285.8
kJ/mol
③
C2H5OH(l)
+
3
O2(g)
=
2CO2(g)
+
3
H2O(l)
ΔH3=
-1370
kJ/mol
计算:
2CO(g)+
4
H2(g)=
H2O(l)+
C2H5OH(l)
的ΔH
2CO(g)+
4
H2(g)=
H2O(l)+
C2H5OH(l)
ΔH
=-339.2
kJ/mol
课堂练习
二
反应热的计算
常考题型训练
1.
有关热化学反应方程式的的含义及书写.
2.
反应热的判断和求算.
3.
利用键能计算反应热
题型1:4
g硫粉完全燃烧时放出37
kJ热量,该反应的热
化学方程式是:
S(s)
+
O2(g)
=
SO2(g)
△H=-296kJ/mol
二
反应热的计算
0.5
mol
C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收65.65KJ热量,该反应的热化学方程式为:
C(s,石墨)
+
H2O
(g)
=
CO(g)
+
H2(g)
△H=+131.3kJ/mol
课堂练习
题型2:25℃、101KPa时,将1.0g钠与足量氯气反应生成氯化钠晶体并放出17.87KJ的热量,求生成1mol
NaCl
的反应热。
-411kJ/mol
二
反应热的计算
乙醇的燃烧热为1366.8kJ/mol,在
25℃、101KPa时,
1kg乙醇充分燃烧后放出多少热量?
29714kJ
课堂练习
在
101
kPa时,1mol
CH4
完全燃烧生成CO2和液态H2O,放出
890
kJ的热量,CH4
的燃烧热为多少?
2240
L
CH4(标准状况)燃烧后所产生的热量为多少?
答:CH4的燃烧热为-890
kJ/mol,2240
L
CH4
(标况)完全燃烧产生的热量为
8.9×104kJ。
课堂练习
已知:
2H2(g)+O2(g)=2H2O(l)
△H=-571.6kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-283.0kJ/mol
某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量之比。
n
(H2)∶
n
(CO)
=1∶
1
课堂练习
H2、CO、辛烷、甲烷的热化学方程式分别为:
H2(g)+1/2O2(g)=H2O(l);
△H=-285.8kJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890.3kJ/mol
相同质量的H2、CO、辛烷、甲烷完全燃烧时放出热量最少的是
A
H2(g)
B
CO(g)
C
C8H18(l)
D
CH4(g)
B
CO(g)
课堂练习
例4:
已知下列反应的反应热为:
(1)
CH3COOH(l)+
2O2(g)=2CO2(g)+
2H2O(l)
△H=-870.3KJ/mol
(2)
C(s)+O2(g)=CO2(g)
△H=-393.5KJ/mol
(3)
H2(g)+1/2O2(g)=H2O(l)
△H=-285.8KJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)
=CH3COOH(l)
课堂练习
Zn
(
s
)+1/2O2
(
g
)
=
ZnO
(
s
)
ΔH
=
-351.1
kJ/mol
Hg
(
l)
+1/2O2
(
g
)
=
Hg
O
(
s
)
ΔH
=
-90.7
kJ/mol
Zn
(
s
)
+
Hg
O
(
s
)
=
ZnO
(
s
)
+
Hg
(
l)
ΔH
3=
?
则
ΔH
3为多少?
课堂练习
已知:CH3CH3→CH2=CH2+H2;
有关化学键的键能如下。
化学键
C-H
C=C
C-C
H-H
键能
414.4
615.3
347.4
435.3
(kJ/mol)
试计算该反应的反应热。
ΔH
=+125.6
kJ/mol
二
反应热的计算
