新人教版高二选修3-3物理7.1-物体是由大量分子组成的(38张PPT)
文档属性
| 名称 | 新人教版高二选修3-3物理7.1-物体是由大量分子组成的(38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2020-09-16 00:00:00 | ||
图片预览









文档简介
(共38张PPT)
教学目标:
1、知道一般分子直径和质量的数量级;?
2、知道阿伏伽德罗常数的含义,记住这个常数的数值和单位;?
3、知道用单分子油膜方法估算分子的直径。
一、分子的大小
约翰·道尔顿:
1766年9月6日-1844年7月27日
1、有多少种不同的化学元素,就有多少种不同的原子;
2、同一种元素的原子在质量、形态等方面完全相同;
3、每个原子在牛顿万有引力作用下,简单地排在一起
×
×
×
理查德·费曼:
1918年5月11日—1988年2月15日,美籍犹太裔物理学家,加州理工学院物理学教授,1965年诺贝尔物理奖得主
如果世界即将毁灭,人类只能留给后代一句话:世界是由分子构成的
扫描隧道显微镜
扫描隧道显微镜拍摄的石墨表面原子排布图
?
物体是由大量分子组成的
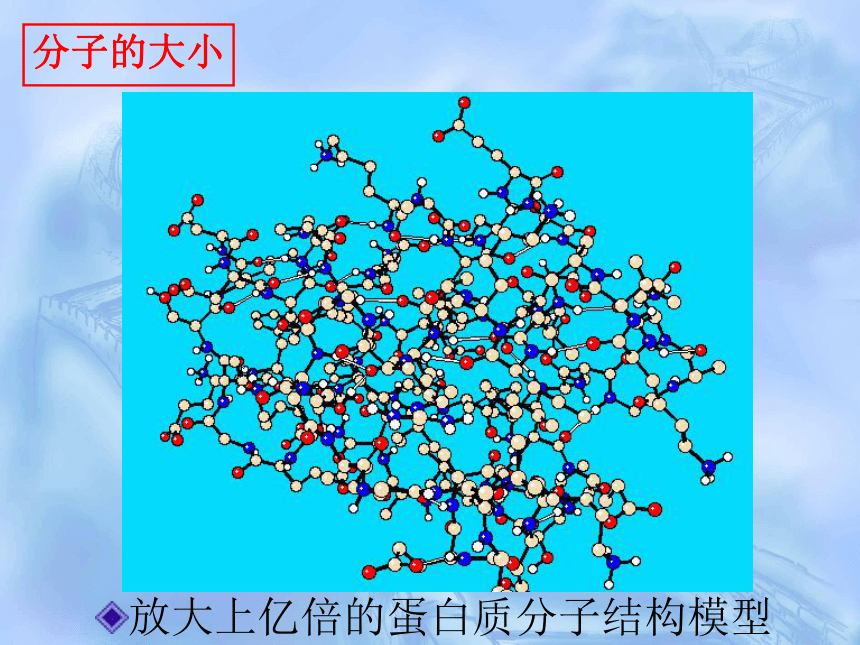
分子的大小
放大上亿倍的蛋白质分子结构模型
分子的大小
怎样才能知道分子的大小呢?
思考1.为什么选择油酸做为实验材料
思考2.如何测量油酸分子的大小(直径)?
思考3.如何测量油膜的面积?
1.分子大小的估测——单分子层油膜法
1.先测出油酸滴的体积V:
2.测出水面上漂浮的油膜的表面积S;
3.单分子油膜的厚度等于油滴体积V与油膜面积S的比值:
方法小结:通过测量较大量来研究较小量。
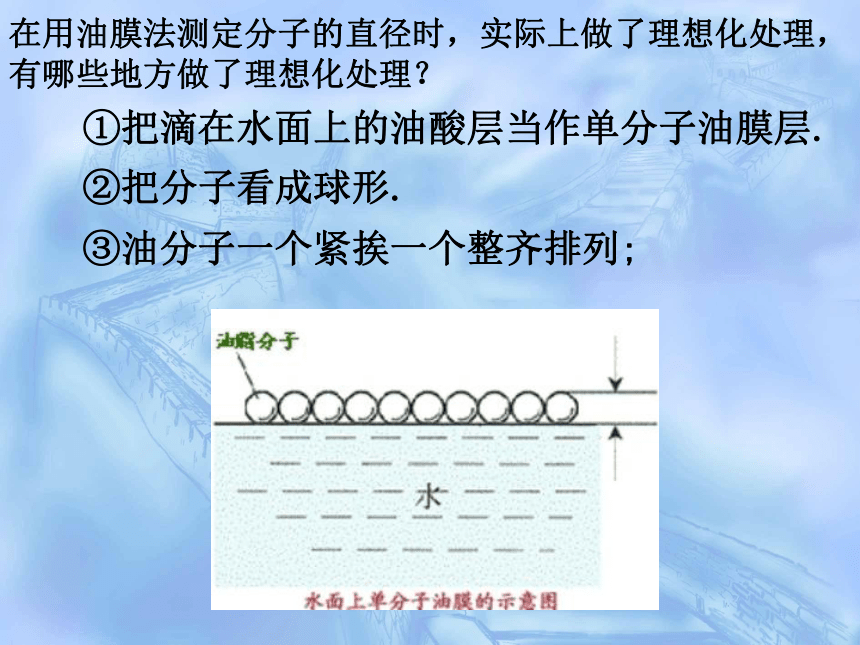
在用油膜法测定分子的直径时,实际上做了理想化处理,有哪些地方做了理想化处理?
②把分子看成球形.
①把滴在水面上的油酸层当作单分子油膜层.
③油分子一个紧挨一个整齐排列;
注意事项
(1)
实验前应检查方盘是否干净,如果有油渍则导致实验无法完成.
(2)
方盘中的水应保持稳定状态,最好静置一段时间.
痱子粉均匀撒在水面上.
(3)
向水面滴酒精油酸溶液时,针尖应竖直、靠近水面,如果离水面太高,可能无法形成油膜.
最好在1
cm左右.
滴酒精油酸溶液时要注意控制好,只滴1滴.
注意事项
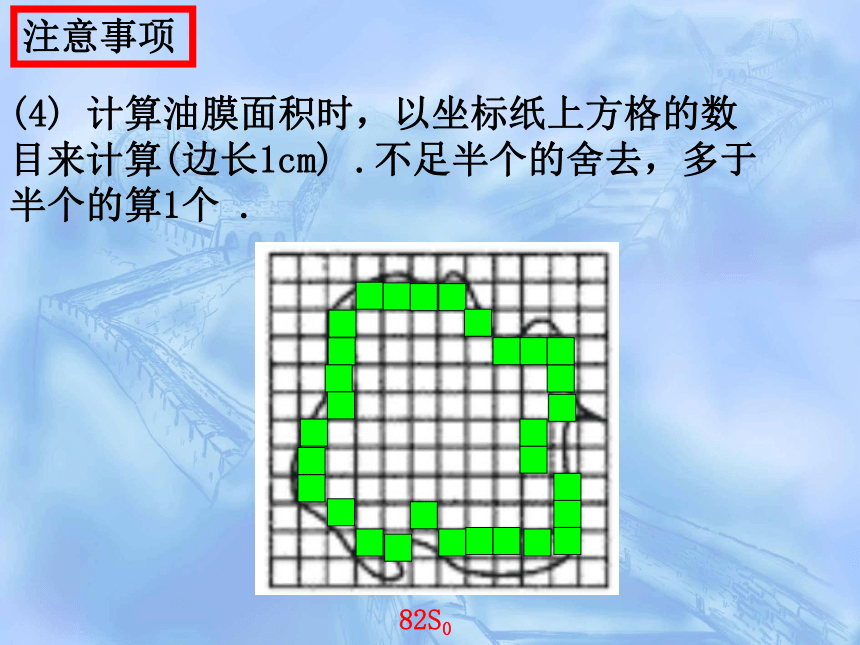
(4)
计算油膜面积时,以坐标纸上方格的数目来计算(边长1cm)
.不足半个的舍去,多于半个的算1个
.
82S0
训练
将1cm3的油酸溶于酒精,制成500cm3的酒精油酸溶液.
该酒精油酸溶液40滴的体积为1cm3,现取1滴溶液滴在水面上,随着酒精溶于水,油酸在水面上形成单分子油膜层,油膜面积0.4m2,由此估算油酸分子直径。
1.25X10-10m
1、一般分子直径的数量级为10-10m(除少数有机物大分子以外)
2、一般分子质量的数量级为10-27kg到10-26kg
数量级
注意:除一些有机物质的大分子外,一般分子的质量数量级为上面数值,以后无特别说明,我们就以上面数值作为分子质量的数量级.
二、阿伏加德罗常数
1.阿伏加德罗常数NA:1摩尔(mol)任何物质所含的微粒数叫做阿伏加德罗常数.
(1)已知物质的摩尔质量MA,可求出分子质量m0
(2)已知物质的量(摩尔数)n,可求出物体所含分子的数目N.
2、有关计算:
(3)已知物质的摩尔体积VA
,可求出分子的体积
V0
固体、液体
小球模型
d
d
d
d
3、分子模型的建立
①分子模型:在计算固液体分子大小时,作为一个近似的物理模型,可把分子看成是一小球.则:
d
d
气体
立方体模型
d
②对气体可以把分子当作是一个小立方体,这个小立方体的边长可以看作相当于分子间的平均距离.即
(以上两式中d表示分子的直径,V表示固液体分子的体积或气体分子所占的空间体积.)
设
NA为阿伏加德罗常数,VA为物质的摩尔体积
(1)球体模型
把分子视为紧密排列的球形分子,可估算分子直径为
(2)立方体模型
把分子所占有空间视为立方体,可估算分子间平均距离为
一般用于固体、液体
一般用于气体
对于固体、液体
对于气体
5.
阿伏加德罗常数NA:
(2)微观量:
单分子体积V0
单分子质量m0
分子的直径d
分子数n
(1)宏观量:
物质的体积V
物质的质量m
物质的密度ρ
物质的摩尔数N
物质的摩尔质量mmol
物质的摩尔体积Vmol
…③
…②
…①
(3)宏观量与微观量的关系:
…⑥
用于固体、液体:v0为单个分子球模型的体积
…⑤
[立方体模型]
…④
[球模型]
用于气体:v0为每个立方体模型的体积
注:因为固体、液体分子间距较小,可认为是一个个的小球,且是一个紧挨一个排列的,估算时,可忽略分子间的空隙。
估算分子直径的数量级,一般建立两种模型:球模型、立方体模型。球模型适用于估算固体和液体分子直径大小;而立方体模型计算出来的是气体分子间的平均间距。有时,也可把固体、液体分子看成一个紧挨一个的正方体来处理.
所以从而简化计算。
d
d
例1.
已知铜的密度是8.9?103kg/m3,相对原子质量64,通过估算可知每个铜原子所占的体积为(
)
A.
7?10-6m3
B.
1?10-29m3
C.
1?10-26m3
D.
8?10-24m3
[范例精讲]
解析:铜的相对原子质量是64,意思是
铜的摩尔质量是:
mmol=64g/mol=64×10-3kg/mol
B
注:此题若要进一步估算铜原子的直
径,则可用球模型:
例2.
只要知道下列哪一组物理量,就可以估算出气体中分子间的平均距离?
(
)
A.
阿伏加德罗常数,该气体的摩尔质量和质量
B.
阿伏加德罗常数,该气体的摩尔质量和密度
C.
阿伏加德罗常数,该气体的质量和体积
D.
该气体的密度、体积和摩尔质量
所以B正确.
解析:要估算分子间平均距离,先要计算出单个气体分子所占平均空间v0,再利用立方体模型:
求d.
若能求出摩尔体积Vmol,又知道阿伏加德罗常
数NA,
例3.
用油膜法估测分子大小的实验中,配制的油酸酒精溶液的浓度为每5000ml溶液中有纯油酸2ml,用注射器测得1ml上述溶液有60滴,把1滴该溶液滴入盛水的浅盘里,等水面稳定以后,用玻璃板放在浅盘上,在玻璃板放在坐标纸上,其形状和尺寸如右图所
示,坐标纸中正方形小格的边长为1cm,根据以上数据和测量结果,估测出油酸分子的大小是多少?
s
=
83×1cm2=
83cm2=8.3×10-3m2
解析:(1)先数整数个小方格,再数不足一格的.
方法是大于半格的记为1格,小于半格的舍去,一共数得小方格总数为83,则
1.若以μ表示水的摩尔质量,v表示在标准状态下水蒸气的摩尔体积,ρ为在标准状态下水蒸气的密度,NA为阿伏加德罗常数,m、v0表示每个水分子的质量和体积,下面是四个关系式:(1)
NA=
vρ/m
(2)
ρ=μ/(NA
v0)
(3)m=μ/
NA
(4)
v0=v/
NA其中
(
)
A.(1)和(2)都是正确的
B.(1)和(3)都是正确的
C.(3)和(4)都是正确的
D.(1)和(4)都是正确的
B
练习
2.下面关于分子数量的说法中正确的是(
)
A.1g的氢气和1g的氦气含有相同的分子数
B.体积相等的固体和液体相比较,固体中的分子数多
C.无论什么物质,只要它们的摩尔数相同就含有相同的分子数
D.无论什么物质,只要它们的体积相同就含有相同的分子数
C
3.关于分子质量,下列说法正确的是( )
A.质量相同的任何物质,分子数相同
B.摩尔质量相同的物体,分子质量一定相同
C.分子质量之比一定等于它们的摩尔质量之比
D.密度大的物质,分子质量一定大
4.只要知道下列哪一组物理量,就可以估算出气体中分子间的平均距离?
(
)
A.阿伏加德罗常数、该气体的摩尔质量和质量
B.阿伏加德罗常数、该气体的摩尔质量和密度
C.阿伏加德罗常数、该气体的摩尔体积
D.该气体的密度、体积和质量
BC
BC
5、已知地球半径约为6.4×106
m,空气的摩尔质量约为29×10-3
kg/mol,一个标准大气压约为1.0×105
Pa.利用以上数据可估算出地球表面大气在标准状况下的体积为(
)
A.4×1016
m3
B.4×1018
m3
C.
4×1020
m3
D.
4×1022
m3
答案:B
[小结]
1.一般物体中的分子数目是很大的.
2.一般分子的质量也是很小的.?一般分子质量数量级是10-26Kg
3.阿伏加德罗常数是联系微观世界和宏观世界的桥梁,通过该常数把摩尔质量、摩尔体积跟分子质量、分子大小等微观物理量联系起来了.
一般分子直径的数量级为10-10
m
分子的模型:把分子看成球形或正方体模型。
教学目标:
1、知道一般分子直径和质量的数量级;?
2、知道阿伏伽德罗常数的含义,记住这个常数的数值和单位;?
3、知道用单分子油膜方法估算分子的直径。
一、分子的大小
约翰·道尔顿:
1766年9月6日-1844年7月27日
1、有多少种不同的化学元素,就有多少种不同的原子;
2、同一种元素的原子在质量、形态等方面完全相同;
3、每个原子在牛顿万有引力作用下,简单地排在一起
×
×
×
理查德·费曼:
1918年5月11日—1988年2月15日,美籍犹太裔物理学家,加州理工学院物理学教授,1965年诺贝尔物理奖得主
如果世界即将毁灭,人类只能留给后代一句话:世界是由分子构成的
扫描隧道显微镜
扫描隧道显微镜拍摄的石墨表面原子排布图
?
物体是由大量分子组成的
分子的大小
放大上亿倍的蛋白质分子结构模型
分子的大小
怎样才能知道分子的大小呢?
思考1.为什么选择油酸做为实验材料
思考2.如何测量油酸分子的大小(直径)?
思考3.如何测量油膜的面积?
1.分子大小的估测——单分子层油膜法
1.先测出油酸滴的体积V:
2.测出水面上漂浮的油膜的表面积S;
3.单分子油膜的厚度等于油滴体积V与油膜面积S的比值:
方法小结:通过测量较大量来研究较小量。
在用油膜法测定分子的直径时,实际上做了理想化处理,有哪些地方做了理想化处理?
②把分子看成球形.
①把滴在水面上的油酸层当作单分子油膜层.
③油分子一个紧挨一个整齐排列;
注意事项
(1)
实验前应检查方盘是否干净,如果有油渍则导致实验无法完成.
(2)
方盘中的水应保持稳定状态,最好静置一段时间.
痱子粉均匀撒在水面上.
(3)
向水面滴酒精油酸溶液时,针尖应竖直、靠近水面,如果离水面太高,可能无法形成油膜.
最好在1
cm左右.
滴酒精油酸溶液时要注意控制好,只滴1滴.
注意事项
(4)
计算油膜面积时,以坐标纸上方格的数目来计算(边长1cm)
.不足半个的舍去,多于半个的算1个
.
82S0
训练
将1cm3的油酸溶于酒精,制成500cm3的酒精油酸溶液.
该酒精油酸溶液40滴的体积为1cm3,现取1滴溶液滴在水面上,随着酒精溶于水,油酸在水面上形成单分子油膜层,油膜面积0.4m2,由此估算油酸分子直径。
1.25X10-10m
1、一般分子直径的数量级为10-10m(除少数有机物大分子以外)
2、一般分子质量的数量级为10-27kg到10-26kg
数量级
注意:除一些有机物质的大分子外,一般分子的质量数量级为上面数值,以后无特别说明,我们就以上面数值作为分子质量的数量级.
二、阿伏加德罗常数
1.阿伏加德罗常数NA:1摩尔(mol)任何物质所含的微粒数叫做阿伏加德罗常数.
(1)已知物质的摩尔质量MA,可求出分子质量m0
(2)已知物质的量(摩尔数)n,可求出物体所含分子的数目N.
2、有关计算:
(3)已知物质的摩尔体积VA
,可求出分子的体积
V0
固体、液体
小球模型
d
d
d
d
3、分子模型的建立
①分子模型:在计算固液体分子大小时,作为一个近似的物理模型,可把分子看成是一小球.则:
d
d
气体
立方体模型
d
②对气体可以把分子当作是一个小立方体,这个小立方体的边长可以看作相当于分子间的平均距离.即
(以上两式中d表示分子的直径,V表示固液体分子的体积或气体分子所占的空间体积.)
设
NA为阿伏加德罗常数,VA为物质的摩尔体积
(1)球体模型
把分子视为紧密排列的球形分子,可估算分子直径为
(2)立方体模型
把分子所占有空间视为立方体,可估算分子间平均距离为
一般用于固体、液体
一般用于气体
对于固体、液体
对于气体
5.
阿伏加德罗常数NA:
(2)微观量:
单分子体积V0
单分子质量m0
分子的直径d
分子数n
(1)宏观量:
物质的体积V
物质的质量m
物质的密度ρ
物质的摩尔数N
物质的摩尔质量mmol
物质的摩尔体积Vmol
…③
…②
…①
(3)宏观量与微观量的关系:
…⑥
用于固体、液体:v0为单个分子球模型的体积
…⑤
[立方体模型]
…④
[球模型]
用于气体:v0为每个立方体模型的体积
注:因为固体、液体分子间距较小,可认为是一个个的小球,且是一个紧挨一个排列的,估算时,可忽略分子间的空隙。
估算分子直径的数量级,一般建立两种模型:球模型、立方体模型。球模型适用于估算固体和液体分子直径大小;而立方体模型计算出来的是气体分子间的平均间距。有时,也可把固体、液体分子看成一个紧挨一个的正方体来处理.
所以从而简化计算。
d
d
例1.
已知铜的密度是8.9?103kg/m3,相对原子质量64,通过估算可知每个铜原子所占的体积为(
)
A.
7?10-6m3
B.
1?10-29m3
C.
1?10-26m3
D.
8?10-24m3
[范例精讲]
解析:铜的相对原子质量是64,意思是
铜的摩尔质量是:
mmol=64g/mol=64×10-3kg/mol
B
注:此题若要进一步估算铜原子的直
径,则可用球模型:
例2.
只要知道下列哪一组物理量,就可以估算出气体中分子间的平均距离?
(
)
A.
阿伏加德罗常数,该气体的摩尔质量和质量
B.
阿伏加德罗常数,该气体的摩尔质量和密度
C.
阿伏加德罗常数,该气体的质量和体积
D.
该气体的密度、体积和摩尔质量
所以B正确.
解析:要估算分子间平均距离,先要计算出单个气体分子所占平均空间v0,再利用立方体模型:
求d.
若能求出摩尔体积Vmol,又知道阿伏加德罗常
数NA,
例3.
用油膜法估测分子大小的实验中,配制的油酸酒精溶液的浓度为每5000ml溶液中有纯油酸2ml,用注射器测得1ml上述溶液有60滴,把1滴该溶液滴入盛水的浅盘里,等水面稳定以后,用玻璃板放在浅盘上,在玻璃板放在坐标纸上,其形状和尺寸如右图所
示,坐标纸中正方形小格的边长为1cm,根据以上数据和测量结果,估测出油酸分子的大小是多少?
s
=
83×1cm2=
83cm2=8.3×10-3m2
解析:(1)先数整数个小方格,再数不足一格的.
方法是大于半格的记为1格,小于半格的舍去,一共数得小方格总数为83,则
1.若以μ表示水的摩尔质量,v表示在标准状态下水蒸气的摩尔体积,ρ为在标准状态下水蒸气的密度,NA为阿伏加德罗常数,m、v0表示每个水分子的质量和体积,下面是四个关系式:(1)
NA=
vρ/m
(2)
ρ=μ/(NA
v0)
(3)m=μ/
NA
(4)
v0=v/
NA其中
(
)
A.(1)和(2)都是正确的
B.(1)和(3)都是正确的
C.(3)和(4)都是正确的
D.(1)和(4)都是正确的
B
练习
2.下面关于分子数量的说法中正确的是(
)
A.1g的氢气和1g的氦气含有相同的分子数
B.体积相等的固体和液体相比较,固体中的分子数多
C.无论什么物质,只要它们的摩尔数相同就含有相同的分子数
D.无论什么物质,只要它们的体积相同就含有相同的分子数
C
3.关于分子质量,下列说法正确的是( )
A.质量相同的任何物质,分子数相同
B.摩尔质量相同的物体,分子质量一定相同
C.分子质量之比一定等于它们的摩尔质量之比
D.密度大的物质,分子质量一定大
4.只要知道下列哪一组物理量,就可以估算出气体中分子间的平均距离?
(
)
A.阿伏加德罗常数、该气体的摩尔质量和质量
B.阿伏加德罗常数、该气体的摩尔质量和密度
C.阿伏加德罗常数、该气体的摩尔体积
D.该气体的密度、体积和质量
BC
BC
5、已知地球半径约为6.4×106
m,空气的摩尔质量约为29×10-3
kg/mol,一个标准大气压约为1.0×105
Pa.利用以上数据可估算出地球表面大气在标准状况下的体积为(
)
A.4×1016
m3
B.4×1018
m3
C.
4×1020
m3
D.
4×1022
m3
答案:B
[小结]
1.一般物体中的分子数目是很大的.
2.一般分子的质量也是很小的.?一般分子质量数量级是10-26Kg
3.阿伏加德罗常数是联系微观世界和宏观世界的桥梁,通过该常数把摩尔质量、摩尔体积跟分子质量、分子大小等微观物理量联系起来了.
一般分子直径的数量级为10-10
m
分子的模型:把分子看成球形或正方体模型。
