【精品推荐】鲁教版化学必修1同步教学(课件+练习):第1章 第1章 认识化学科学——章末高效整合
文档属性
| 名称 | 【精品推荐】鲁教版化学必修1同步教学(课件+练习):第1章 第1章 认识化学科学——章末高效整合 |  | |
| 格式 | rar | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-09-02 13:22:35 | ||
图片预览



文档简介
(共13张PPT)
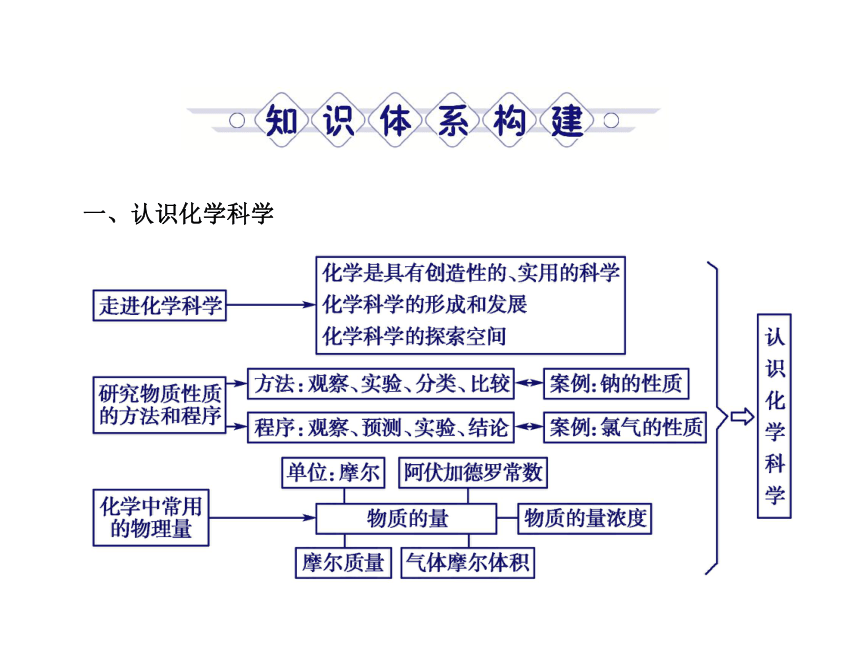
一、认识化学科学
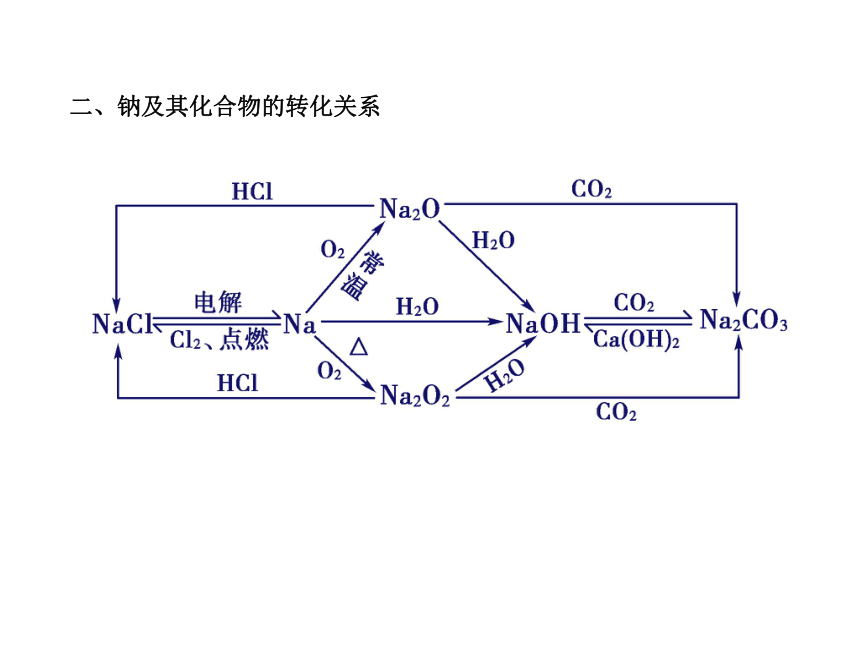
二、钠及其化合物的转化关系
三、氯及其化合物的转化关系
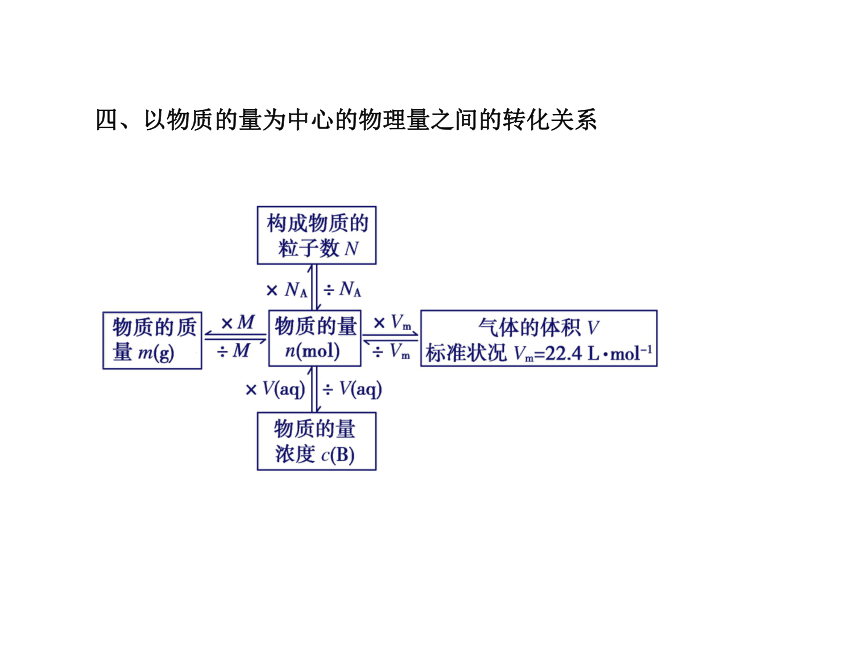
四、以物质的量为中心的物理量之间的转化关系
一、以阿伏加德罗常数为核心的相关计算
1.若题目中给出物质的体积
一要看是否处于标准状况,若不是标准状况,则1 mol气体体积一般不为22.4 L;
二要看该物质在标准状况下是否为气体,若不是气体,则无法求算该物质的物质的量或分子数目,若是气体,则可用n= 或N=
求算出该物质的n或N,这与是混合气体还是单一气体无关。
2.若题目中给出气体物质的质量或物质的量
该物质的粒子数目与外界条件(是否处于标准状况下)无关。
3.若题目要求计算物质分子中的原子个数
需注意物质的组成。例如稀有气体为单原子分子,臭氧(O3)为三原子分 子,甲烷(CH4)为五原子分子等。
4.若题目要求计算分子、原子、离子中的质子或电子数目
需正确运用原子中质子数等于电子数、离子中质子数、电子数、电荷数之间的关系进行求解。
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,33.6 L H2O中含有1.5 NA个H2O分子
B.常温常压下,2 g H2中含有NA个H原子
C.标准状况下,22.4 L任意比的H2和O2的混合气体中含有的分子总数为NA
D.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
【解析】 A项:标准状况下水为非气态物质,由STP下的体积无法计算
n(H2O),该项不正确;B项:n(H2)= =1 mol,含N(H)=1
mol×2×NA mol-1=2NA;C项:n(气)= =1 mol,N(分子)=1
mol×NAmol-1=NA,该项正确;D项:n(Mg)= =0.1 mol,
由Mg→Mg2+知0.1 mol Mg失0.2 mol e-,即0.2NA个电子,该项错误。
【答案】 C
二、十字交叉法
十字交叉法是进行二组分混合物平均量与组分量计算的一种简便方法。凡可按M1n1+M2n2= (n1+n2)计算的问题,均可按十字交叉法计算,算式为:
式中, 表示混合物的某平均量,M1、M2则表示两组分对应的量。如
表示平均相对分子质量,M1、M2则表示两组分各自的相对分子质量,n1、n2表示两组分在混合物中所占的份额,n1∶n2在大多数情况下表示两组分的物质的量之比,有时也可以是两组分的质量之比,如在进行有关溶液的质量百分比和浓度的计算时。十字交叉法常用于求算混合气体的平均相对分子质量及其组成、混合气体的平均分子式、溶液的配制、混合物的反应等。
在标准状况下,由H2和O2组成的混合气体的密度等于0.536 g·L-1,
求该混合气体中H2和O2的体积比等于多少?
【解析】 =ρ·Vm=0.536 g·L-1×22.4 L·mol-1=12 g·mol-1。
由“十字交叉法”可列关系式:
故V(H2)∶V(O2)=n(H2)∶n(O2)=20∶10=2∶1。
【答案】 2∶1
三、差量法在根据化学方程式计算中的应用
在化学反应中不仅有质的变化,而且也有量的变化,有量的变化就会产生“差量”。
例如对CuO+H2 Cu+H2O的化学反应中的固体物质做定量研究会发现,每80 g CuO发生反应,同时就有64 g Cu生成,反应前后固体的质量差(减少)为16 g,对此质量关系可表示为:
CuO+H2 Cu+H2O Δm
80 g 64 g 16 g
m(CuO) m(Cu) Δm
则有:80 g∶64 g∶16 g=m(CuO)∶m(Cu)∶Δm
由于这种差量(Δm)是伴随着物质的化学反应而产生的,是按比例变化的,所以可将其应用于根据化学方程式的计算。我们将应用“差量”解题的方法叫做“差量法”。使用“差量法”会使解题变得简捷,甚至于能解决一些别的方法难以解决的问题。涉及“差量法”的题也是高考常考题型之一。
化学计算中常用的物理量还有体积、物质的量等,它们也会在物质发生化学变化的过程中产生差量,例如:
高温
CO2 + C 2CO ΔV(标准状况气体体积差)
22.4 L 12 g 44.8 L 22.4 L
应用差量法的关键是合理地建立差量关系,检验差量关系是否正确的方法是看有关量之间是否成正比例关系。
已知3CO+Fe2O3 2Fe+3CO2,取含不与CO反应杂质的
Fe2O3的样品20 g置于密闭的硬质玻璃管中,在加热的条件下,通入足量的
CO,彻底反应后取出固体物质,冷却到室温时称得其质量为15.2 g。求样品
中Fe2O3的质量分数。
【解析】 3CO+Fe2O3 2Fe+3CO2 固体质量减少
160 g 48 g
m(Fe2O3) (20-15.2)g
m(Fe2O3)=16 g
w(Fe2O3)= ×100%=80%
【答案】 80%
一、认识化学科学
二、钠及其化合物的转化关系
三、氯及其化合物的转化关系
四、以物质的量为中心的物理量之间的转化关系
一、以阿伏加德罗常数为核心的相关计算
1.若题目中给出物质的体积
一要看是否处于标准状况,若不是标准状况,则1 mol气体体积一般不为22.4 L;
二要看该物质在标准状况下是否为气体,若不是气体,则无法求算该物质的物质的量或分子数目,若是气体,则可用n= 或N=
求算出该物质的n或N,这与是混合气体还是单一气体无关。
2.若题目中给出气体物质的质量或物质的量
该物质的粒子数目与外界条件(是否处于标准状况下)无关。
3.若题目要求计算物质分子中的原子个数
需注意物质的组成。例如稀有气体为单原子分子,臭氧(O3)为三原子分 子,甲烷(CH4)为五原子分子等。
4.若题目要求计算分子、原子、离子中的质子或电子数目
需正确运用原子中质子数等于电子数、离子中质子数、电子数、电荷数之间的关系进行求解。
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,33.6 L H2O中含有1.5 NA个H2O分子
B.常温常压下,2 g H2中含有NA个H原子
C.标准状况下,22.4 L任意比的H2和O2的混合气体中含有的分子总数为NA
D.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
【解析】 A项:标准状况下水为非气态物质,由STP下的体积无法计算
n(H2O),该项不正确;B项:n(H2)= =1 mol,含N(H)=1
mol×2×NA mol-1=2NA;C项:n(气)= =1 mol,N(分子)=1
mol×NAmol-1=NA,该项正确;D项:n(Mg)= =0.1 mol,
由Mg→Mg2+知0.1 mol Mg失0.2 mol e-,即0.2NA个电子,该项错误。
【答案】 C
二、十字交叉法
十字交叉法是进行二组分混合物平均量与组分量计算的一种简便方法。凡可按M1n1+M2n2= (n1+n2)计算的问题,均可按十字交叉法计算,算式为:
式中, 表示混合物的某平均量,M1、M2则表示两组分对应的量。如
表示平均相对分子质量,M1、M2则表示两组分各自的相对分子质量,n1、n2表示两组分在混合物中所占的份额,n1∶n2在大多数情况下表示两组分的物质的量之比,有时也可以是两组分的质量之比,如在进行有关溶液的质量百分比和浓度的计算时。十字交叉法常用于求算混合气体的平均相对分子质量及其组成、混合气体的平均分子式、溶液的配制、混合物的反应等。
在标准状况下,由H2和O2组成的混合气体的密度等于0.536 g·L-1,
求该混合气体中H2和O2的体积比等于多少?
【解析】 =ρ·Vm=0.536 g·L-1×22.4 L·mol-1=12 g·mol-1。
由“十字交叉法”可列关系式:
故V(H2)∶V(O2)=n(H2)∶n(O2)=20∶10=2∶1。
【答案】 2∶1
三、差量法在根据化学方程式计算中的应用
在化学反应中不仅有质的变化,而且也有量的变化,有量的变化就会产生“差量”。
例如对CuO+H2 Cu+H2O的化学反应中的固体物质做定量研究会发现,每80 g CuO发生反应,同时就有64 g Cu生成,反应前后固体的质量差(减少)为16 g,对此质量关系可表示为:
CuO+H2 Cu+H2O Δm
80 g 64 g 16 g
m(CuO) m(Cu) Δm
则有:80 g∶64 g∶16 g=m(CuO)∶m(Cu)∶Δm
由于这种差量(Δm)是伴随着物质的化学反应而产生的,是按比例变化的,所以可将其应用于根据化学方程式的计算。我们将应用“差量”解题的方法叫做“差量法”。使用“差量法”会使解题变得简捷,甚至于能解决一些别的方法难以解决的问题。涉及“差量法”的题也是高考常考题型之一。
化学计算中常用的物理量还有体积、物质的量等,它们也会在物质发生化学变化的过程中产生差量,例如:
高温
CO2 + C 2CO ΔV(标准状况气体体积差)
22.4 L 12 g 44.8 L 22.4 L
应用差量法的关键是合理地建立差量关系,检验差量关系是否正确的方法是看有关量之间是否成正比例关系。
已知3CO+Fe2O3 2Fe+3CO2,取含不与CO反应杂质的
Fe2O3的样品20 g置于密闭的硬质玻璃管中,在加热的条件下,通入足量的
CO,彻底反应后取出固体物质,冷却到室温时称得其质量为15.2 g。求样品
中Fe2O3的质量分数。
【解析】 3CO+Fe2O3 2Fe+3CO2 固体质量减少
160 g 48 g
m(Fe2O3) (20-15.2)g
m(Fe2O3)=16 g
w(Fe2O3)= ×100%=80%
【答案】 80%
