反应热的测量与计算
图片预览








文档简介
(共23张PPT)
反应热的测量
与计算
H+(aq)+OH-(aq)=H2O(l) = -57.3 kJ/mol
H
在稀溶液中,酸和碱发生中和反应而生成1mol水时放出的热量。
研究条件:稀溶液
反应物:酸与碱
生成物及其物质的量:1molH2O
注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热量小于57.3KJ/mol
一、中和热:
二、中和热的测定
⑴实验药品:
0.50 mol/L的盐酸和0.50 mol/L的氢氧化钠溶液
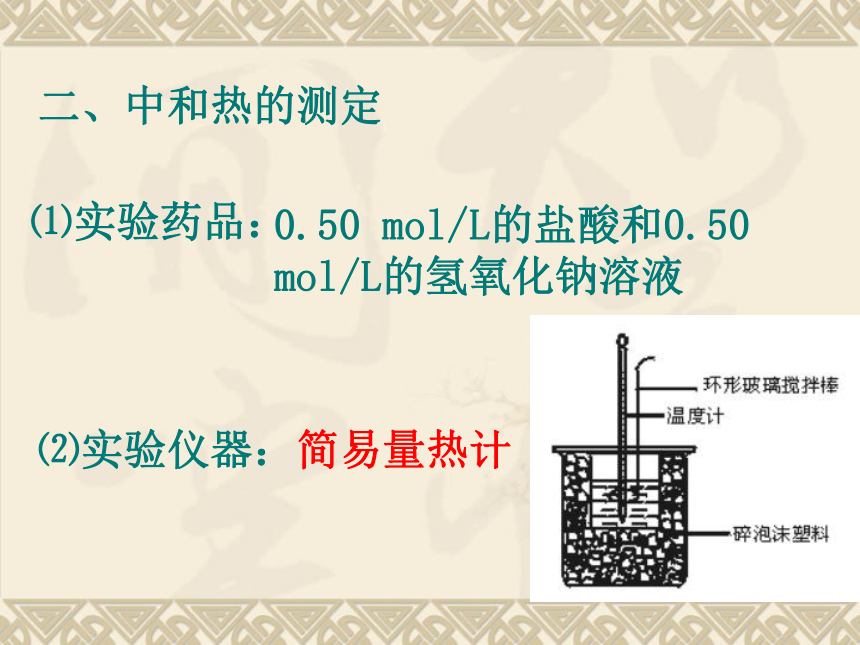
⑵实验仪器:简易量热计
⑶实验原理:
ΔH=
-
4.18 m△t×10-3
0.025
kJ/mol
H+(aq) + OH-(aq)= H2O(l)
(4)实验步骤:
1.组装量热器
在大烧杯底部垫泡沫塑料
(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如上图所示。
用一个量筒量取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度(t1),记入下表。然后把温度计上的酸用水冲洗干净。
2、药品取用
用另一个量筒量取50 mL 0.50 mol/L
NaOH溶液,并用温度计测量NaOH溶液
的温度(t2) ,记入下表。
把量筒中的NaOH溶液迅速倒入量热计(注意不要洒到外面)。立即盖上盖板,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度(t3) ,记入下表。
3、酸碱混合
4、数据处理
5、重复以上实验两次
问题探究
判断下列实验操作对中和热测定的数值有何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验
变 小
变 小
变 小
不变
1、为了减小误差。某同学在实验中两次测定中和热。第一次是用50 mL 0.50 mol/L的盐酸和50 mL 0.50 mol/L氢氧化钠,第二次是用100 mL 0.50 mol/L的盐酸和100 mL 0.50mol/L的NaOH溶液。请你预测该同学两次测得的中和热结果 (相等或者不相等)。
概念辨析
相 等
概念辨析
2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小关系为 。
△H1> △H3 > △H2
讨论:是不是任一反应的反应热均能直接测出
如何测出这个反应的反应热:
① C(s)+1/2O2(g)==CO(g) ΔH1=
② CO(g)+1/2O2(g)= CO2(g) ΔH2=-283.0kJ/mol
③ C(s)+O2(g)=CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③
则ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3- ΔH2
=-393.5kJ/mol+ 283.0kJ/mol
=-110.5kJ/mol
一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。
化学反应的焓变(ΔH)仅与反应体系的始态和终态有关,而与反应的途径无关。
如何理解盖斯定律?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
1、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)
△H=-1135.2kJ/mol
2、已知:金刚石、石墨的热化学方程式:
C(s,金刚石)+O2(g) =CO2(g)
△H = -395.4 kJ/mol
C(s,石墨)+O2(g) =CO2(g)
△H = -393.5 kJ/mol
则石墨转化为金刚石的反应热 △H= ,
两物质中 较为稳定 。
+1.9 kJ/mol
石 墨
一、标准燃烧热
1、定义:在101kPa时,l mol物质完全燃烧生成稳定的氧化物时所放出的热量。
2、注意:① 燃烧的条件是在101kPa;
② 可燃物以1mol作为标准,其它物质的系数可用分数表示;
③ 物质燃烧都是放热反应,△H均为负值;
④ 生成的产物是稳定的氧化物:
C→CO2,H→H2O (l) ,S→SO2
如:H2(g)+ 1/2 O2(g) = H2O(l) △H =-285.8 kJ/mol
1、一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是 ( )
A.0.5Q B. Q C. 2Q D.5Q
C
2、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列正确的是 ( )
A.C(s)+O2(g)=CO(g) △H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) △H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)
△H=-890.3 kJ/mol
D.1/2 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)
△H=-1400 kJ/mol
D
小结:标准燃烧热和中和热的区别与联系
1mol反应物完全燃烧时放出的热量;不同反应物,标准燃烧热不同。
生成1mol水时放出的热量;强酸与强碱的中和热都约为57.3kJ/mol 。
标准燃烧热
中和热
相同点
不同点
能量变化
H
标准
含义
放热反应
H<0;单位:kJ/mol
1mol可燃物
生成1mol水
3.已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热等于110.5 kJ/mol B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
C
反应热的测量
与计算
H+(aq)+OH-(aq)=H2O(l) = -57.3 kJ/mol
H
在稀溶液中,酸和碱发生中和反应而生成1mol水时放出的热量。
研究条件:稀溶液
反应物:酸与碱
生成物及其物质的量:1molH2O
注:强酸与弱碱反应,强碱与弱酸、弱酸和弱碱反应生成1molH2O放出的热量小于57.3KJ/mol
一、中和热:
二、中和热的测定
⑴实验药品:
0.50 mol/L的盐酸和0.50 mol/L的氢氧化钠溶液
⑵实验仪器:简易量热计
⑶实验原理:
ΔH=
-
4.18 m△t×10-3
0.025
kJ/mol
H+(aq) + OH-(aq)= H2O(l)
(4)实验步骤:
1.组装量热器
在大烧杯底部垫泡沫塑料
(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如上图所示。
用一个量筒量取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度(t1),记入下表。然后把温度计上的酸用水冲洗干净。
2、药品取用
用另一个量筒量取50 mL 0.50 mol/L
NaOH溶液,并用温度计测量NaOH溶液
的温度(t2) ,记入下表。
把量筒中的NaOH溶液迅速倒入量热计(注意不要洒到外面)。立即盖上盖板,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度(t3) ,记入下表。
3、酸碱混合
4、数据处理
5、重复以上实验两次
问题探究
判断下列实验操作对中和热测定的数值有何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板
②用相同浓度和体积的氨水代替NaOH溶液进行实验
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验
变 小
变 小
变 小
不变
1、为了减小误差。某同学在实验中两次测定中和热。第一次是用50 mL 0.50 mol/L的盐酸和50 mL 0.50 mol/L氢氧化钠,第二次是用100 mL 0.50 mol/L的盐酸和100 mL 0.50mol/L的NaOH溶液。请你预测该同学两次测得的中和热结果 (相等或者不相等)。
概念辨析
相 等
概念辨析
2、若将1L1mol/LNaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,恰好完全反应时的热效应分别为△H1、△H2 、△H3 ;则三者的大小关系为 。
△H1> △H3 > △H2
讨论:是不是任一反应的反应热均能直接测出
如何测出这个反应的反应热:
① C(s)+1/2O2(g)==CO(g) ΔH1=
② CO(g)+1/2O2(g)= CO2(g) ΔH2=-283.0kJ/mol
③ C(s)+O2(g)=CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③
则ΔH1 + ΔH2 =ΔH3
ΔH1 =ΔH3- ΔH2
=-393.5kJ/mol+ 283.0kJ/mol
=-110.5kJ/mol
一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。
化学反应的焓变(ΔH)仅与反应体系的始态和终态有关,而与反应的途径无关。
如何理解盖斯定律?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
1、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)
△H=-1135.2kJ/mol
2、已知:金刚石、石墨的热化学方程式:
C(s,金刚石)+O2(g) =CO2(g)
△H = -395.4 kJ/mol
C(s,石墨)+O2(g) =CO2(g)
△H = -393.5 kJ/mol
则石墨转化为金刚石的反应热 △H= ,
两物质中 较为稳定 。
+1.9 kJ/mol
石 墨
一、标准燃烧热
1、定义:在101kPa时,l mol物质完全燃烧生成稳定的氧化物时所放出的热量。
2、注意:① 燃烧的条件是在101kPa;
② 可燃物以1mol作为标准,其它物质的系数可用分数表示;
③ 物质燃烧都是放热反应,△H均为负值;
④ 生成的产物是稳定的氧化物:
C→CO2,H→H2O (l) ,S→SO2
如:H2(g)+ 1/2 O2(g) = H2O(l) △H =-285.8 kJ/mol
1、一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是 ( )
A.0.5Q B. Q C. 2Q D.5Q
C
2、25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列正确的是 ( )
A.C(s)+O2(g)=CO(g) △H=-393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(g) △H=+571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)
△H=-890.3 kJ/mol
D.1/2 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)
△H=-1400 kJ/mol
D
小结:标准燃烧热和中和热的区别与联系
1mol反应物完全燃烧时放出的热量;不同反应物,标准燃烧热不同。
生成1mol水时放出的热量;强酸与强碱的中和热都约为57.3kJ/mol 。
标准燃烧热
中和热
相同点
不同点
能量变化
H
标准
含义
放热反应
H<0;单位:kJ/mol
1mol可燃物
生成1mol水
3.已知反应:①2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热等于110.5 kJ/mol B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
C
