原电池的工作原理
图片预览



文档简介
(共15张PPT)
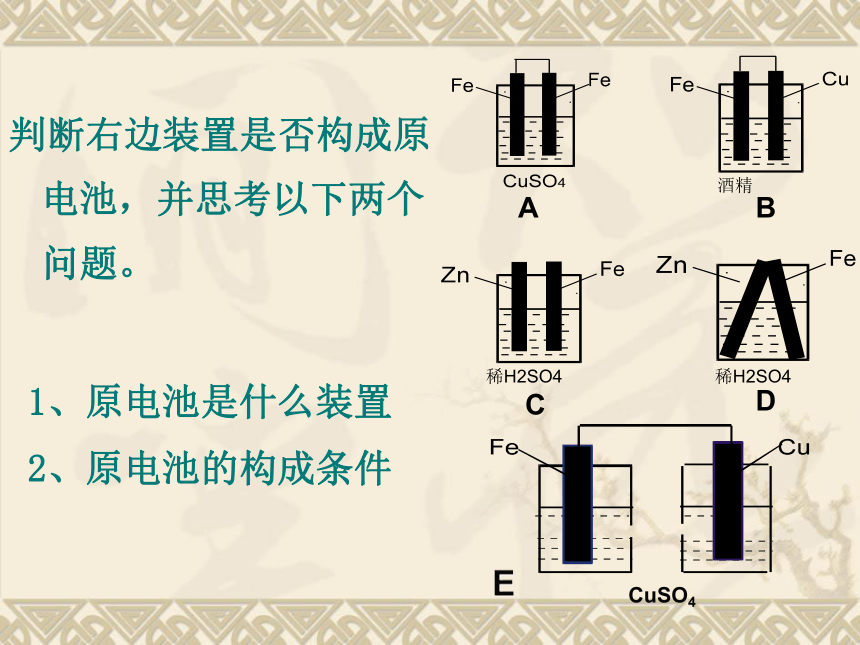
判断右边装置是否构成原电池,并思考以下两个问题。
1、原电池是什么装置
2、原电池的构成条件
酒精
稀H2SO4
稀H2SO4
A
B
C
D
CuSO4
E
知识回顾
1、原电池:
2、构成原电池的条件
(1)、两种活泼性不同的电极
(2)、电解质溶液
(3)、形成闭合回路
把化学能转变为电能的装置
[设疑]若E中两烧杯中的电解质溶液用能使阴阳离子移动的装置连接起来,能否形成原电池?
探究一:
预测P13[实验1] 的现象和结论
现象:
锌粉溶解,有红色物质析出,温度计显示温度迅速上升.
结论:
Zn+ Cu2+ = Zn2+ + Cu
化学能 热能
CuSO4
探究二:
预测P13[实验2] 的现象和结论
现象:
锌片变细,铜上有红色物质析出,电流计指针发生偏转.
结论:
化学能 电能
Zn-2e-=Zn2+
Zn+ Cu2+ = Zn2+ + Cu
2e-
Cu2++2e-=Cu
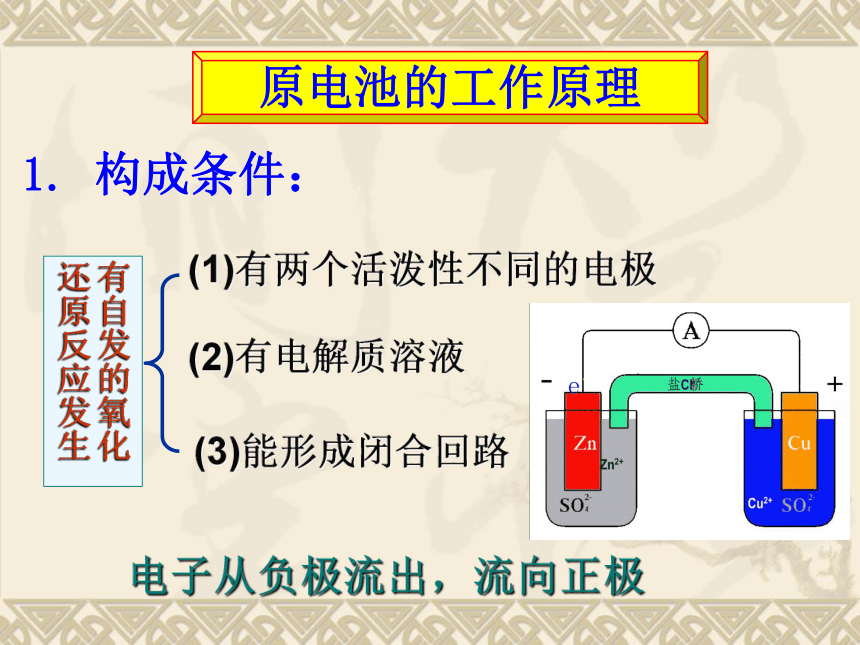
1. 构成条件:
原电池的工作原理
(1)有两个活泼性不同的电极
(2)有电解质溶液
(3)能形成闭合回路
有自发的氧化还原反应发生
电子从负极流出,流向正极
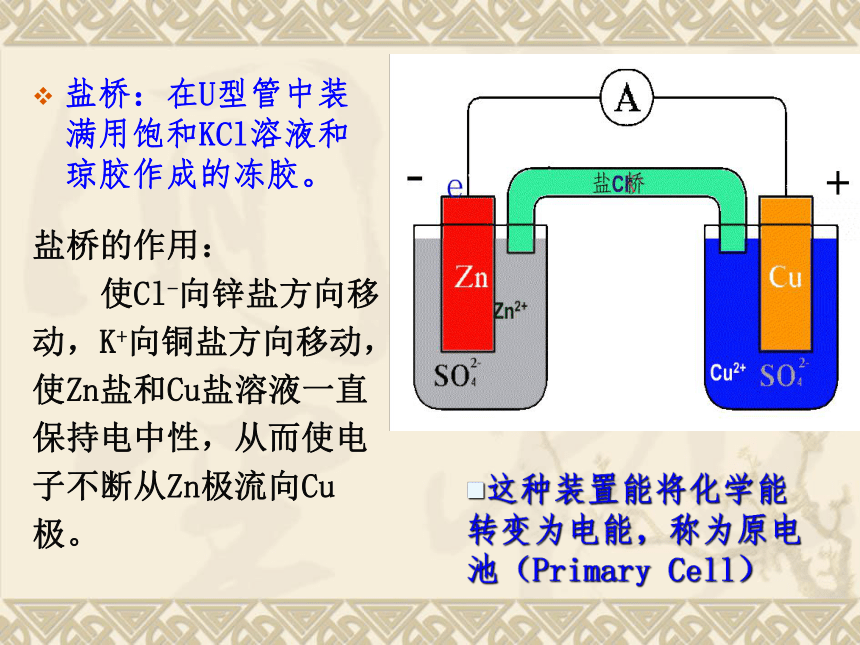
盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。
这种装置能将化学能转变为电能,称为原电池(Primary Cell)
盐桥的作用:
使Cl-向锌盐方向移
动,K+向铜盐方向移动,
使Zn盐和Cu盐溶液一直
保持电中性,从而使电
子不断从Zn极流向Cu
极。
负极(锌电极):
Zn - 2e- Zn2+
正极(铜电极):
Cu2+ + 2e- Cu
电池总反应:
Zn+ Cu2+ = Cu+ Zn2+
2、原电池正负极的判断方法及电极反应、电池反应的书写
练习
⒈
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑥
④
(×)
(∨)
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
⑤
(×)
2.为获得较长时间的稳定电流,如何将必修2中由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
ZnSO4
H2SO4
A
Zn
Cu
Cu
Zn
H2SO4
A
3、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
CuCl2
FeCl3
A
Cu
C
正极:
负极:
总反应:
Cu-2e - =Cu2+
2Fe3++2e- =2Fe2+
2Fe3++Cu=2Fe2++Cu2+
小结
2. 两个电极相连插入电解质溶液中并形成闭合电路;
把化学能直接转化为电能的装置。
1.有两块金属(或非金属)导体作电极;
二.构成原电池的基本条件:
一.原电池:
3.有可自发发生的氧化还原反应。
三.加入盐桥后由两个半电池组成的原电池工作原理:
1. 用还原性较强的物质(如:活泼金属)作负极,向外电路提供电子; 用氧化性较强的物质作正极,并在正极得到电子;
2. 原电池在放电时,负极上的电子经过导线流向正极,而氧化性较强的物质从正极上得到电子,两极之间再通过盐桥及池内溶液中的阴、阳离子定向运动形成的内电路构成有稳定电流的闭合回路。
判断右边装置是否构成原电池,并思考以下两个问题。
1、原电池是什么装置
2、原电池的构成条件
酒精
稀H2SO4
稀H2SO4
A
B
C
D
CuSO4
E
知识回顾
1、原电池:
2、构成原电池的条件
(1)、两种活泼性不同的电极
(2)、电解质溶液
(3)、形成闭合回路
把化学能转变为电能的装置
[设疑]若E中两烧杯中的电解质溶液用能使阴阳离子移动的装置连接起来,能否形成原电池?
探究一:
预测P13[实验1] 的现象和结论
现象:
锌粉溶解,有红色物质析出,温度计显示温度迅速上升.
结论:
Zn+ Cu2+ = Zn2+ + Cu
化学能 热能
CuSO4
探究二:
预测P13[实验2] 的现象和结论
现象:
锌片变细,铜上有红色物质析出,电流计指针发生偏转.
结论:
化学能 电能
Zn-2e-=Zn2+
Zn+ Cu2+ = Zn2+ + Cu
2e-
Cu2++2e-=Cu
1. 构成条件:
原电池的工作原理
(1)有两个活泼性不同的电极
(2)有电解质溶液
(3)能形成闭合回路
有自发的氧化还原反应发生
电子从负极流出,流向正极
盐桥:在U型管中装满用饱和KCl溶液和琼胶作成的冻胶。
这种装置能将化学能转变为电能,称为原电池(Primary Cell)
盐桥的作用:
使Cl-向锌盐方向移
动,K+向铜盐方向移动,
使Zn盐和Cu盐溶液一直
保持电中性,从而使电
子不断从Zn极流向Cu
极。
负极(锌电极):
Zn - 2e- Zn2+
正极(铜电极):
Cu2+ + 2e- Cu
电池总反应:
Zn+ Cu2+ = Cu+ Zn2+
2、原电池正负极的判断方法及电极反应、电池反应的书写
练习
⒈
判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.
①
②
③
(×)
(×)
(∨)
2H++2e-=H2↑
负极:
总反应:
正极:
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
⑥
④
(×)
(∨)
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或 Zn+CuSO4=ZnSO4+Cu
⑤
(×)
2.为获得较长时间的稳定电流,如何将必修2中由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装?
ZnSO4
H2SO4
A
Zn
Cu
Cu
Zn
H2SO4
A
3、已知氧化还原反应
Cu + 2FeCl3 = 2FeCl2 + CuCl2,
利用这一反应设计一个原电池,画出示意图,
标出电极材料,电解质溶液,写出电极反应式。
CuCl2
FeCl3
A
Cu
C
正极:
负极:
总反应:
Cu-2e - =Cu2+
2Fe3++2e- =2Fe2+
2Fe3++Cu=2Fe2++Cu2+
小结
2. 两个电极相连插入电解质溶液中并形成闭合电路;
把化学能直接转化为电能的装置。
1.有两块金属(或非金属)导体作电极;
二.构成原电池的基本条件:
一.原电池:
3.有可自发发生的氧化还原反应。
三.加入盐桥后由两个半电池组成的原电池工作原理:
1. 用还原性较强的物质(如:活泼金属)作负极,向外电路提供电子; 用氧化性较强的物质作正极,并在正极得到电子;
2. 原电池在放电时,负极上的电子经过导线流向正极,而氧化性较强的物质从正极上得到电子,两极之间再通过盐桥及池内溶液中的阴、阳离子定向运动形成的内电路构成有稳定电流的闭合回路。
