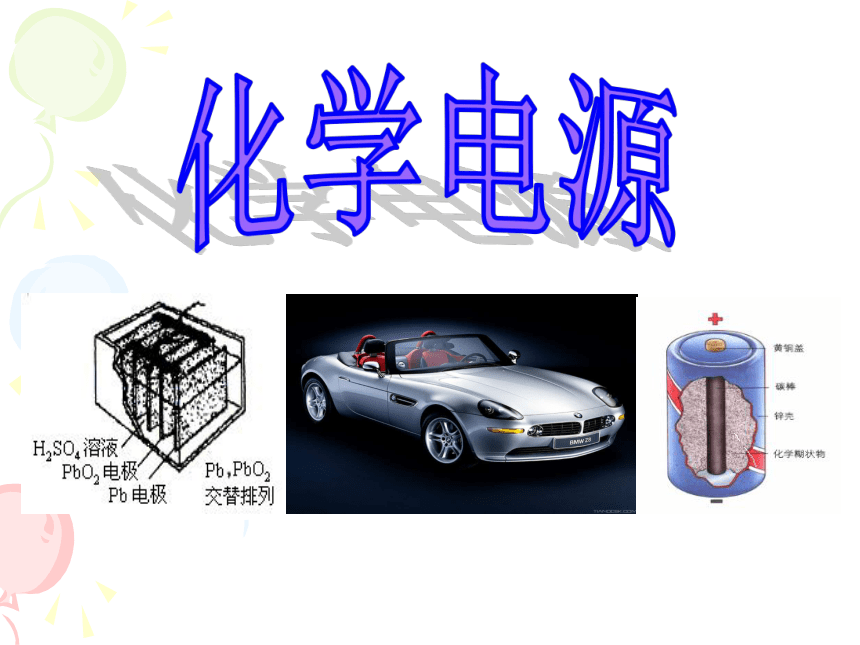
化学电源
图片预览




文档简介
(共20张PPT)
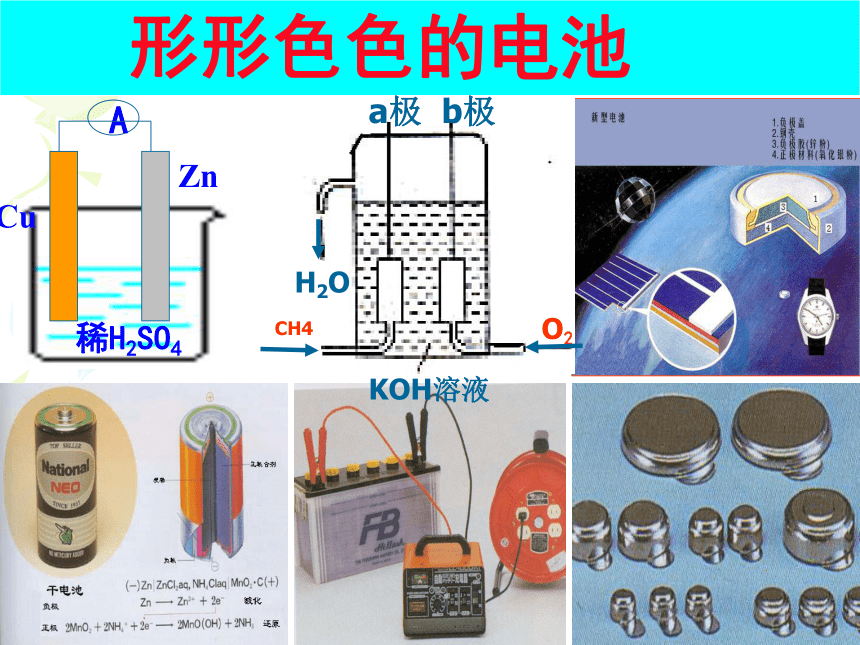
形形色色的电池
A
Cu
Zn
稀H2SO4
KOH溶液
CH4
O2
H2O
a极 b极
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
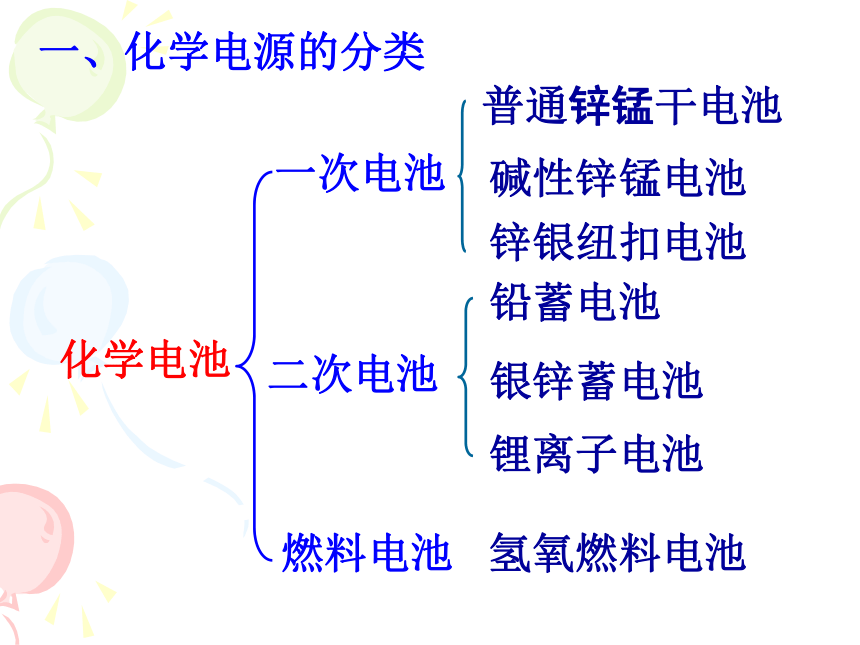
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
一、化学电源的分类
二、一次电池
普通锌锰电池
碱性电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
1、普通干电池
负极
正极
电池反应:
氢氧化氧锰
(Zn):Zn – 2e- = Zn2+
(MnO2和C):
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
2、碱性锌-锰干电池
电解质:
KOH
负极:
——Zn
Zn + 2OH- - 2e- = Zn(OH)2
正极:
——MnO2
2MnO2+2H2O+2e-=2MnOOH+2OH-
缺点:多数只能一次使用,不能充电;价格较贵
优点:比能量和储存时间有所提高,适用于大电流
和连续放电
电池反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
3、锌银钮扣电池
正极:Ag2O + H2O+ 2e- =2Ag+2OH-
负极:Zn +2OH--2e- =ZnO+H2O
总反应:
Zn+Ag2O=ZnO+2Ag
三、二次电池
1、铅蓄电池
放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb + SO42- -2e- =PbSO4
正极:
PbO2 + 4H++SO42-+2e- =2PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程
PbSO4 +2e- =Pb + SO42-
还原反应
阴极:
阳极:
PbSO4 +2H2O -2e- = PbO2 + 4H++ SO42-
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
缺点:
比能量低、笨重、废弃电池污染环境
优点:
可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池
镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……
四、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤气燃料电池……)
氢氧燃料电池
酸性电解质:
碱性电解质
负极: 2H2-4e-+4OH-==4H2O
正极: O2+2H2O+4e-==4OH-
总反应: 2H2+O2==2H2O
负极: 2H2-4e-==4H+
正极: O2+4H++4e-==2H2O
总反应:2H2+O2==2H2O
书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以
CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
练习1: 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn s +2MnO2 s +H2O l =Zn OH 2 s +Mn2O3 s
下列说法错误的是 ( )
A 电池工作时,锌失去电子
B 电池正极电极反应式为:
2MnO2 s +H2O l +2e =Mn2O3 s +2OH aq
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0 2 mol电子,锌的质量理论上减小6 5 g
C
练习2:航天技术上使用的氢氧燃料电池具有高
能、轻便、无污染的优点。氢氧燃料电池有酸式
和碱式两种,它们放电时的总反应都可以表示为
2H2+O2=2H2O,酸式电池中电解质是酸,其负极反
应可表示为2H2-4e-=4H+ ,则其正极反应式
为 。碱式电池的电解质是碱,
其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应
可表示为 。
O2+4e-+4H+=2H2O
2H2-4e-+4OH-=4H2O
练习3:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式:
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e-=CO32- +7H2O
CH4+2O2+2KOH=K2CO3+3H2O
小结:
化学电源
1、一次电池
2、二次电池
3、燃料电池
——锌锰干电池
——铅蓄电池
——氢氧燃料电池
掌握每一类典型
电池的正负极、
电极反应;了解
每一类电池的优
缺点;对其它电
池有初步的认识
形形色色的电池
A
Cu
Zn
稀H2SO4
KOH溶液
CH4
O2
H2O
a极 b极
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
一、化学电源的分类
二、一次电池
普通锌锰电池
碱性电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
1、普通干电池
负极
正极
电池反应:
氢氧化氧锰
(Zn):Zn – 2e- = Zn2+
(MnO2和C):
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
2、碱性锌-锰干电池
电解质:
KOH
负极:
——Zn
Zn + 2OH- - 2e- = Zn(OH)2
正极:
——MnO2
2MnO2+2H2O+2e-=2MnOOH+2OH-
缺点:多数只能一次使用,不能充电;价格较贵
优点:比能量和储存时间有所提高,适用于大电流
和连续放电
电池反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
3、锌银钮扣电池
正极:Ag2O + H2O+ 2e- =2Ag+2OH-
负极:Zn +2OH--2e- =ZnO+H2O
总反应:
Zn+Ag2O=ZnO+2Ag
三、二次电池
1、铅蓄电池
放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb + SO42- -2e- =PbSO4
正极:
PbO2 + 4H++SO42-+2e- =2PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程
PbSO4 +2e- =Pb + SO42-
还原反应
阴极:
阳极:
PbSO4 +2H2O -2e- = PbO2 + 4H++ SO42-
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
缺点:
比能量低、笨重、废弃电池污染环境
优点:
可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池
镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……
四、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤气燃料电池……)
氢氧燃料电池
酸性电解质:
碱性电解质
负极: 2H2-4e-+4OH-==4H2O
正极: O2+2H2O+4e-==4OH-
总反应: 2H2+O2==2H2O
负极: 2H2-4e-==4H+
正极: O2+4H++4e-==2H2O
总反应:2H2+O2==2H2O
书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以
CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
练习1: 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn s +2MnO2 s +H2O l =Zn OH 2 s +Mn2O3 s
下列说法错误的是 ( )
A 电池工作时,锌失去电子
B 电池正极电极反应式为:
2MnO2 s +H2O l +2e =Mn2O3 s +2OH aq
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0 2 mol电子,锌的质量理论上减小6 5 g
C
练习2:航天技术上使用的氢氧燃料电池具有高
能、轻便、无污染的优点。氢氧燃料电池有酸式
和碱式两种,它们放电时的总反应都可以表示为
2H2+O2=2H2O,酸式电池中电解质是酸,其负极反
应可表示为2H2-4e-=4H+ ,则其正极反应式
为 。碱式电池的电解质是碱,
其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应
可表示为 。
O2+4e-+4H+=2H2O
2H2-4e-+4OH-=4H2O
练习3:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式:
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e-=CO32- +7H2O
CH4+2O2+2KOH=K2CO3+3H2O
小结:
化学电源
1、一次电池
2、二次电池
3、燃料电池
——锌锰干电池
——铅蓄电池
——氢氧燃料电池
掌握每一类典型
电池的正负极、
电极反应;了解
每一类电池的优
缺点;对其它电
池有初步的认识
