第四章第一节无机非金属材料的主角-硅同步练习(含答案)
文档属性
| 名称 | 第四章第一节无机非金属材料的主角-硅同步练习(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-17 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第四章第一节无机非金属材料的主角-硅
第I卷(选择题)
一、单选题
1.“一带一路”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会共同理想和美好追求。下列贸易的商品中,主要成分属于蛋白质的是(
)
A.捷克水晶
B.埃及长绒棉
C.乌克兰葵花籽油
D.中国丝绸
2.据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可轻易制备出超高强度和超高耐久性能的高性能混凝土。关于二氧化硅下列说法中正确的是
A.二氧化硅溶于水显酸性,所以它是酸性氧化物
B.二氧化硅是酸性氧化物,它不溶于任何酸
C.二氧化硅能与烧碱和氢氟酸反应,它是两性氧化物
D.二氧化硅是一种熔点高、硬度大的固体
3.制备单质硅时,主要发生化学反应:①;②;③。下列对这三个反应的叙述不正确的是(
)
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素均被氧化
4.赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是
A.盐酸
B.烧碱
C.氢氟酸
D.纯碱
5.下列有关材料的说法正确的是
A.“神舟”飞船航天员穿的航天服使用的多种合成纤维是天然有机高分子材料
B.“超轻海绵”使用的石墨烯是新型无机非金属材料
C.“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于纯金属材料
D.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
6.下列有关物质的用途说法不正确的是(
)
A.明矾可用于饮用水的消毒
B.二氧化硅可用于制造光导纤维
C.水玻璃可用作木材防火剂
D.氧化铁可用作红色颜料
7.硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是
A.水晶镜片
B.玛瑙手镯
C.硅太阳能电池
D.石英光导纤维
8.存放食品和药品的包装盒中常放有一袋半透明的球形颗粒,该颗粒的主要作用是保证食品和药品的干燥,其成分可能是
A.活性炭
B.氯化钠
C.硅胶
D.小苏打
9.硅及其化合物在材料领域中应用广泛。下列叙述正确的是(
)
A.晶体硅可做光导纤维
B.SiO2
可与水反应制备硅胶
C.玻璃、水泥、陶瓷都是硅酸盐产品
D.SiO2
与
NaOH
和
HF
均可反应,属于两性氧化物
10.下列有关无机材料的叙述正确的是
A.工业上常用电解法来生产铝、钠、铁等金属
B.工业生产玻璃和水泥均要用到石灰石
C.硅是生产计算机芯片的原料,二氧化硅是制造太阳能电池的原料
D.耐高温的碳化硅陶瓷是新型无机非金属材料,属于高分子化合物
11.在给定条件下,下列选项所示的物质间转化均能实现的是(
)
A.FeFeCl2Fe(OH)2
B.SiSiO2H2SiO3
C.CaCO3CaOCaSiO3
D.AlAl2O3Al(OH)3
12.下列物质与水混合得到的溶液不能使酚酞变红的是(
)
A.Na2SiO3
B.Na2CO3
C.Na2O
D.NaCl
13.化学与生产、生活、科技、环境等密切相关。下列说法正确的是(
)
A.指南针由天然磁石制成,磁石的主要成分是Fe2O3
B.活字印刷使用的胶泥由Al2O3、SiO2、CaO等组成,它们都属于碱性氧化物
C.用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
D.中国天眼FAST用到的碳化硅是一种传统的硅酸盐材料
14.下列方法不合理的是(
)
A.用Ba(OH)2溶液鉴别Na2CO3和NaHCO3
B.用水鉴别乙醇和四氯化碳
C.用澄清石灰水鉴别CO和CO2
D.用硫酸鉴别碳酸钠、硅酸钠和硫酸钠
15.陶瓷是火与土的结晶,其形成、性质与化学有着密切的关系,下列说法错误的是(
)
A.瓷器青色,来自氧化铁
B.陶瓷由粘土经高温烧结而成
C.陶瓷主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有抗氧化等优点
16.下列说法不正确的是(
)
A.电解熔融氯化铝可制取金属铝
B.CO高温条件下还原氧化铁可制铁
C.生产普通玻璃的主要原料为石灰石、纯碱和石英砂
D.用SiO2和C高温条件下制粗硅
17.汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:
BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是(
)
A.用盐的形式表示:
BaSiO3·CuSiO3
B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱
D.性质稳定,不易褪色
18.现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,若经测量两次实验产生的气体质量相等,则原混合物中Fe、Al、Si三种单质的物质的量之比可能为( )
A.6:4:3
B.1:1:1
C.2:3:4
D.3:7:6
19.X、Y、Z、W四种物质存在如图所示的转化关系:
下列说法错误的是
A.若X为镁,Z为氧化镁,则Y可能为二氧化碳
B.若X为硫酸铜溶液,Z为红色固体物质,则Y可能为钾
C.若X、Z均为非金属单质,则Y可能为二氧化硅
D.若X、Z均为金属单质,则Y可能为二氧化锰
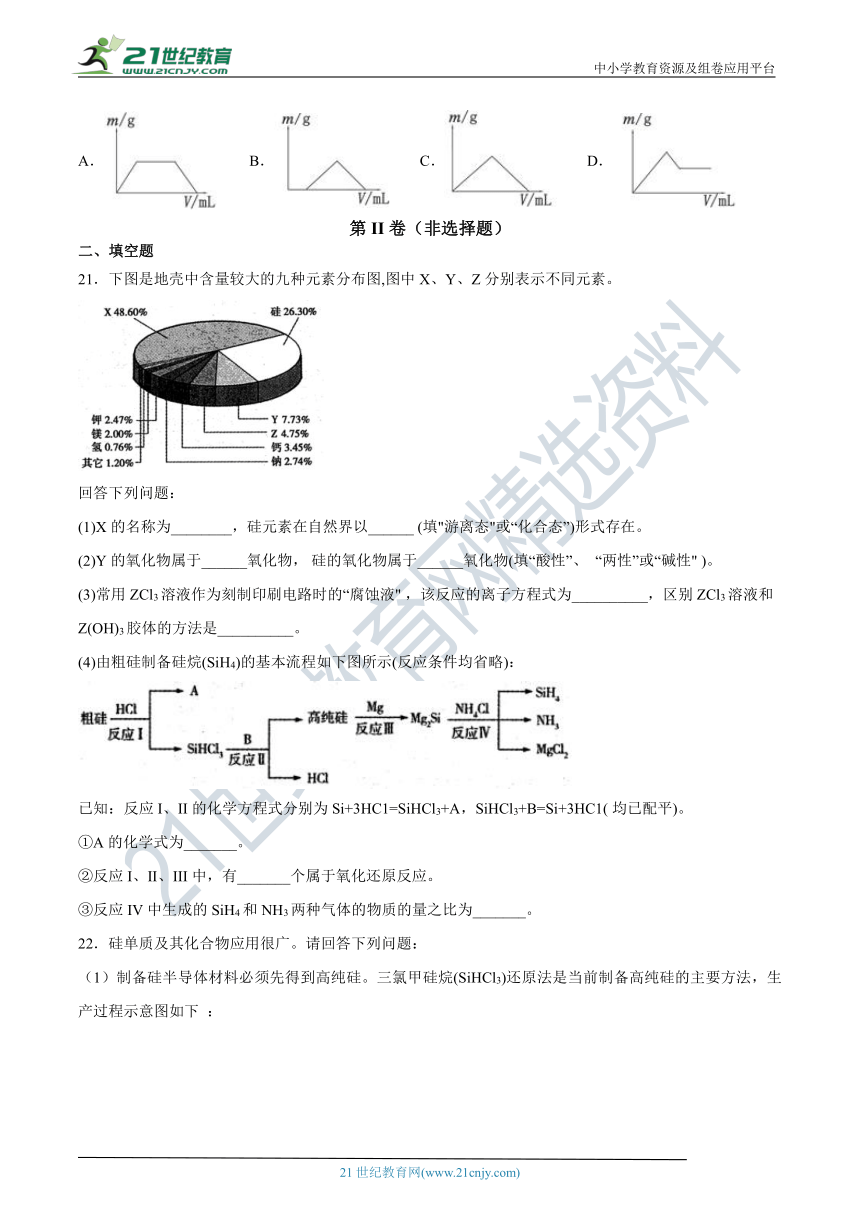
20.将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系正确的是
A.
B.
C.
D.
第II卷(非选择题)
二、填空题
21.下图是地壳中含量较大的九种元素分布图,图中X、Y、Z分别表示不同元素。
回答下列问题:
(1)X的名称为________,硅元素在自然界以______?(填"游离态"或“化合态”)形式存在。
(2)Y的氧化物属于______氧化物,?硅的氧化物属于______氧化物(填“酸性”、
“两性”或“碱性"?)。
(3)常用ZCl3溶液作为刻制印刷电路时的“腐蚀液"?,该反应的离子方程式为__________,区别ZCl3溶液和Z(OH)3胶体的方法是__________。
(4)由粗硅制备硅烷(SiH4)的基本流程如下图所示(反应条件均省略):
已知:反应I、II的化学方程式分别为Si+3HC1=SiHCl3+A,SiHCl3+B=Si+3HC1(?均已配平)。
①A的化学式为_______。
②反应I、II、III中,有_______个属于氧化还原反应。
③反应IV中生成的SiH4和NH3两种气体的物质的量之比为_______。
22.硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下
:
①写出由纯SiHCl3制备高纯硅的化学反应方程式
。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式
;H2还原SiHCl3过程中若混有O2,可能引起的后果是
。
(2)下列有关硅材料的说法正确的是
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)
。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是
(填字母)。
A.高温结构陶瓷
B.生物陶瓷
C.导电陶瓷
23.霞石是一种硅酸盐,其组成可表示为K2O·3Na2O·4Al2O3·8SiO2。某小组同学设计以霞石为原料制备Al2O3的方案如下:
已知:NaAlO2
+
CO2
+
2H2O
Al(OH)3↓
+
NaHCO3
请回答下列问题:
(1)沉淀1的主要成分的化学式为
。在实验室进行过滤操作需要的玻璃仪器有___________。
(2)由溶液2生成沉淀2的离子方程式为
。
(3)向滤液1中加入过量NaOH溶液,有关反应的离子方程式是
、
。
(4)某同学提出上述流程较繁琐,可简化流程,其方法是向滤液1中加入足量的试剂X即可得到Al(OH)3,则试剂X为
。
三、推断题
24.A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
请回答:
(1)写出对应物质的化学式:A__________;
C_________;
E_________。
(2)反应①的化学方程式为:_____________________________________。
(3)反应④的离子方程式为:_____________________________________。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明:
_________________________。
四、实验题
25.工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式___________。工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg
+
Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
A.石灰石 B.锌粒 C.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是
_______________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①________________,②_________________
参考答案
1.D
2.D
3.D
4.C
5.B
6.A
7.C
8.C
9.C
10.B
11.C
12.D
13.C
14.A
15.A
16.A
17.C
18.A
19.B
20.A
21.氧
化合态
两性
酸性
2Fe3++Cu=2Fe2++Ca2+
丁达尔效应
H2
3
1:4
22.(1)①SiHCl3+H2Si+3HCl
;
②SiHCl3+3H2O=H2SiO3+H2↑+3HCl↑;高温下,H2遇O2可能会引起爆炸;O2可能会氧化SiHCl3
(2)AD;(3)生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓;(4)B
23.(1)SiO2
烧杯、玻璃棒、漏斗
(2)AlO2-
+
CO2
+
2H2OAl(OH)3↓
+
HCO3-
(3)H++
OH-
H2O
Al3++
4OH-
AlO2-
+
2H2O(4)
氨水
24.SiO2
Na2SiO3
H2SiO3(或H4SiO4)
SiO2+2CSi+2CO↑
Si+2OH-+H2O===
SiO32-+2H2↑
SiO32-+CO2+H2O===H2SiO3↓+HCO32-
或SiO32-+CO2+H2O===H2SiO3↓+CO32-(写成H4SiO4同样给分)
25.SiO2
+
2C
Si
+
2CO↑
b
防止加热条件下H2与空气混合爆炸
Mg与SiO2的反应是放热反应
Mg2Si+4HCl=
2MgCl2+SiH4↑
SiH4+2O2
=
SiO2↓+2H2O
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
第四章第一节无机非金属材料的主角-硅
第I卷(选择题)
一、单选题
1.“一带一路”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会共同理想和美好追求。下列贸易的商品中,主要成分属于蛋白质的是(
)
A.捷克水晶
B.埃及长绒棉
C.乌克兰葵花籽油
D.中国丝绸
2.据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可轻易制备出超高强度和超高耐久性能的高性能混凝土。关于二氧化硅下列说法中正确的是
A.二氧化硅溶于水显酸性,所以它是酸性氧化物
B.二氧化硅是酸性氧化物,它不溶于任何酸
C.二氧化硅能与烧碱和氢氟酸反应,它是两性氧化物
D.二氧化硅是一种熔点高、硬度大的固体
3.制备单质硅时,主要发生化学反应:①;②;③。下列对这三个反应的叙述不正确的是(
)
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素均被氧化
4.赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是
A.盐酸
B.烧碱
C.氢氟酸
D.纯碱
5.下列有关材料的说法正确的是
A.“神舟”飞船航天员穿的航天服使用的多种合成纤维是天然有机高分子材料
B.“超轻海绵”使用的石墨烯是新型无机非金属材料
C.“辽宁舰”上用于舰载机降落的阻拦索是一种特种钢缆,属于纯金属材料
D.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
6.下列有关物质的用途说法不正确的是(
)
A.明矾可用于饮用水的消毒
B.二氧化硅可用于制造光导纤维
C.水玻璃可用作木材防火剂
D.氧化铁可用作红色颜料
7.硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤。在无机非金属材料中,硅一直扮演着主角。下面几种物质中含有硅单质的是
A.水晶镜片
B.玛瑙手镯
C.硅太阳能电池
D.石英光导纤维
8.存放食品和药品的包装盒中常放有一袋半透明的球形颗粒,该颗粒的主要作用是保证食品和药品的干燥,其成分可能是
A.活性炭
B.氯化钠
C.硅胶
D.小苏打
9.硅及其化合物在材料领域中应用广泛。下列叙述正确的是(
)
A.晶体硅可做光导纤维
B.SiO2
可与水反应制备硅胶
C.玻璃、水泥、陶瓷都是硅酸盐产品
D.SiO2
与
NaOH
和
HF
均可反应,属于两性氧化物
10.下列有关无机材料的叙述正确的是
A.工业上常用电解法来生产铝、钠、铁等金属
B.工业生产玻璃和水泥均要用到石灰石
C.硅是生产计算机芯片的原料,二氧化硅是制造太阳能电池的原料
D.耐高温的碳化硅陶瓷是新型无机非金属材料,属于高分子化合物
11.在给定条件下,下列选项所示的物质间转化均能实现的是(
)
A.FeFeCl2Fe(OH)2
B.SiSiO2H2SiO3
C.CaCO3CaOCaSiO3
D.AlAl2O3Al(OH)3
12.下列物质与水混合得到的溶液不能使酚酞变红的是(
)
A.Na2SiO3
B.Na2CO3
C.Na2O
D.NaCl
13.化学与生产、生活、科技、环境等密切相关。下列说法正确的是(
)
A.指南针由天然磁石制成,磁石的主要成分是Fe2O3
B.活字印刷使用的胶泥由Al2O3、SiO2、CaO等组成,它们都属于碱性氧化物
C.用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
D.中国天眼FAST用到的碳化硅是一种传统的硅酸盐材料
14.下列方法不合理的是(
)
A.用Ba(OH)2溶液鉴别Na2CO3和NaHCO3
B.用水鉴别乙醇和四氯化碳
C.用澄清石灰水鉴别CO和CO2
D.用硫酸鉴别碳酸钠、硅酸钠和硫酸钠
15.陶瓷是火与土的结晶,其形成、性质与化学有着密切的关系,下列说法错误的是(
)
A.瓷器青色,来自氧化铁
B.陶瓷由粘土经高温烧结而成
C.陶瓷主要化学成分是硅酸盐
D.陶瓷化学性质稳定,具有抗氧化等优点
16.下列说法不正确的是(
)
A.电解熔融氯化铝可制取金属铝
B.CO高温条件下还原氧化铁可制铁
C.生产普通玻璃的主要原料为石灰石、纯碱和石英砂
D.用SiO2和C高温条件下制粗硅
17.汉代器物上的颜料“汉紫”至今尚没有发现其自然存在的记载。20世纪80年代科学家进行超导材料研究时,偶然发现其成分为紫色的硅酸铜钡(化学式:
BaCuSi2Ox,Cu为+2价),下列有关“汉紫”的说法中不正确的是(
)
A.用盐的形式表示:
BaSiO3·CuSiO3
B.用氧化物形式表示:BaO·CuO·2SiO2
C.易溶于强酸、强碱
D.性质稳定,不易褪色
18.现有Fe、Al、Si三种单质的混合物,取一半投入足量的NaOH溶液中,将剩余的一半投入足量的稀硫酸中,若经测量两次实验产生的气体质量相等,则原混合物中Fe、Al、Si三种单质的物质的量之比可能为( )
A.6:4:3
B.1:1:1
C.2:3:4
D.3:7:6
19.X、Y、Z、W四种物质存在如图所示的转化关系:
下列说法错误的是
A.若X为镁,Z为氧化镁,则Y可能为二氧化碳
B.若X为硫酸铜溶液,Z为红色固体物质,则Y可能为钾
C.若X、Z均为非金属单质,则Y可能为二氧化硅
D.若X、Z均为金属单质,则Y可能为二氧化锰
20.将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系正确的是
A.
B.
C.
D.
第II卷(非选择题)
二、填空题
21.下图是地壳中含量较大的九种元素分布图,图中X、Y、Z分别表示不同元素。
回答下列问题:
(1)X的名称为________,硅元素在自然界以______?(填"游离态"或“化合态”)形式存在。
(2)Y的氧化物属于______氧化物,?硅的氧化物属于______氧化物(填“酸性”、
“两性”或“碱性"?)。
(3)常用ZCl3溶液作为刻制印刷电路时的“腐蚀液"?,该反应的离子方程式为__________,区别ZCl3溶液和Z(OH)3胶体的方法是__________。
(4)由粗硅制备硅烷(SiH4)的基本流程如下图所示(反应条件均省略):
已知:反应I、II的化学方程式分别为Si+3HC1=SiHCl3+A,SiHCl3+B=Si+3HC1(?均已配平)。
①A的化学式为_______。
②反应I、II、III中,有_______个属于氧化还原反应。
③反应IV中生成的SiH4和NH3两种气体的物质的量之比为_______。
22.硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下
:
①写出由纯SiHCl3制备高纯硅的化学反应方程式
。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式
;H2还原SiHCl3过程中若混有O2,可能引起的后果是
。
(2)下列有关硅材料的说法正确的是
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡。写出实验现象并给予解释(用化学方程式说明)
。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是
(填字母)。
A.高温结构陶瓷
B.生物陶瓷
C.导电陶瓷
23.霞石是一种硅酸盐,其组成可表示为K2O·3Na2O·4Al2O3·8SiO2。某小组同学设计以霞石为原料制备Al2O3的方案如下:
已知:NaAlO2
+
CO2
+
2H2O
Al(OH)3↓
+
NaHCO3
请回答下列问题:
(1)沉淀1的主要成分的化学式为
。在实验室进行过滤操作需要的玻璃仪器有___________。
(2)由溶液2生成沉淀2的离子方程式为
。
(3)向滤液1中加入过量NaOH溶液,有关反应的离子方程式是
、
。
(4)某同学提出上述流程较繁琐,可简化流程,其方法是向滤液1中加入足量的试剂X即可得到Al(OH)3,则试剂X为
。
三、推断题
24.A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。若该元素用R表示,则A为R的氧化物,D与NaOH溶液反应生成C和H2。
请回答:
(1)写出对应物质的化学式:A__________;
C_________;
E_________。
(2)反应①的化学方程式为:_____________________________________。
(3)反应④的离子方程式为:_____________________________________。
(4)H2CO3的酸性强于E的,请用离子方程式予以证明:
_________________________。
四、实验题
25.工业上通常利用SiO2和碳反应来制取硅,写出反应的化学方程式___________。工业上还可以利用镁制取硅,反应为2Mg+SiO2=2MgO+Si,同时会发生副反应:2Mg
+
Si=Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
A.石灰石 B.锌粒 C.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是
_______________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃。用化学方程式表示这两个反应①________________,②_________________
参考答案
1.D
2.D
3.D
4.C
5.B
6.A
7.C
8.C
9.C
10.B
11.C
12.D
13.C
14.A
15.A
16.A
17.C
18.A
19.B
20.A
21.氧
化合态
两性
酸性
2Fe3++Cu=2Fe2++Ca2+
丁达尔效应
H2
3
1:4
22.(1)①SiHCl3+H2Si+3HCl
;
②SiHCl3+3H2O=H2SiO3+H2↑+3HCl↑;高温下,H2遇O2可能会引起爆炸;O2可能会氧化SiHCl3
(2)AD;(3)生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓;(4)B
23.(1)SiO2
烧杯、玻璃棒、漏斗
(2)AlO2-
+
CO2
+
2H2OAl(OH)3↓
+
HCO3-
(3)H++
OH-
H2O
Al3++
4OH-
AlO2-
+
2H2O(4)
氨水
24.SiO2
Na2SiO3
H2SiO3(或H4SiO4)
SiO2+2CSi+2CO↑
Si+2OH-+H2O===
SiO32-+2H2↑
SiO32-+CO2+H2O===H2SiO3↓+HCO32-
或SiO32-+CO2+H2O===H2SiO3↓+CO32-(写成H4SiO4同样给分)
25.SiO2
+
2C
Si
+
2CO↑
b
防止加热条件下H2与空气混合爆炸
Mg与SiO2的反应是放热反应
Mg2Si+4HCl=
2MgCl2+SiH4↑
SiH4+2O2
=
SiO2↓+2H2O
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
