第四章第三节硫和氮的氧化物 同步练习(含答案)
文档属性
| 名称 | 第四章第三节硫和氮的氧化物 同步练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-17 09:43:34 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第四章第三节硫和氮的氧化物
第I卷(选择题)
一、单选题
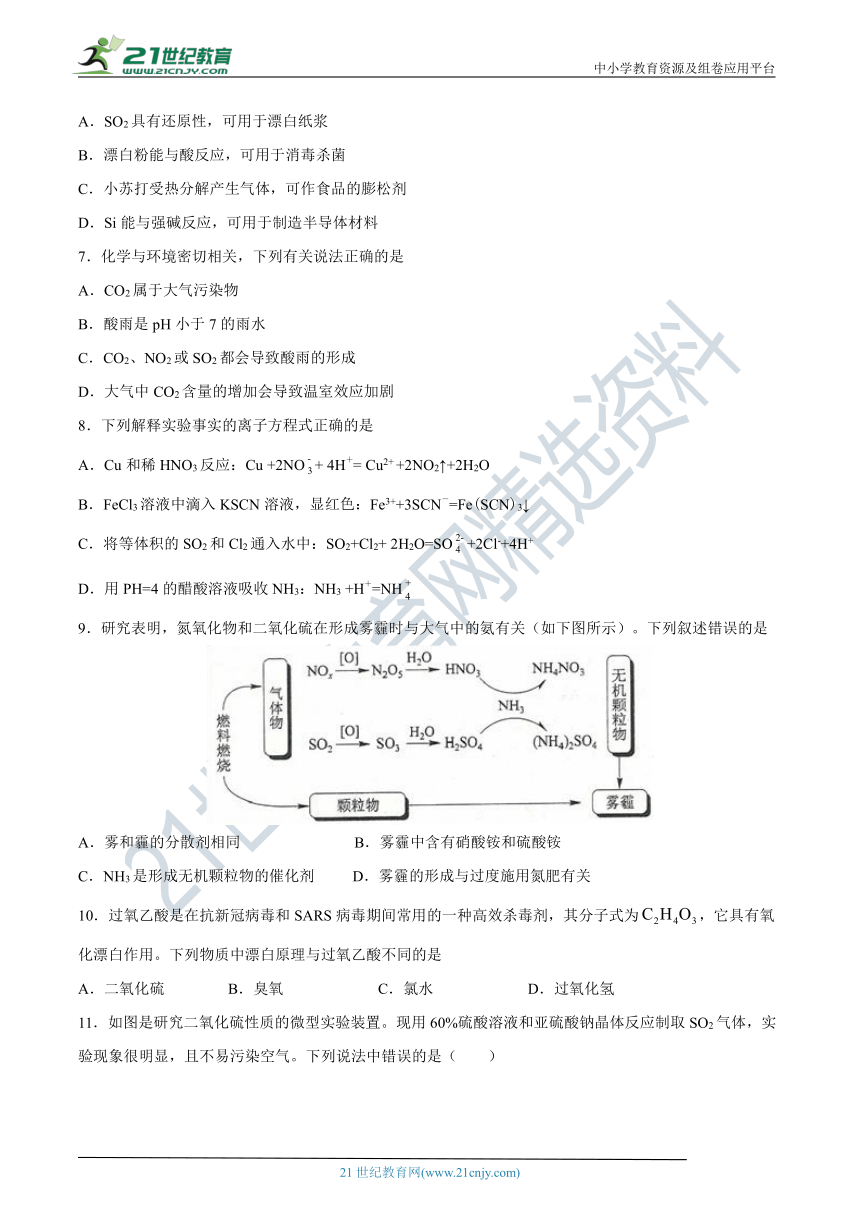
1.下列物质在氧气中燃烧会产生蓝紫色火焰的是( )
A.铁
B.木炭
C.氢气
D.硫
2.近年来,环境问题越来越引起人们的重视。温室效应、酸雨、臭氧层被破坏、赤潮等已经给我们赖以生存的环境带来较大的影响,造成酸雨的主要有害物质是
A.CO2
B.硫和氮的氧化物
C.含氟化合物
D.化肥和含磷洗衣粉的使用及其污水的排放
3.自然界中氮的循环如图所示。下列说法不正确的是(
)
A.工业合成氨属于人工固氮
B.在雷电作用下N2与O2发生化学反应
C.在氮的循环过程中不涉及氧化还原反应
D.含氮无机物与含氮有机物可相互转化
4.下列变化中,不属于化学变化的是(
)
A.使品红溶液褪色
B.氯水使有色布条褪色
C.使某些颜料褪色
D.活性炭使红墨水褪色
5.我国城市环境中的大气污染物主要是
A.SO2、NO2、CO、粉尘
B.HCl、O2、N2、粉尘
C.CO、Cl2、N2、酸雨
D.NH3、CO2、NO、雾
6.下列物质的化学性质与用途具有对应关系的是
A.SO2具有还原性,可用于漂白纸浆
B.漂白粉能与酸反应,可用于消毒杀菌
C.小苏打受热分解产生气体,可作食品的膨松剂
D.Si能与强碱反应,可用于制造半导体材料
7.化学与环境密切相关,下列有关说法正确的是
A.CO2属于大气污染物
B.酸雨是pH小于7的雨水
C.CO2、NO2或SO2都会导致酸雨的形成
D.大气中CO2含量的增加会导致温室效应加剧
8.下列解释实验事实的离子方程式正确的是
A.Cu和稀HNO3反应:Cu
+2NO+
4H+=
Cu2+
+2NO2↑+2H2O
B.FeCl3溶液中滴入KSCN溶液,显红色:Fe3++3SCN-=Fe(SCN)3↓
C.将等体积的SO2和Cl2通入水中:SO2+Cl2+
2H2O=SO+2Cl-+4H+
D.用PH=4的醋酸溶液吸收NH3:NH3
+H+=NH
9.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
10.过氧乙酸是在抗新冠病毒和SARS病毒期间常用的一种高效杀毒剂,其分子式为,它具有氧化漂白作用。下列物质中漂白原理与过氧乙酸不同的是
A.二氧化硫
B.臭氧
C.氯水
D.过氧化氢
11.如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是(
)
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.溴水橙色褪去
D.含酚酞的NaOH溶液红色变浅或褪色
12.无色的混合气体甲,可能含有NO、、、、中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为(
)
A.、、
B.、、
C.、NO、
D.NO、、
13.下列有关三氧化硫的说法中,正确的是
A.三氧化硫极易溶于水,且与水反应生成
B.标准状况下,1的体积约为22.4L
C.硫粉在过量的氧气中燃烧可以生成
D.、均具有漂白性,二者都能使石蕊溶液褪色
14.下列说法不正确的是
A.石灰石、纯碱、石英可作为制备水泥的主要原料
B.燃煤烟气的脱硫过程可以得到副产品石膏和硫酸铵
C.硫酸钡可作高档油漆、油墨、塑料、橡胶的原料及填充剂
D.在催化剂作用下,用玉米、高粱为原料经水解和细菌发酵可制得乙醇
15.H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法不正确的是(
)
A.单质硫为淡黄色固体
B.脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
C.再生过程中,硫元素被还原
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
16.成功合成纳米氮化镓是我国科学家取得的一项重大科技成果,已知镓是ⅢA
族元素,则氮化镓的化学式可能是
A.Ga2N3
B.Ga3N
C.Ga3N2
D.GaN
17.某些化合物可由两种单质加热直接反应生成。下列化合物不符合上述条件的是(
)
A.FeS
B.FeCl2
C.FeCl3
D.Fe3O4
18.某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2===Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
A.通入N2是为了排尽装置中的空气
B.装置B、D中的试剂可分别为水和浓硫酸
C.将铜片换成木炭也可以制备纯净的亚硝酸钙
D.借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
19.将3mol的NO2气体依次通入下列三个分别装有足量①NaHCO3饱和溶液②浓H2SO4③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是同温、同压下测定)
A.1molNO
B.1mol
NO2和0.05molO2
C.2mol
NO2
D.0.25mol
NO2
20.如图所示,当向集气瓶内通入17.5mLO2时,最后试管中液面仍在原来的位置,则原试管中NO的体积为
A.10mL
B.12mL
C.14mL
D.8mL
第II卷(非选择题)
二、填空题
21.现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是其电子层数的3倍,C+和D3+的电子层结构相同,B与E属于同一主族。
(1)E在元素周期表中的位置是____________。
(2)上述元素形成的简单离子中,半径最小的是________(填离子符号)。
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:
①若乙具有漂白性,则乙的电子式为____________。
②若丙的水溶液是强碱性溶液,则甲为____________或____________(填化学式)。
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为____________。
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确。用如图装置进行实验时,分液漏斗中应加入________(填试剂名称)。实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是____________________。
22.实验室中要测定某无色气体的成份,已知此气体可能由CO2、NH3、NO2、N2、NO中的一种或几种混合而成。将此无色气体进行以下实验:①先通过盛有浓硫酸的洗气瓶,发现气体减少一部分体积;②继续通过装有Na2O2固体的干燥管,发现从干燥管出来的气体颜色呈红棕色;③再继续将气体通入盛满水倒立于水槽中的试管内,气体被完全被吸收。由此判断:
(1)原气体中一定含有
,一定不含有
。
(2)写出②中发生反应的化学方程式
;
_____________。
(3)由最终结果可知原气体中
和
的体积比为
。
三、计算题
23.某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成2.4
g硫单质、0.425
mol
FeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为_____________。
(2)该磁黄铁矿FexS中,x=_________________。
四、推断题
24.非金属单质A经过如图所示的过程转化为含氧酸D。已知D为强酸,请回答下列问题:
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是_
__。
②在工业生产中气体B大量排放后,被雨水吸收形成了污染环境的_
__。
(2)A在常温下为气体,C是红棕色的气体。
①A的化学式是_
__;C的化学式是__
_。
②在常温下D的浓溶液可与铜反应并生成气体C,请写出该反应的化学方程式:___,该反应__(填“属于”或“不属于”)氧化还原反应。
25.有关物质的转化关系如图所示。A是生活中常用的调味品,B是常见的无色液体。气体C是空气的主要成分之一,I的溶液常用作漂白剂。气体H的水溶液显碱性。J的摩尔质量是32g·mol-1,且与H所含元素种类相同。
回答下列问题:
(1)C的结构式是_____,I的化学式是_____。
(2)反应①的离子方程式是___
___。
(3)反应②的化学方程式是___
___。
参考答案
1.D
2.B
3.C
4.D
5.A
6.C
7.D
8.C
9.C
10.A
11.A
12.C
13.A
14.A
15.C
16.D
17.B
18.C
19.D
20.A
21.(1)第三周期,ⅥA族(2)Al3+
(2)(3)①②Na或Na2O2
③氯化氢
④浓硝酸
浓硫酸不能干燥二氧化氮气体
22.(1)NH3、CO2、NO,
N2、NO2,(2)2Na2O2+
2CO2=
2Na2CO3
+
O2,
2NO+O2=2NO2(3)CO2和NO;3:2
23.11∶6
0.85
24.H2SO4
酸雨
N2
NO2
Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O
属于
25.N≡N
NaClO
2Cl-+2H2OCl2↑+H2↑+2OH-
NaClO+2NH3=NaCl+N2H4+H2O
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
第四章第三节硫和氮的氧化物
第I卷(选择题)
一、单选题
1.下列物质在氧气中燃烧会产生蓝紫色火焰的是( )
A.铁
B.木炭
C.氢气
D.硫
2.近年来,环境问题越来越引起人们的重视。温室效应、酸雨、臭氧层被破坏、赤潮等已经给我们赖以生存的环境带来较大的影响,造成酸雨的主要有害物质是
A.CO2
B.硫和氮的氧化物
C.含氟化合物
D.化肥和含磷洗衣粉的使用及其污水的排放
3.自然界中氮的循环如图所示。下列说法不正确的是(
)
A.工业合成氨属于人工固氮
B.在雷电作用下N2与O2发生化学反应
C.在氮的循环过程中不涉及氧化还原反应
D.含氮无机物与含氮有机物可相互转化
4.下列变化中,不属于化学变化的是(
)
A.使品红溶液褪色
B.氯水使有色布条褪色
C.使某些颜料褪色
D.活性炭使红墨水褪色
5.我国城市环境中的大气污染物主要是
A.SO2、NO2、CO、粉尘
B.HCl、O2、N2、粉尘
C.CO、Cl2、N2、酸雨
D.NH3、CO2、NO、雾
6.下列物质的化学性质与用途具有对应关系的是
A.SO2具有还原性,可用于漂白纸浆
B.漂白粉能与酸反应,可用于消毒杀菌
C.小苏打受热分解产生气体,可作食品的膨松剂
D.Si能与强碱反应,可用于制造半导体材料
7.化学与环境密切相关,下列有关说法正确的是
A.CO2属于大气污染物
B.酸雨是pH小于7的雨水
C.CO2、NO2或SO2都会导致酸雨的形成
D.大气中CO2含量的增加会导致温室效应加剧
8.下列解释实验事实的离子方程式正确的是
A.Cu和稀HNO3反应:Cu
+2NO+
4H+=
Cu2+
+2NO2↑+2H2O
B.FeCl3溶液中滴入KSCN溶液,显红色:Fe3++3SCN-=Fe(SCN)3↓
C.将等体积的SO2和Cl2通入水中:SO2+Cl2+
2H2O=SO+2Cl-+4H+
D.用PH=4的醋酸溶液吸收NH3:NH3
+H+=NH
9.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
10.过氧乙酸是在抗新冠病毒和SARS病毒期间常用的一种高效杀毒剂,其分子式为,它具有氧化漂白作用。下列物质中漂白原理与过氧乙酸不同的是
A.二氧化硫
B.臭氧
C.氯水
D.过氧化氢
11.如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是(
)
A.紫色石蕊溶液变蓝色
B.品红溶液褪色
C.溴水橙色褪去
D.含酚酞的NaOH溶液红色变浅或褪色
12.无色的混合气体甲,可能含有NO、、、、中的某几种。将100mL甲气体经过如下图的实验处理,结果得到酸性溶液,而几乎无气体剩余。则甲气体的组成为(
)
A.、、
B.、、
C.、NO、
D.NO、、
13.下列有关三氧化硫的说法中,正确的是
A.三氧化硫极易溶于水,且与水反应生成
B.标准状况下,1的体积约为22.4L
C.硫粉在过量的氧气中燃烧可以生成
D.、均具有漂白性,二者都能使石蕊溶液褪色
14.下列说法不正确的是
A.石灰石、纯碱、石英可作为制备水泥的主要原料
B.燃煤烟气的脱硫过程可以得到副产品石膏和硫酸铵
C.硫酸钡可作高档油漆、油墨、塑料、橡胶的原料及填充剂
D.在催化剂作用下,用玉米、高粱为原料经水解和细菌发酵可制得乙醇
15.H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法不正确的是(
)
A.单质硫为淡黄色固体
B.脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
C.再生过程中,硫元素被还原
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
16.成功合成纳米氮化镓是我国科学家取得的一项重大科技成果,已知镓是ⅢA
族元素,则氮化镓的化学式可能是
A.Ga2N3
B.Ga3N
C.Ga3N2
D.GaN
17.某些化合物可由两种单质加热直接反应生成。下列化合物不符合上述条件的是(
)
A.FeS
B.FeCl2
C.FeCl3
D.Fe3O4
18.某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2===Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
A.通入N2是为了排尽装置中的空气
B.装置B、D中的试剂可分别为水和浓硫酸
C.将铜片换成木炭也可以制备纯净的亚硝酸钙
D.借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
19.将3mol的NO2气体依次通入下列三个分别装有足量①NaHCO3饱和溶液②浓H2SO4③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是同温、同压下测定)
A.1molNO
B.1mol
NO2和0.05molO2
C.2mol
NO2
D.0.25mol
NO2
20.如图所示,当向集气瓶内通入17.5mLO2时,最后试管中液面仍在原来的位置,则原试管中NO的体积为
A.10mL
B.12mL
C.14mL
D.8mL
第II卷(非选择题)
二、填空题
21.现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是其电子层数的3倍,C+和D3+的电子层结构相同,B与E属于同一主族。
(1)E在元素周期表中的位置是____________。
(2)上述元素形成的简单离子中,半径最小的是________(填离子符号)。
(3)由上述元素中的一种或几种组成的物质甲可以发生如下反应:
①若乙具有漂白性,则乙的电子式为____________。
②若丙的水溶液是强碱性溶液,则甲为____________或____________(填化学式)。
③若乙为二元弱酸,丙既能溶于强酸、又能溶于强碱,则乙的名称为____________。
④乙遇空气变为红棕色,有同学认为“浓硫酸可以干燥气体甲”,为验证其观点是否正确。用如图装置进行实验时,分液漏斗中应加入________(填试剂名称)。实验过程中,浓硫酸中未发现有气体逸出,且溶液变为红棕色,由此得出的结论是____________________。
22.实验室中要测定某无色气体的成份,已知此气体可能由CO2、NH3、NO2、N2、NO中的一种或几种混合而成。将此无色气体进行以下实验:①先通过盛有浓硫酸的洗气瓶,发现气体减少一部分体积;②继续通过装有Na2O2固体的干燥管,发现从干燥管出来的气体颜色呈红棕色;③再继续将气体通入盛满水倒立于水槽中的试管内,气体被完全被吸收。由此判断:
(1)原气体中一定含有
,一定不含有
。
(2)写出②中发生反应的化学方程式
;
_____________。
(3)由最终结果可知原气体中
和
的体积比为
。
三、计算题
23.某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成2.4
g硫单质、0.425
mol
FeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为_____________。
(2)该磁黄铁矿FexS中,x=_________________。
四、推断题
24.非金属单质A经过如图所示的过程转化为含氧酸D。已知D为强酸,请回答下列问题:
(1)A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是_
__。
②在工业生产中气体B大量排放后,被雨水吸收形成了污染环境的_
__。
(2)A在常温下为气体,C是红棕色的气体。
①A的化学式是_
__;C的化学式是__
_。
②在常温下D的浓溶液可与铜反应并生成气体C,请写出该反应的化学方程式:___,该反应__(填“属于”或“不属于”)氧化还原反应。
25.有关物质的转化关系如图所示。A是生活中常用的调味品,B是常见的无色液体。气体C是空气的主要成分之一,I的溶液常用作漂白剂。气体H的水溶液显碱性。J的摩尔质量是32g·mol-1,且与H所含元素种类相同。
回答下列问题:
(1)C的结构式是_____,I的化学式是_____。
(2)反应①的离子方程式是___
___。
(3)反应②的化学方程式是___
___。
参考答案
1.D
2.B
3.C
4.D
5.A
6.C
7.D
8.C
9.C
10.A
11.A
12.C
13.A
14.A
15.C
16.D
17.B
18.C
19.D
20.A
21.(1)第三周期,ⅥA族(2)Al3+
(2)(3)①②Na或Na2O2
③氯化氢
④浓硝酸
浓硫酸不能干燥二氧化氮气体
22.(1)NH3、CO2、NO,
N2、NO2,(2)2Na2O2+
2CO2=
2Na2CO3
+
O2,
2NO+O2=2NO2(3)CO2和NO;3:2
23.11∶6
0.85
24.H2SO4
酸雨
N2
NO2
Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O
属于
25.N≡N
NaClO
2Cl-+2H2OCl2↑+H2↑+2OH-
NaClO+2NH3=NaCl+N2H4+H2O
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
