物质的量的单位——摩尔
图片预览




文档简介
(共11张PPT)
一滴水(约0.05mL)大约含有17万亿亿个水分子。如果一个个地去数,即使分秒不停,一个人一生也无法完成这项工作!
物质的量的单位——摩尔
重庆市育才中学校 王明
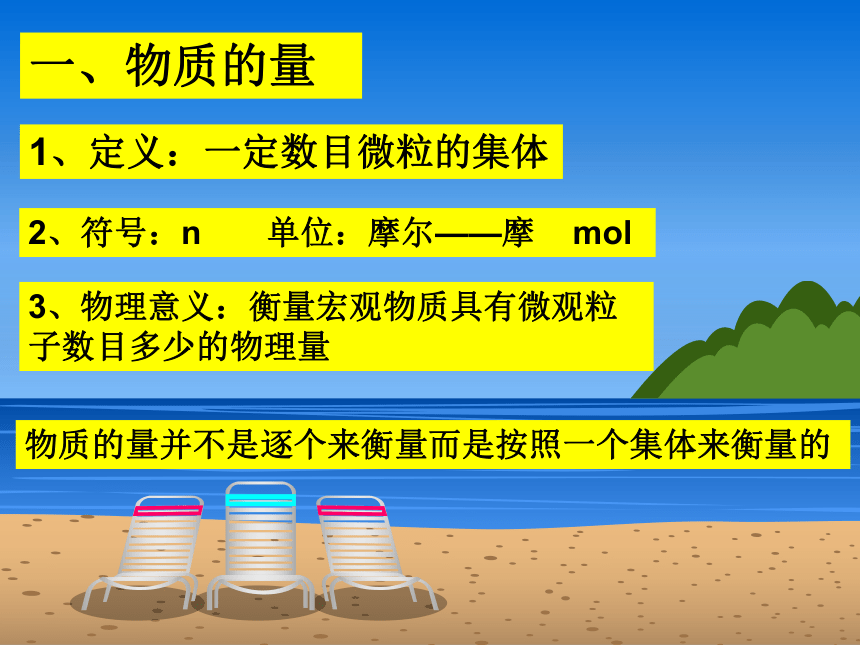
一、物质的量
1、定义:一定数目微粒的集体
2、符号:n 单位:摩尔——摩 mol
3、物理意义:衡量宏观物质具有微观粒子数目多少的物理量
物质的量并不是逐个来衡量而是按照一个集体来衡量的
③使用mol作为物质的量的单位时,必须用化学式指明微粒种类
4、使用规范
①只适用于微观粒子
②这四个字为一个整体同时出现,不能增也不能减
二、标准
1、以0.012kg12C中含有的碳原子数作为标准。
1mol任何粒子含有的粒子数目与0.012kg 12C中含有的碳原子数相等,约为6.02×1023个
2、 1mol任何粒子约含有6.02×1023个组成微粒
3、阿伏加德罗常数:1mol任何粒子所含有的粒子数
NA≈ 6.02×1023mol-1
4、1mol任何微粒含有NA个微粒约6.02×1023个
n (物质的量 )=
N(物质所含微粒数目)
NA(阿伏加德罗常数)
判断
下面叙述是否正确
(A)每摩尔微粒含有 6.02×1023个微粒
(B)摩尔是七个基本物理量之一
(C)摩尔是物质的质量单位
(D)1摩尔大米约含有 6.02×1023个米粒
(E)0.5mol氧表示含O原子 0.5mol
1、1mol12C含有 个12C
2、9.03×1023个水分子的物质的量是 mol
3、1mol H2O有 个H原子, mol H原
子;有 个O原子, mol O原子。
结论:微粒的物质的量之比等于个数之比。
练习
6.02×1023
1.5
1.204×1024
2
6.02×1023
1
4、0.5molH2SO4中含有 个H原子;原子总
数 个,合 mol 。
5、含6.02×1023个H原子的水中,有 mol H2O,
mol O
6、含有1molNa2SO4的溶液中,含有 molNa+,
个SO42-离子
6.02×1023
3.5×6.02×1023
3.5
0.5
0.5
2
6.02×1023
C + O2 == CO2
△
微粒个数
1个
1个
1个
物质的量
1mol
1mol
1mol
2H2 + O2 == 2H2O
△
微粒个数
物质的量
2个
1个
2个
2mol
1mol
2mol
化学反应方程式中,系数之比即反应过程中
各物质的物质的量之比
7、说出下列方程式的含义(读出方程式)
①2Na+2H2O===2NaOH+H2↑
②Cl2+2NaOH===NaCl+NaClO
③CuO+2HCl===CuCl2+H2O
④HCl+NaOH===NaCl+H2O
小 结
1、物质的量的基本概念、物理意义、使用标准
4、n(物质的量)
N(微粒数)
×NA
÷NA
3、NA- 阿伏加德罗常数 (≈6.02×1023/mol)
2、1mol任何微粒含有NA个微粒约6.02×1023个
一滴水(约0.05mL)大约含有17万亿亿个水分子。如果一个个地去数,即使分秒不停,一个人一生也无法完成这项工作!
物质的量的单位——摩尔
重庆市育才中学校 王明
一、物质的量
1、定义:一定数目微粒的集体
2、符号:n 单位:摩尔——摩 mol
3、物理意义:衡量宏观物质具有微观粒子数目多少的物理量
物质的量并不是逐个来衡量而是按照一个集体来衡量的
③使用mol作为物质的量的单位时,必须用化学式指明微粒种类
4、使用规范
①只适用于微观粒子
②这四个字为一个整体同时出现,不能增也不能减
二、标准
1、以0.012kg12C中含有的碳原子数作为标准。
1mol任何粒子含有的粒子数目与0.012kg 12C中含有的碳原子数相等,约为6.02×1023个
2、 1mol任何粒子约含有6.02×1023个组成微粒
3、阿伏加德罗常数:1mol任何粒子所含有的粒子数
NA≈ 6.02×1023mol-1
4、1mol任何微粒含有NA个微粒约6.02×1023个
n (物质的量 )=
N(物质所含微粒数目)
NA(阿伏加德罗常数)
判断
下面叙述是否正确
(A)每摩尔微粒含有 6.02×1023个微粒
(B)摩尔是七个基本物理量之一
(C)摩尔是物质的质量单位
(D)1摩尔大米约含有 6.02×1023个米粒
(E)0.5mol氧表示含O原子 0.5mol
1、1mol12C含有 个12C
2、9.03×1023个水分子的物质的量是 mol
3、1mol H2O有 个H原子, mol H原
子;有 个O原子, mol O原子。
结论:微粒的物质的量之比等于个数之比。
练习
6.02×1023
1.5
1.204×1024
2
6.02×1023
1
4、0.5molH2SO4中含有 个H原子;原子总
数 个,合 mol 。
5、含6.02×1023个H原子的水中,有 mol H2O,
mol O
6、含有1molNa2SO4的溶液中,含有 molNa+,
个SO42-离子
6.02×1023
3.5×6.02×1023
3.5
0.5
0.5
2
6.02×1023
C + O2 == CO2
△
微粒个数
1个
1个
1个
物质的量
1mol
1mol
1mol
2H2 + O2 == 2H2O
△
微粒个数
物质的量
2个
1个
2个
2mol
1mol
2mol
化学反应方程式中,系数之比即反应过程中
各物质的物质的量之比
7、说出下列方程式的含义(读出方程式)
①2Na+2H2O===2NaOH+H2↑
②Cl2+2NaOH===NaCl+NaClO
③CuO+2HCl===CuCl2+H2O
④HCl+NaOH===NaCl+H2O
小 结
1、物质的量的基本概念、物理意义、使用标准
4、n(物质的量)
N(微粒数)
×NA
÷NA
3、NA- 阿伏加德罗常数 (≈6.02×1023/mol)
2、1mol任何微粒含有NA个微粒约6.02×1023个
