第一节 共价键
图片预览




文档简介
(共19张PPT)
第二章 分子结构与性质
第一节 共价键
你能用电子式表示H2、HCl、Cl2分子的形成过程吗?
H2、NaCl、HCl、KOH、Cl2 中有哪些键?
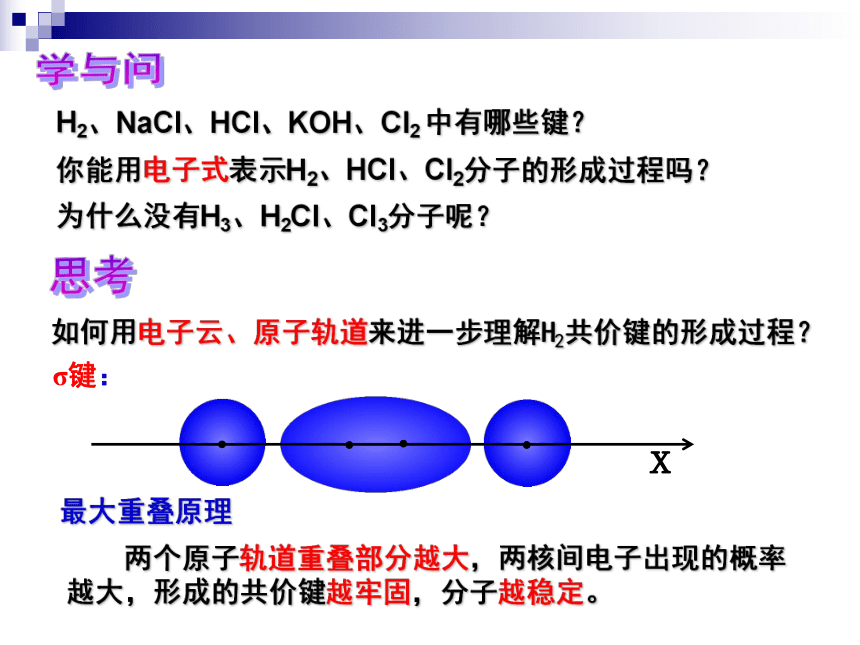
如何用电子云、原子轨道来进一步理解H2共价键的形成过程?
为什么没有H3、H2Cl、Cl3分子呢?
σ键:
x
你能用电子式表示H2、HCl、Cl2分子的形成过程吗?
H2、NaCl、HCl、KOH、Cl2 中有哪些键?
如何用电子云、原子轨道来进一步理解H2共价键的形成过程?
最大重叠原理
两个原子轨道重叠部分越大,两核间电子出现的概率越大,形成的共价键越牢固,分子越稳定。
为什么没有H3、H2Cl、Cl3分子呢?
HCl和Cl2中原子轨道分别是如何重叠的?是否也能形成σ键?
HCl和Cl2中原子轨道分别是如何重叠的?是否也能形成σ键?
x
x
X
s-s σ
X
X
s-p σ
p-p σ
“轴对称”
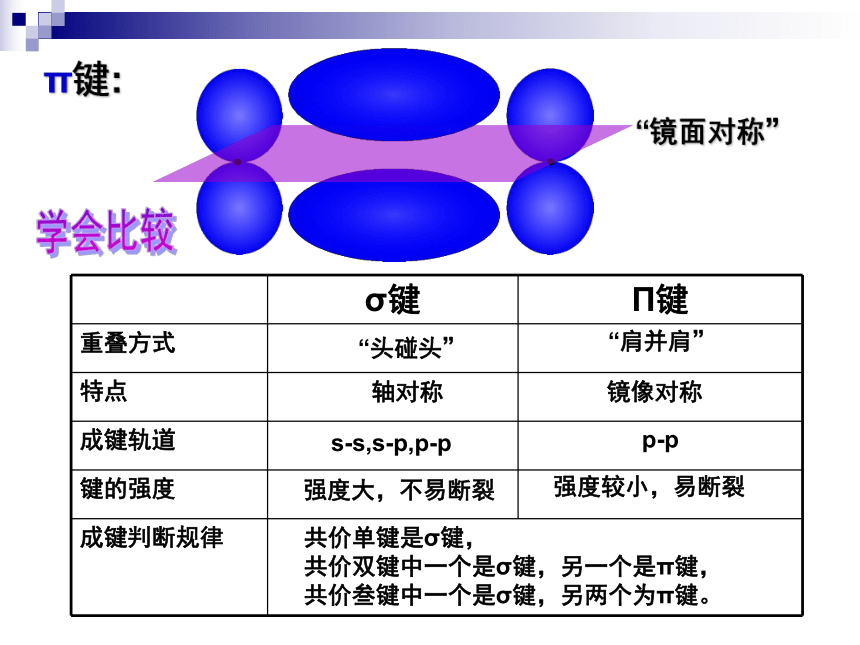
π键:
“镜面对称”
σ键 Π键
重叠方式
特点
成键轨道
键的强度
成键判断规律
“头碰头”
“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
s-s,s-p,p-p
p-p
共价单键是σ键,
共价双键中一个是σ键,另一个是π键,
共价叁键中一个是σ键,另两个为π键。
z
z
y
y
x
1、氮气分子中原子轨道重叠方式如何?
1、氮气分子中原子轨道重叠方式如何?
2.乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?
乙烷中: 个σ键
乙烯中: 个σ键 个π键
乙炔中: 个σ键 个π键
7
5
1
3
2
共价键的形成本质
成键原子相互接近时,原子轨道发生 ,自旋方向 的
电子形成 ,两原子核间的电子概率密度 ,体系的能量 。
重叠
相反
未成对
共用电子对
增 加
降低
1.原子间形成分子时,决定分子组成的是( ) A. 共价键的方向性
B. 共价键的饱和性
C. 形成共价键的原子的大小
D. 共价键的稳定性
B
2.在氯化氢分子中,形成共价键的原子轨道是( ) A. 氯原子的2p轨道和氢原子的1s轨道
B. 氯原子的2p轨道和氢原子的2p轨道
C. 氯原子的3p轨道和氢原子的1s轨道
D. 氯原子的3p轨道和氢原子的3p轨道
C
3.下列说法中正确的是( ) A. p轨道之间以“肩并肩”重叠可形成σ键
B. p轨道之间以“头碰头”重叠可形成π键
C. 共价键是两个原子轨道以“头碰头”重叠形成的
D. s和p轨道以“头碰头”重叠可形成σ键
D
4.下列有关σ键的说法错误的是 ( ) A.两个s-s轨道重叠形成的是σ键
B.s轨道和p轨道重叠形成的是σ键
C.p轨道和p轨道重叠不能σ键
D.HCl分子中含有一个s-pσ键
C
5. 有机物丙烯CH2=CH—CH3分子中有
个σ键, π键。
8
1
6. 乙烯分子中C-C之间有 个σ键,
个π键。乙烯易发生加成反应是
因为分子中C-C之间的一个 键易
断裂。
1
1
π
自制σ键、π键模型。
谢 谢!
第二章 分子结构与性质
第一节 共价键
你能用电子式表示H2、HCl、Cl2分子的形成过程吗?
H2、NaCl、HCl、KOH、Cl2 中有哪些键?
如何用电子云、原子轨道来进一步理解H2共价键的形成过程?
为什么没有H3、H2Cl、Cl3分子呢?
σ键:
x
你能用电子式表示H2、HCl、Cl2分子的形成过程吗?
H2、NaCl、HCl、KOH、Cl2 中有哪些键?
如何用电子云、原子轨道来进一步理解H2共价键的形成过程?
最大重叠原理
两个原子轨道重叠部分越大,两核间电子出现的概率越大,形成的共价键越牢固,分子越稳定。
为什么没有H3、H2Cl、Cl3分子呢?
HCl和Cl2中原子轨道分别是如何重叠的?是否也能形成σ键?
HCl和Cl2中原子轨道分别是如何重叠的?是否也能形成σ键?
x
x
X
s-s σ
X
X
s-p σ
p-p σ
“轴对称”
π键:
“镜面对称”
σ键 Π键
重叠方式
特点
成键轨道
键的强度
成键判断规律
“头碰头”
“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
s-s,s-p,p-p
p-p
共价单键是σ键,
共价双键中一个是σ键,另一个是π键,
共价叁键中一个是σ键,另两个为π键。
z
z
y
y
x
1、氮气分子中原子轨道重叠方式如何?
1、氮气分子中原子轨道重叠方式如何?
2.乙烷、乙烯和乙炔分子中的共价键分别有几个σ键和几个π键组成?
乙烷中: 个σ键
乙烯中: 个σ键 个π键
乙炔中: 个σ键 个π键
7
5
1
3
2
共价键的形成本质
成键原子相互接近时,原子轨道发生 ,自旋方向 的
电子形成 ,两原子核间的电子概率密度 ,体系的能量 。
重叠
相反
未成对
共用电子对
增 加
降低
1.原子间形成分子时,决定分子组成的是( ) A. 共价键的方向性
B. 共价键的饱和性
C. 形成共价键的原子的大小
D. 共价键的稳定性
B
2.在氯化氢分子中,形成共价键的原子轨道是( ) A. 氯原子的2p轨道和氢原子的1s轨道
B. 氯原子的2p轨道和氢原子的2p轨道
C. 氯原子的3p轨道和氢原子的1s轨道
D. 氯原子的3p轨道和氢原子的3p轨道
C
3.下列说法中正确的是( ) A. p轨道之间以“肩并肩”重叠可形成σ键
B. p轨道之间以“头碰头”重叠可形成π键
C. 共价键是两个原子轨道以“头碰头”重叠形成的
D. s和p轨道以“头碰头”重叠可形成σ键
D
4.下列有关σ键的说法错误的是 ( ) A.两个s-s轨道重叠形成的是σ键
B.s轨道和p轨道重叠形成的是σ键
C.p轨道和p轨道重叠不能σ键
D.HCl分子中含有一个s-pσ键
C
5. 有机物丙烯CH2=CH—CH3分子中有
个σ键, π键。
8
1
6. 乙烯分子中C-C之间有 个σ键,
个π键。乙烯易发生加成反应是
因为分子中C-C之间的一个 键易
断裂。
1
1
π
自制σ键、π键模型。
谢 谢!
