鲁科版必修1化学高一第3节 化学中常用的物理量―物质的量(38张PPT)
文档属性
| 名称 | 鲁科版必修1化学高一第3节 化学中常用的物理量―物质的量(38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1006.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-21 20:29:10 | ||
图片预览











文档简介
(共38张PPT)
第三节
化学中常用的
物理量----物质的量
2H2
+
O2
2H2O
点燃
质量比
4
32
36
微粒个数比
2
1
2
就宏观而言
就微观而言
4gH2中含有多少个H2分子?
4g氢气与32g氧气反应可以生成36g水;
2个氢气分子与1个氧气分子反应可以生成2个水分子
第三节
化学中常用的
物理量----物质的量
(第一课时)
[讨论1]
国际单位制(简称SI制)共有7个基本单位,每一个物理量对应着一个特定的基本单位。回忆学过的物理量及对应的单位。
[讨论2]
物质的量的单位是什么?
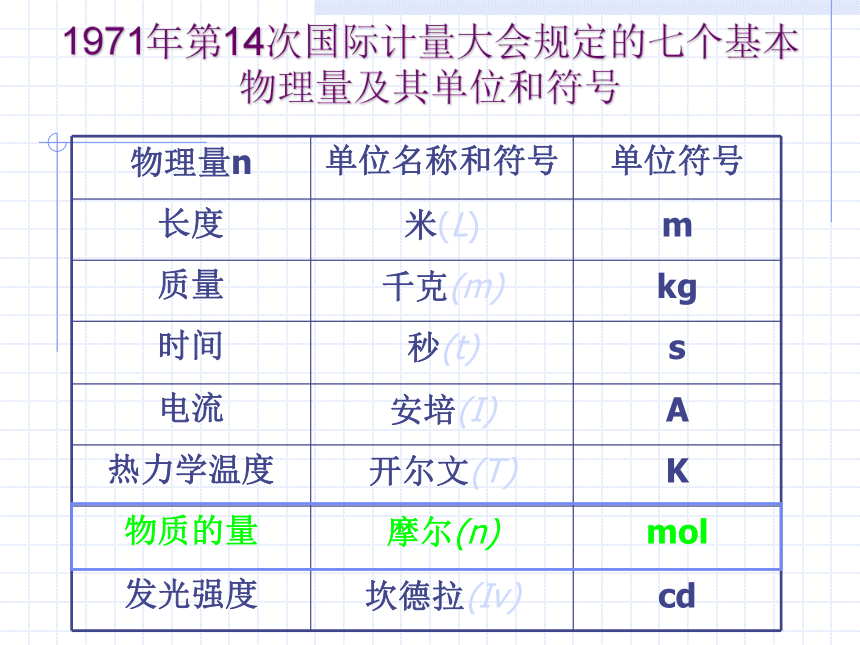
物理量n
单位名称和符号
单位符号
长度
米(L)
m
质量
千克(m)
kg
时间
秒(t)
s
电流
安培(I)
A
热力学温度
开尔文(T)
K
物质的量
摩尔(n)
mol
发光强度
坎德拉(Iv)
cd
1971年第14次国际计量大会规定的七个基本物理量及其单位和符号
注意
1、物质的量与长度、质量、时间等一样是一个基本物理量的名称。
2、摩尔如同米、千克、秒一样是物理量的单位。
3、物质的量四个字如同电流强度、发光强度、热力学温度等名称一样是一个固定的词组,由固定的字数组成,一个不能多一个不能少,否则就是错误的。
[讨论3]
在国际单位制中,为何要引入物质的量这个物理量,如何理解这个“专用”名词?
[讨论4]
摩尔这一单位的“基准”是怎样规定的?是多少?
[讨论5]
根据“物质的量”所表示的实际意义和“摩尔”的定义,回答物质的量和摩尔有何区别与联系?
物质的量与摩尔的区别和联系
物质的量
摩尔
区别
表示含有一定数目粒子的集体的物理量
是物质的量的单位
联系
摩尔是物质的量的单位
什么是摩尔?
摩尔:摩尔是物质的量的单位。每摩尔物质都含有阿伏加德罗常数个微粒。
注意:
(1)应用对象:微观粒子。
(2)应用时要指明具体的微粒。
理解:
(1)“摩尔”是单位,不是物理量。
(2)“摩尔”简称“摩”,符号mol。
(3)“每摩尔物质”:1mol含有任何微粒的物质
。
(4)“阿伏加德罗常数个”:1mol物质中的微粒个
数,
是一个常数。
(5)“微粒”:指原子、分子、原子团、电子、中
子、
质子等
微观粒子。
[讨论6]
什么是阿伏加德罗常数(NA)?物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)之间的关系如何?
已知一个12C原子的质量为1.993×10-26kg
,求
0.012kg
12C中含有的12C原子个数为多少?
解:
≈
6.02×1023(个)
0.012kg
1.993×10-26kg
0.012kg12C中的12C原子个数
=1mol12C中的12C原子个数
=阿伏加德罗常数个12C原子
≈
6.02×1023个12C原子
请算一算!
阿伏加德罗常数与6.02×1023
·mol—1的区别和联系
阿伏加德罗常数
6.02×1023
·mol—1
区别
精确值
近似值
联系
阿伏加德罗常数
6.02×1023
·mol—1
物质的量与阿伏加德罗常数的区别和联系
物质的量
阿伏加德罗常数
区别
表示物质所含粒子数目的集体的物理量,单位是摩尔
0.012kg
12C所含的原子数,单位是mol—1
联系
1mol任何粒子的粒子数叫做阿伏加德罗常数
1mol碳原子约含有
_________个碳原子
0.5mol氢分子约含有
_________个氢分子
2mol硫酸约含有
___________个硫酸分子
0.5molOH-约含有
_________个OH-
6.02×1023个H2分子是____molH2分子
3.01×1023个SO42-是____molSO42-
6.02×1023
3.01×1023
1.204×1024
3.01×1023
1
0.5
物质的量
微粒个数
×
(6.02×1023)
÷
(6.02×1023)
练习1:下列叙述中正确的是(
)
A.0.5molH
B.5mol氢
C.2mol氧元素
D.1mol麦子
A
练习2:假设10亿人都来数0.012kg12C中的12C原子数,
如果每个人以每秒钟1个原子的速度连续不断
的数,那么数清这些12C原子约需要———年
时间。
1900万年
6.02×1023
1×109
×3600
×24
×365
≈
总结:
本节课我们学习了物质的量、物质的量的
单位——摩尔、以及一个常数——阿伏加德
罗常数。同时推出了物质的量、微粒个数和
阿伏加德罗常数间的关系,即:
n=
课后请大家仔细阅读教材,记住各个概念和定义,尤其要理解摩尔的概念。
NA
N
二、摩尔质量和气体摩尔体积
1mol任何物质都约含有6.02×1023
·mol—1个粒子,
怎样求算1mol物质的质量?
粒子
符号
物质的
式量
每个粒子的
质量(g/个)
1摩尔物质含有的粒子数(个)
1摩尔物质质量(g)
C
12
1.993×10—23
Fe
56
9.320×10—23
H2SO4
98
1.628×10—22
H2O
18
2.990×10—23
Na
23
3.821×10—23
OH—
17
2.824×10—23
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
12
56
98
23
18
17
由以上计算结果可得出什么规律?
①
1mol
任何原子的质量在数值上等于这种
原子的相对原子质量。
②
1mol
任何分子的质量在数值上等于这种
原子的相对分子质量。
③
1mol
任何离子的质量在数值上等于这种
离子的式量。
1、摩尔质量
①
1mol物质质量
1mol
任何粒子质量是以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。
②摩尔质量
⑴定义:单位物质的量(n)的物质所具有的质
量(m)叫做摩尔质量,符号M。
⑵单位:g
?
mol-1或kg
?
mol-1
⑶数值:等于物质或粒子的式量
写出下列物质的摩尔质量
A.
Mg
B.
S
C.
CO2
D.
Fe2O3
E.
H3PO4
F.
KOH
G.
Na+
H.
SO42
-
物质的质量(m)、摩尔质量(M)、物质的量(n)的关系如何用式子表示?
①
②
摩尔质量(g·mol-1)
物质的质量(g)
物质的量(mol)=
符号表示:
n
=
m
/
M
物质的质量与摩尔质量的区别与联系
物质的质量
摩尔质量
区别
质量数值是任意的,单位通常是g或kg
摩尔质量的数值是该物质的相对分子质量,单位是
g
?
mol-1或kg
?
mol-1
联系
单位物质的量的物质所具有的质量叫做摩尔质量
摩尔质量与物质的相对分子质量
的区别与联系
摩尔质量
物质的相对分子质量
区别
摩尔质量是由物质质量除以物质的量得到的,单位是g
?
mol-1
或kg
?
mol-1
物质的相对分子质量是一种相对比值,它没有单位
联系
摩尔质量在数值上等于该物质的式量
物质的质量与物质的量的简单计算
1、0.5摩尔氧分子的质量是
,28克铁的物质的量
是
,一个铁原子的质量是
,一个二氧化碳
分子的质量是
。
2、11克二氧化碳的物质的量
,所含的分子数是
,所含的氧原子是
,所含的原子的物质的量
是
。
3、分子数为a的O3所具有的质量是
。
4、0.5摩尔铁与1摩尔的镁的质量比是
。
5、等质量的氧分子与臭氧的分子数之比
,原子数之
比
。
6、agFe与bgMg的物质的量之比为
,原子数之比为
.
小结
(1)物质的微粒数之比=微粒的物质的量之比
(2)质量比与物质的量之比的转换?
n(A):n(B)=(mA/MA):(mB/MB)
mA
:
mB
=[n(A)
MA]:[n(B)MB]
思考:在相同条件下,1摩尔物质的体积相同吗?
有的相同(气体物质),有的不同(固体、液体)
讨论:
压强增大对气体的体积有何影响?
压强增大。气体的体积变小,(与压强成反比)
讨论:
决定物质体积的因素有哪些?试举例说明。
⑴粒子数的多少。(粒子数多的体积大)
⑵微粒间的距离大小.(微粒间距离大的体积大)
⑶微粒的直径大小。(微粒直系大的体积大)
知识链接
实验证明:
⑴气体分子间的距离较大,一般是分子直径的10倍左右.
⑵在相同的条件下气体分子间的平均距离相等.
思考:
⑴分子间的距离增大10倍,其体积增大多少倍?
⑵在相同的温度和压强下,体积相同的气体含有的分子数有什么关系?在相同的温度和压强下,分子数相同的气体的体积有什么关系?
⑶在相同的温度和压强下,气体的体积之比与分子数之比有什么关系?
2、气体摩尔体积
①定义:单位物质的量的气体所占的体积叫做
气体摩尔体积。
符号:Vm
即
②单位:L
?
mol-1
或
L
/
mol
③标准状况下,气体摩尔体积约为22.4
L
?
mol--1,
Vm
=
22.4
L
?
mol-1。
④
V
Vm=
n
物质的量(mol)=
气体的体积
(L)
气体摩尔体积
(
L
?
mol-1)
3、阿伏加德罗定律
1、内容:在相同的温度和压强下,相同体
积的任何气体都含有相同数目的分子。
2、应用:
⑴
同温同压:
=
=
⑵同温同压:
=
V1
V2
N1
N2
n1
n2
?1
?2
M1
M2
小结:
怎样实现体积比与物质的量之比的转换?
怎样实现体积比与质量之比的转换?
三、气体摩尔体积的简单计算
1、a摩尔甲烷在标准状况下的体积是多少?质
量是多少?含原子总数是多少?
2、
24g甲烷在标准状况下的体积是多少?分子数是多少?含原子总数是多少?
3、等质量的氧分子与臭氧的体积比是
,
分子数之比
,原子数这比
。
4、标准状况下,2.2gA气体所占的体积为1.12L,
求A的相对分子质量?
5、在标准状况下,空气的密度为1.2945g.L-1,
则空气的平均相对分子质量是多少。
6、在标准状况下,体积比按1:4混合的氧气与
氮气22.4L,其质量是多少?
7、在标准状况下,10体积A2气体与10体积B2气
体化合生成20体积C气体,求C的分子式?
8、在1200C,1atm下,20mLA2气体与10mLB2
气体化合生成20mLC气体,求C的分子式?
第三节
化学中常用的
物理量----物质的量
2H2
+
O2
2H2O
点燃
质量比
4
32
36
微粒个数比
2
1
2
就宏观而言
就微观而言
4gH2中含有多少个H2分子?
4g氢气与32g氧气反应可以生成36g水;
2个氢气分子与1个氧气分子反应可以生成2个水分子
第三节
化学中常用的
物理量----物质的量
(第一课时)
[讨论1]
国际单位制(简称SI制)共有7个基本单位,每一个物理量对应着一个特定的基本单位。回忆学过的物理量及对应的单位。
[讨论2]
物质的量的单位是什么?
物理量n
单位名称和符号
单位符号
长度
米(L)
m
质量
千克(m)
kg
时间
秒(t)
s
电流
安培(I)
A
热力学温度
开尔文(T)
K
物质的量
摩尔(n)
mol
发光强度
坎德拉(Iv)
cd
1971年第14次国际计量大会规定的七个基本物理量及其单位和符号
注意
1、物质的量与长度、质量、时间等一样是一个基本物理量的名称。
2、摩尔如同米、千克、秒一样是物理量的单位。
3、物质的量四个字如同电流强度、发光强度、热力学温度等名称一样是一个固定的词组,由固定的字数组成,一个不能多一个不能少,否则就是错误的。
[讨论3]
在国际单位制中,为何要引入物质的量这个物理量,如何理解这个“专用”名词?
[讨论4]
摩尔这一单位的“基准”是怎样规定的?是多少?
[讨论5]
根据“物质的量”所表示的实际意义和“摩尔”的定义,回答物质的量和摩尔有何区别与联系?
物质的量与摩尔的区别和联系
物质的量
摩尔
区别
表示含有一定数目粒子的集体的物理量
是物质的量的单位
联系
摩尔是物质的量的单位
什么是摩尔?
摩尔:摩尔是物质的量的单位。每摩尔物质都含有阿伏加德罗常数个微粒。
注意:
(1)应用对象:微观粒子。
(2)应用时要指明具体的微粒。
理解:
(1)“摩尔”是单位,不是物理量。
(2)“摩尔”简称“摩”,符号mol。
(3)“每摩尔物质”:1mol含有任何微粒的物质
。
(4)“阿伏加德罗常数个”:1mol物质中的微粒个
数,
是一个常数。
(5)“微粒”:指原子、分子、原子团、电子、中
子、
质子等
微观粒子。
[讨论6]
什么是阿伏加德罗常数(NA)?物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)之间的关系如何?
已知一个12C原子的质量为1.993×10-26kg
,求
0.012kg
12C中含有的12C原子个数为多少?
解:
≈
6.02×1023(个)
0.012kg
1.993×10-26kg
0.012kg12C中的12C原子个数
=1mol12C中的12C原子个数
=阿伏加德罗常数个12C原子
≈
6.02×1023个12C原子
请算一算!
阿伏加德罗常数与6.02×1023
·mol—1的区别和联系
阿伏加德罗常数
6.02×1023
·mol—1
区别
精确值
近似值
联系
阿伏加德罗常数
6.02×1023
·mol—1
物质的量与阿伏加德罗常数的区别和联系
物质的量
阿伏加德罗常数
区别
表示物质所含粒子数目的集体的物理量,单位是摩尔
0.012kg
12C所含的原子数,单位是mol—1
联系
1mol任何粒子的粒子数叫做阿伏加德罗常数
1mol碳原子约含有
_________个碳原子
0.5mol氢分子约含有
_________个氢分子
2mol硫酸约含有
___________个硫酸分子
0.5molOH-约含有
_________个OH-
6.02×1023个H2分子是____molH2分子
3.01×1023个SO42-是____molSO42-
6.02×1023
3.01×1023
1.204×1024
3.01×1023
1
0.5
物质的量
微粒个数
×
(6.02×1023)
÷
(6.02×1023)
练习1:下列叙述中正确的是(
)
A.0.5molH
B.5mol氢
C.2mol氧元素
D.1mol麦子
A
练习2:假设10亿人都来数0.012kg12C中的12C原子数,
如果每个人以每秒钟1个原子的速度连续不断
的数,那么数清这些12C原子约需要———年
时间。
1900万年
6.02×1023
1×109
×3600
×24
×365
≈
总结:
本节课我们学习了物质的量、物质的量的
单位——摩尔、以及一个常数——阿伏加德
罗常数。同时推出了物质的量、微粒个数和
阿伏加德罗常数间的关系,即:
n=
课后请大家仔细阅读教材,记住各个概念和定义,尤其要理解摩尔的概念。
NA
N
二、摩尔质量和气体摩尔体积
1mol任何物质都约含有6.02×1023
·mol—1个粒子,
怎样求算1mol物质的质量?
粒子
符号
物质的
式量
每个粒子的
质量(g/个)
1摩尔物质含有的粒子数(个)
1摩尔物质质量(g)
C
12
1.993×10—23
Fe
56
9.320×10—23
H2SO4
98
1.628×10—22
H2O
18
2.990×10—23
Na
23
3.821×10—23
OH—
17
2.824×10—23
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
6.02
×1023
12
56
98
23
18
17
由以上计算结果可得出什么规律?
①
1mol
任何原子的质量在数值上等于这种
原子的相对原子质量。
②
1mol
任何分子的质量在数值上等于这种
原子的相对分子质量。
③
1mol
任何离子的质量在数值上等于这种
离子的式量。
1、摩尔质量
①
1mol物质质量
1mol
任何粒子质量是以克为单位时,在数值上都与该粒子的相对原子质量或相对分子质量相等。
②摩尔质量
⑴定义:单位物质的量(n)的物质所具有的质
量(m)叫做摩尔质量,符号M。
⑵单位:g
?
mol-1或kg
?
mol-1
⑶数值:等于物质或粒子的式量
写出下列物质的摩尔质量
A.
Mg
B.
S
C.
CO2
D.
Fe2O3
E.
H3PO4
F.
KOH
G.
Na+
H.
SO42
-
物质的质量(m)、摩尔质量(M)、物质的量(n)的关系如何用式子表示?
①
②
摩尔质量(g·mol-1)
物质的质量(g)
物质的量(mol)=
符号表示:
n
=
m
/
M
物质的质量与摩尔质量的区别与联系
物质的质量
摩尔质量
区别
质量数值是任意的,单位通常是g或kg
摩尔质量的数值是该物质的相对分子质量,单位是
g
?
mol-1或kg
?
mol-1
联系
单位物质的量的物质所具有的质量叫做摩尔质量
摩尔质量与物质的相对分子质量
的区别与联系
摩尔质量
物质的相对分子质量
区别
摩尔质量是由物质质量除以物质的量得到的,单位是g
?
mol-1
或kg
?
mol-1
物质的相对分子质量是一种相对比值,它没有单位
联系
摩尔质量在数值上等于该物质的式量
物质的质量与物质的量的简单计算
1、0.5摩尔氧分子的质量是
,28克铁的物质的量
是
,一个铁原子的质量是
,一个二氧化碳
分子的质量是
。
2、11克二氧化碳的物质的量
,所含的分子数是
,所含的氧原子是
,所含的原子的物质的量
是
。
3、分子数为a的O3所具有的质量是
。
4、0.5摩尔铁与1摩尔的镁的质量比是
。
5、等质量的氧分子与臭氧的分子数之比
,原子数之
比
。
6、agFe与bgMg的物质的量之比为
,原子数之比为
.
小结
(1)物质的微粒数之比=微粒的物质的量之比
(2)质量比与物质的量之比的转换?
n(A):n(B)=(mA/MA):(mB/MB)
mA
:
mB
=[n(A)
MA]:[n(B)MB]
思考:在相同条件下,1摩尔物质的体积相同吗?
有的相同(气体物质),有的不同(固体、液体)
讨论:
压强增大对气体的体积有何影响?
压强增大。气体的体积变小,(与压强成反比)
讨论:
决定物质体积的因素有哪些?试举例说明。
⑴粒子数的多少。(粒子数多的体积大)
⑵微粒间的距离大小.(微粒间距离大的体积大)
⑶微粒的直径大小。(微粒直系大的体积大)
知识链接
实验证明:
⑴气体分子间的距离较大,一般是分子直径的10倍左右.
⑵在相同的条件下气体分子间的平均距离相等.
思考:
⑴分子间的距离增大10倍,其体积增大多少倍?
⑵在相同的温度和压强下,体积相同的气体含有的分子数有什么关系?在相同的温度和压强下,分子数相同的气体的体积有什么关系?
⑶在相同的温度和压强下,气体的体积之比与分子数之比有什么关系?
2、气体摩尔体积
①定义:单位物质的量的气体所占的体积叫做
气体摩尔体积。
符号:Vm
即
②单位:L
?
mol-1
或
L
/
mol
③标准状况下,气体摩尔体积约为22.4
L
?
mol--1,
Vm
=
22.4
L
?
mol-1。
④
V
Vm=
n
物质的量(mol)=
气体的体积
(L)
气体摩尔体积
(
L
?
mol-1)
3、阿伏加德罗定律
1、内容:在相同的温度和压强下,相同体
积的任何气体都含有相同数目的分子。
2、应用:
⑴
同温同压:
=
=
⑵同温同压:
=
V1
V2
N1
N2
n1
n2
?1
?2
M1
M2
小结:
怎样实现体积比与物质的量之比的转换?
怎样实现体积比与质量之比的转换?
三、气体摩尔体积的简单计算
1、a摩尔甲烷在标准状况下的体积是多少?质
量是多少?含原子总数是多少?
2、
24g甲烷在标准状况下的体积是多少?分子数是多少?含原子总数是多少?
3、等质量的氧分子与臭氧的体积比是
,
分子数之比
,原子数这比
。
4、标准状况下,2.2gA气体所占的体积为1.12L,
求A的相对分子质量?
5、在标准状况下,空气的密度为1.2945g.L-1,
则空气的平均相对分子质量是多少。
6、在标准状况下,体积比按1:4混合的氧气与
氮气22.4L,其质量是多少?
7、在标准状况下,10体积A2气体与10体积B2气
体化合生成20体积C气体,求C的分子式?
8、在1200C,1atm下,20mLA2气体与10mLB2
气体化合生成20mLC气体,求C的分子式?
