第三节 原子的构成 原子中的电子课件(26张PPT)
文档属性
| 名称 | 第三节 原子的构成 原子中的电子课件(26张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-22 00:00:00 | ||
图片预览







文档简介
原子中的电子
实验:氯化钠的形成
钠 + 氯气 氯化钠
点燃
NaCl
Na
Cl2
微观上这个反应是怎样进行的?
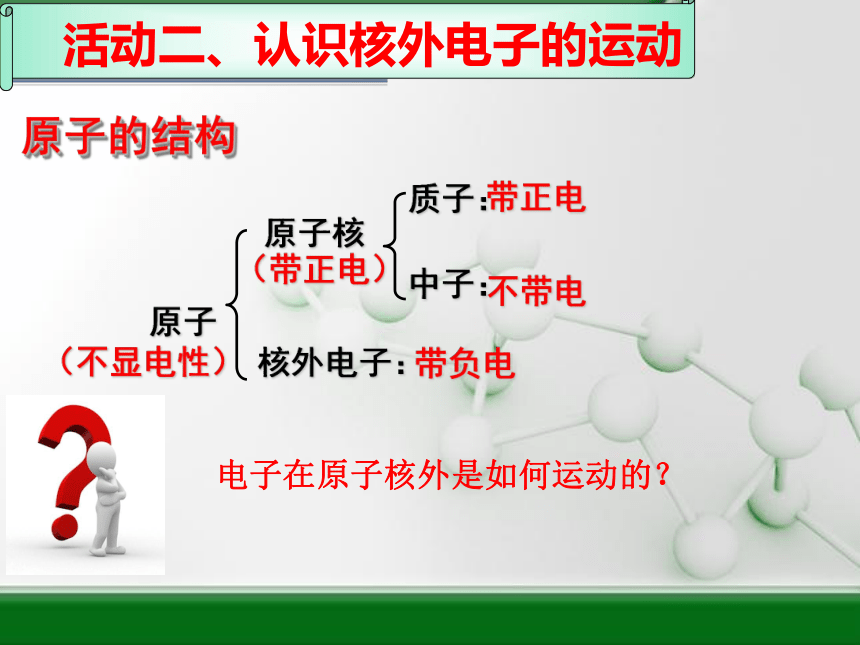
带正电
不带电
(带正电)
质子:
原子
中子:
核外电子:
原子核
(不显电性)
带负电
原子的结构
电子在原子核外是如何运动的?
活动二、认识核外电子的运动
活动二、认识核外电子的运动
电子在氢原子核外一定区域内做高速无规则运动
信息平台:
一个氧原子的原子核内有8个质子和8个中子,核外有8个电子。这些电子同时绕原子核高速运动,其中2个电子能量相近都较低,在离核较近的区域运动,另6个电子能量相近且稍高,在离核较远的区域运动。
问题一:在多电子原子中,电子是如何运动的?请以氧原子为例分析电子运动的特点。
一、认识核外电子的运动
活动二、认识核外电子的运动
电子分层排布 :电子在离核远近不同的区域运动。
能量高低 低 → 高
离核远近 近 → 远
电子层 第一层、第二层、第三层…第七层
一、认识核外电子的运动
活动二、认识核外电子的运动
如何简单的表示出电子的分层排布呢?
6
+8
2
原子核
质子数(核电荷数)
第二电子层(最外层)
第一电子层
该层电子数
一、认识核外电子的运动
活动二、认识核外电子的运动
氧原子结构示意图
试着说出原子结构示意图每一部分的含义。
顾图思义
原子核内有8个质子
第二电子层有6个电子
第一层有2个电子
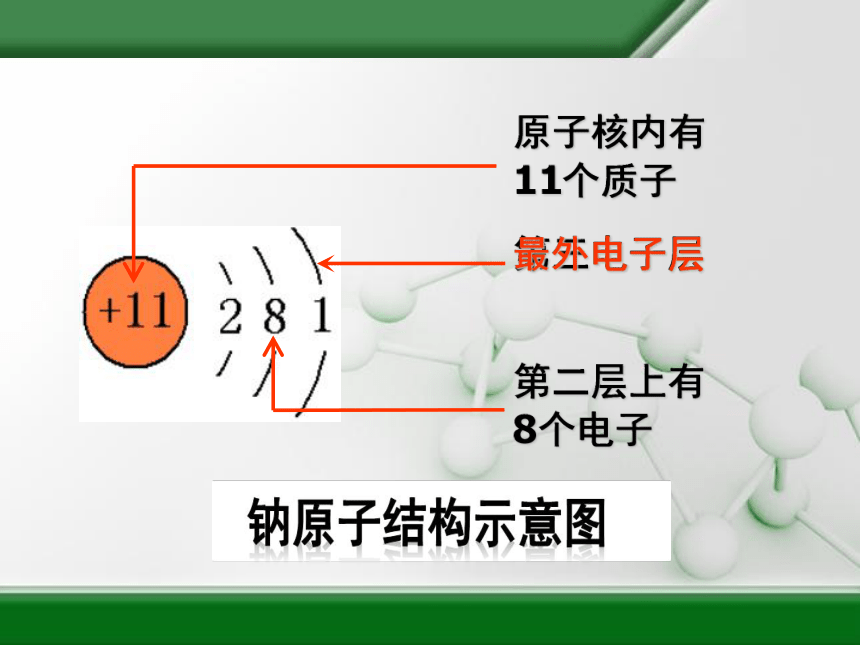
原子核内有11个质子
第三电子层
第二层上有8个电子
最外电子层
电子在原子核外的排布有什么规律呢?
观察上面原子结构示意图,你能发现每层电子排布有什么规律吗?
(1)第一层最多排2个电子,
(2)第二层最多排8个电子,
(3) 最外层不超过8个电子
找规律
(4) 先排满内层,
再排外层
核外电子排布规律
硅
Si
+14
2 9 3
3 2
硼
B
+5
1 7 8
+16
硫
S
找出原子结构示意图中的错误,并改正
2
+3
1
2
+4
2
锂(Li) 铍(Be)
+2
2
氦(He)
钠(Na) 镁(Mg) 铝(Al)
+1
1
氢(H)
8
+11
1
8
+12
2
8
+13
3
2
2
2
硼(B) 碳(C) 氮(N) 氧(O) 氟(F)
氖(Ne)
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
2
+10
8
8
+18
8
2
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅(Si) 磷(P) 硫(S) 氯(Cl)
氩(Ar)
稀有气体原子
金属原子
非金属原子
1、不同种类的原子最外层电子数有何特点?
2、在发生化学反应时最外层电子又将如何变化?
活动三、电子在化学反应中的得失
原子种类
最外层
电子数
易得(失)电子
化学性质
稀有气体原子
金属原子
非金属原子
提示:原子都有形成稳定结构的趋势
活动三、电子在化学反应中的得失
原子种类
最外层
电子数
易得(失)电子
化学性质
稀有气体原子
金属原子
非金属原子
一般少于4个
一般多于4个
易得到电子
易失去电子
既不易得电子也不易失电子
稳定
不稳定
不稳定
核外电子对原子在化学反应中的表现有很大影响
提示:原子都有形成稳定结构的趋势
一般等于8个
(氦为2个)
结构
决定
性质
钠 + 氯气 氯化钠
点燃
NaCl
Na
Cl2
问题四: 根据原子的结构分析,钠原子与氯原子是怎样生成新物质氯化钠的?
8
+11
1
2
8
+17
7
2
Cl(氯原子)
Na(钠原子)
活动四、离子的形成
8
+11
1
2
Na 钠原子
8
+11
2
Na+钠离子
8
+17
7
2
Cl氯原子
8
+17
8
2
Cl-氯离子
质子数﹥电子数
质子数﹤电子数
阳离子
阴离子
NaCl
氯化钠
氯化钠
离子也是构成物质的一种基本粒子
失去电子
得到电子
下列微粒是阳离子的有( );
是阴离子的有 ( )
是原子的有( );
为稳定结构的有( )
A
BCD
A
B
C
D
BC
D
分子
原子
离子
相同点
不同点
相互
关系
都是构成物质的基本粒子,都很小,
不停的运动,粒子间有间隔
在化学变化中分子种类改变
在化学变化中,原子种类不变
带电粒子
粒子
关系
原子
离子
物质
分子
失去电子
得到电子
构成
构成
构成
构成
原子
离子
物质
分子
构成
构成
构成
分子、原子和离子的比较
1.将①分子、②原子、③质子、④中子、⑤电子、
⑥离子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)决定原子化学性质的粒子是____________
(6)原子中数目一定相等的粒子是_______________
①②⑥
③④⑤
①②④
③
⑤
③⑤
2、某原子结构示意图如右,该原子的核电荷数为_____,核外有______个电子层,第二层上有______个电子,最外层上有______个电子。该原子在化学变化中容易______(“得到”或“失去”)电子。
16
3
8
6
8
+16
6
2
得到
3.右图是硫原子的原子结构示意图,下列对硫原子的叙述正确的是( )
A.硫原子第一电子层有6个电子
B.硫原子核内有16个质子
C.硫原子最外层电子的能量低于第二层电子的能量
D.硫原子在化学反应中容易失去电子
B
4.已知铝原子结构示意图 ,铝离子结构示意图正确的是( )
A. B. C.
B
B
5. 下列物质由离子直接构成的是( )
A.金刚石 B.氯化钠晶体 C.水 D.铜
电子在原子核外的高速运动
电子按能量不同分层排布
最外层电子数决定了原子在化学变化中的表现
电子的得失形成离子
离子构成宏观的物质
电子
小
结
认识事物的规律
这节课,我收获了
……
实验:氯化钠的形成
钠 + 氯气 氯化钠
点燃
NaCl
Na
Cl2
微观上这个反应是怎样进行的?
带正电
不带电
(带正电)
质子:
原子
中子:
核外电子:
原子核
(不显电性)
带负电
原子的结构
电子在原子核外是如何运动的?
活动二、认识核外电子的运动
活动二、认识核外电子的运动
电子在氢原子核外一定区域内做高速无规则运动
信息平台:
一个氧原子的原子核内有8个质子和8个中子,核外有8个电子。这些电子同时绕原子核高速运动,其中2个电子能量相近都较低,在离核较近的区域运动,另6个电子能量相近且稍高,在离核较远的区域运动。
问题一:在多电子原子中,电子是如何运动的?请以氧原子为例分析电子运动的特点。
一、认识核外电子的运动
活动二、认识核外电子的运动
电子分层排布 :电子在离核远近不同的区域运动。
能量高低 低 → 高
离核远近 近 → 远
电子层 第一层、第二层、第三层…第七层
一、认识核外电子的运动
活动二、认识核外电子的运动
如何简单的表示出电子的分层排布呢?
6
+8
2
原子核
质子数(核电荷数)
第二电子层(最外层)
第一电子层
该层电子数
一、认识核外电子的运动
活动二、认识核外电子的运动
氧原子结构示意图
试着说出原子结构示意图每一部分的含义。
顾图思义
原子核内有8个质子
第二电子层有6个电子
第一层有2个电子
原子核内有11个质子
第三电子层
第二层上有8个电子
最外电子层
电子在原子核外的排布有什么规律呢?
观察上面原子结构示意图,你能发现每层电子排布有什么规律吗?
(1)第一层最多排2个电子,
(2)第二层最多排8个电子,
(3) 最外层不超过8个电子
找规律
(4) 先排满内层,
再排外层
核外电子排布规律
硅
Si
+14
2 9 3
3 2
硼
B
+5
1 7 8
+16
硫
S
找出原子结构示意图中的错误,并改正
2
+3
1
2
+4
2
锂(Li) 铍(Be)
+2
2
氦(He)
钠(Na) 镁(Mg) 铝(Al)
+1
1
氢(H)
8
+11
1
8
+12
2
8
+13
3
2
2
2
硼(B) 碳(C) 氮(N) 氧(O) 氟(F)
氖(Ne)
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
2
+10
8
8
+18
8
2
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅(Si) 磷(P) 硫(S) 氯(Cl)
氩(Ar)
稀有气体原子
金属原子
非金属原子
1、不同种类的原子最外层电子数有何特点?
2、在发生化学反应时最外层电子又将如何变化?
活动三、电子在化学反应中的得失
原子种类
最外层
电子数
易得(失)电子
化学性质
稀有气体原子
金属原子
非金属原子
提示:原子都有形成稳定结构的趋势
活动三、电子在化学反应中的得失
原子种类
最外层
电子数
易得(失)电子
化学性质
稀有气体原子
金属原子
非金属原子
一般少于4个
一般多于4个
易得到电子
易失去电子
既不易得电子也不易失电子
稳定
不稳定
不稳定
核外电子对原子在化学反应中的表现有很大影响
提示:原子都有形成稳定结构的趋势
一般等于8个
(氦为2个)
结构
决定
性质
钠 + 氯气 氯化钠
点燃
NaCl
Na
Cl2
问题四: 根据原子的结构分析,钠原子与氯原子是怎样生成新物质氯化钠的?
8
+11
1
2
8
+17
7
2
Cl(氯原子)
Na(钠原子)
活动四、离子的形成
8
+11
1
2
Na 钠原子
8
+11
2
Na+钠离子
8
+17
7
2
Cl氯原子
8
+17
8
2
Cl-氯离子
质子数﹥电子数
质子数﹤电子数
阳离子
阴离子
NaCl
氯化钠
氯化钠
离子也是构成物质的一种基本粒子
失去电子
得到电子
下列微粒是阳离子的有( );
是阴离子的有 ( )
是原子的有( );
为稳定结构的有( )
A
BCD
A
B
C
D
BC
D
分子
原子
离子
相同点
不同点
相互
关系
都是构成物质的基本粒子,都很小,
不停的运动,粒子间有间隔
在化学变化中分子种类改变
在化学变化中,原子种类不变
带电粒子
粒子
关系
原子
离子
物质
分子
失去电子
得到电子
构成
构成
构成
构成
原子
离子
物质
分子
构成
构成
构成
分子、原子和离子的比较
1.将①分子、②原子、③质子、④中子、⑤电子、
⑥离子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)决定原子化学性质的粒子是____________
(6)原子中数目一定相等的粒子是_______________
①②⑥
③④⑤
①②④
③
⑤
③⑤
2、某原子结构示意图如右,该原子的核电荷数为_____,核外有______个电子层,第二层上有______个电子,最外层上有______个电子。该原子在化学变化中容易______(“得到”或“失去”)电子。
16
3
8
6
8
+16
6
2
得到
3.右图是硫原子的原子结构示意图,下列对硫原子的叙述正确的是( )
A.硫原子第一电子层有6个电子
B.硫原子核内有16个质子
C.硫原子最外层电子的能量低于第二层电子的能量
D.硫原子在化学反应中容易失去电子
B
4.已知铝原子结构示意图 ,铝离子结构示意图正确的是( )
A. B. C.
B
B
5. 下列物质由离子直接构成的是( )
A.金刚石 B.氯化钠晶体 C.水 D.铜
电子在原子核外的高速运动
电子按能量不同分层排布
最外层电子数决定了原子在化学变化中的表现
电子的得失形成离子
离子构成宏观的物质
电子
小
结
认识事物的规律
这节课,我收获了
……
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
