上海市实验学校2020-2021学年高二上学期等级考第一次测试化学试题
文档属性
| 名称 | 上海市实验学校2020-2021学年高二上学期等级考第一次测试化学试题 |  | |
| 格式 | doc | ||
| 文件大小 | 171.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-22 16:10:51 | ||
图片预览



文档简介
上海市实验学校高二化学等级考第一次测试
2020.9
(满分100分;考试时间50分钟)
班级____________学号__________姓名____________
相对原子质量:H-1 N-14 O-16 Fe-56 Cu-64 Zn-65 S-32
选择题(本题共40分,每小题2分,每题只有一个正确选项)
青铜是我国使用最早的合金。下列关于青铜性质的说法错误的是
A.硬度比纯铜小 B.能够导电 C.能够导热 D.熔点比纯铜低
钠钾合金作为金属有机中常用的干燥剂、除氧试剂、还原剂等在金属有机中有着很大的优势,用途很广。此合金属于
A.离子晶体? B.分子晶体? C.金属晶体? D.原子晶体
下列不能和铁发生反应的是
A.H+ B.OH- C. Fe3+ D.氯水
铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁与氢气 B.铁粉与硫粉加热反应生成硫化亚铁
C.铁丝在氧气中燃烧生成氧化铁 D.铁在冷的浓盐酸中会发生钝化
在常温下,下列物质中,能使铁溶解,又不能生成沉淀和气体的是
A.稀H2SO4 B.浓H2SO4 C.AgNO3溶液 D.Fe2(SO4)3
不能用单质直接化合得到的是
A.NaCl B.MgCl2 C.FeCl2 D.AlCl3
下列微粒中既有氧化性又有还原性的是
A.Fe B.Fe 2+ C.S2- D.H+
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是
A.只有④
B.只有③
C.③和④均错
D.全部错误
取2 mol/L的盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应结束后,所生成的气体体积比为2∶3,则往盐酸中加入铁粉的质量是
?? A.2.8 g????? B.5.6 g????? C.8.4 g?????? D.11.2 g
非整数比化合物Fe0.95O具有氯化钠晶体的结构,且n (Fe):n (O) < 1,在存在缺陷的该晶体中,Fe有Fe2+ 和Fe3+两种离子,则Fe3+占铁总量的
A.10% B.10.5% C.85% D.89.5%
在复杂体系中,确定化学反应先后顺序有利于解决问题。已知氧化性Fe3+>Cu2+>Fe2+。若在氯化铁溶液蚀刻铜印刷电路板后所得的溶液里加入过量锌片。下列说法正确的是
A.Fe3+首先反应,转化为Fe B.反应开始时c(Fe2+)增大,然后又减小
C. Fe2+首先反应,转化为Fe D.存在反应Fe + Cu2+Fe2+ + Cu
下列情况中固体质量会增加的是
A.Cu加入氯化铁溶液中 B. 高温下水蒸气通入Fe粉
C.氢气通入灼热氧化铜 D. Zn加入硫酸铜溶液
下列反应中调节反应物用量或浓度不会改变反应产物的是
A.铜粉加入硝酸中 B.硫化氢在氧气中燃烧
C.铁粉在氯气中燃烧 D.锌加入硫酸中
将氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.氯化铁 B.氢氧化铁 C.氧化亚铁 D.氧化铁
把铜粉、铁粉的混合物放入一定量的稀HNO3中并微热,反应完毕后发现铁粉有剩余。则溶液中含有的金属离子是
A.Cu2+ B.Fe2+ C.Cu2+和Fe2+ D.Cu2+和Fe3+
某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+的物质的量之比是
A.1∶1 B.2∶1 C.3∶2 D.4∶1
下列反应的离子方程式正确的是
A.实验室用大理石和稀盐酸制取二氧化碳:2H+ +CO32-CO2 ↑+H2O
B.铁片溶于稀硫酸中: 2Fe + 6H+ 2Fe3+ + 3H2↑
C.向FeCl3溶液中加入足量的氨水:Fe3++3OH-Fe(OH)3↓
D.氢氧化铜溶于稀盐酸中: Cu(OH)2+2H+ 2H2O +Cu2+
下列各组离子在溶液中不能同时大量存在的是
A. Ca2+ Fe2+ NO3- Cl- B. Fe3+ H+ NO3- Cl-
C. Na+ Fe3+ H+ Cl- D. S2- K+ Fe3+ SO42-
某溶液中可能含有H+、NH4+、Fe2+、SO42-、CO32-、Br-,且物质的量浓度相同;取样进行实验,结果是:①测得溶液pH=2;②加入氯水,溶液颜色变深。对原溶液描述错误的是
A.一定含有Br- B.一定含有Fe2+
C.可能同时含Fe2+、Br- D.一定不含NH4+
由5molFe2O3 、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A .4:3 B.2:3 C.3:1 D.2:l
综合分析题(60分)
(10分)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
____Fe2O3+____NH4Cl _____ Fe+ ____ FeCl3+ ____N2↑+ ______H2O
(1)配平上述反应:
__________________________________
(2)上述反应中_______元素被氧化,当生成3.36L氮气(标准状况)时,发生转移的电子数为_________个。
(3)有同学认为,该反应产物中不应该有Fe生成,其原因是(用化学方程式表示原因)____________________________________。
(4)产物之一氯化铁可做净水剂,结合离子方程式阐述其净水原理______________________________________________________________。
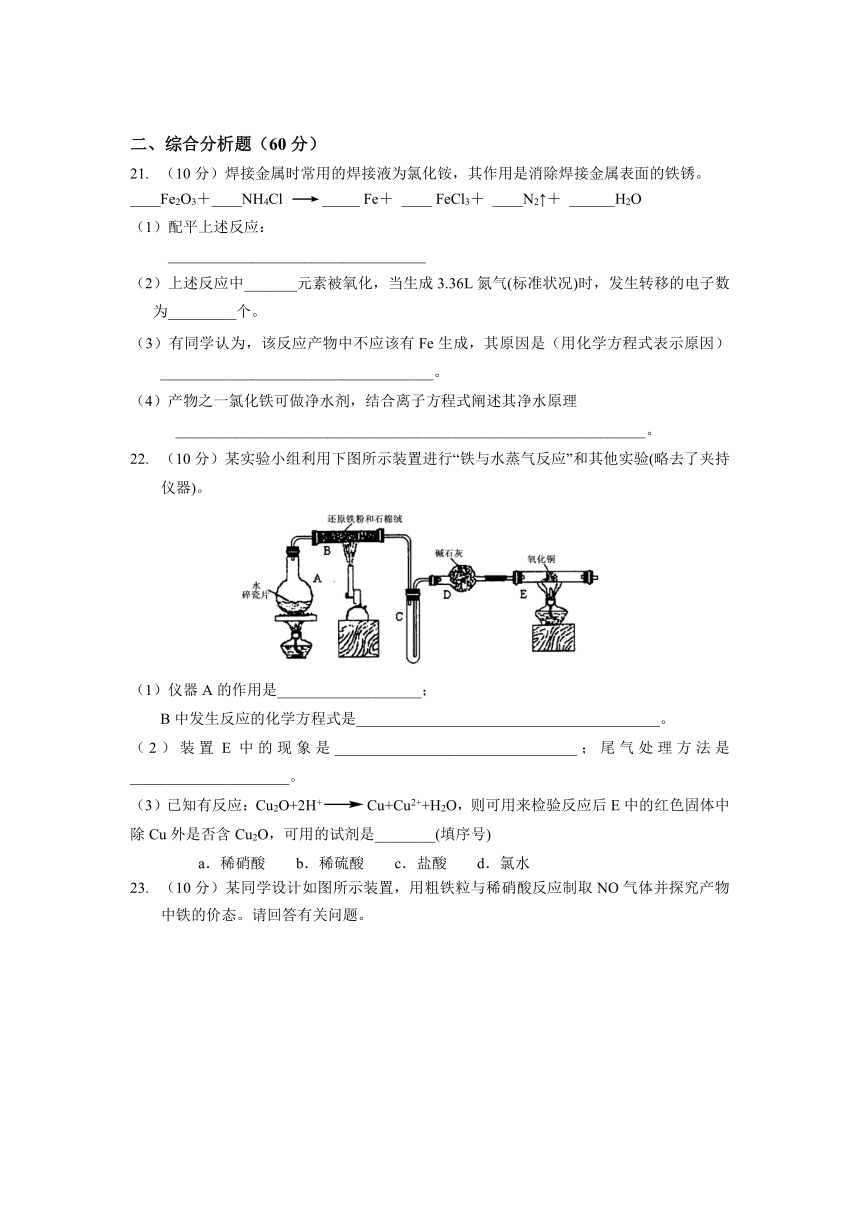
(10分)某实验小组利用下图所示装置进行“铁与水蒸气反应”和其他实验(略去了夹持仪器)。
(1)仪器A的作用是___________________;
B中发生反应的化学方程式是________________________________________。
(2)装置E中的现象是________________________________;尾气处理方法是_____________________。
(3)已知有反应:Cu2O+2H+Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.氯水
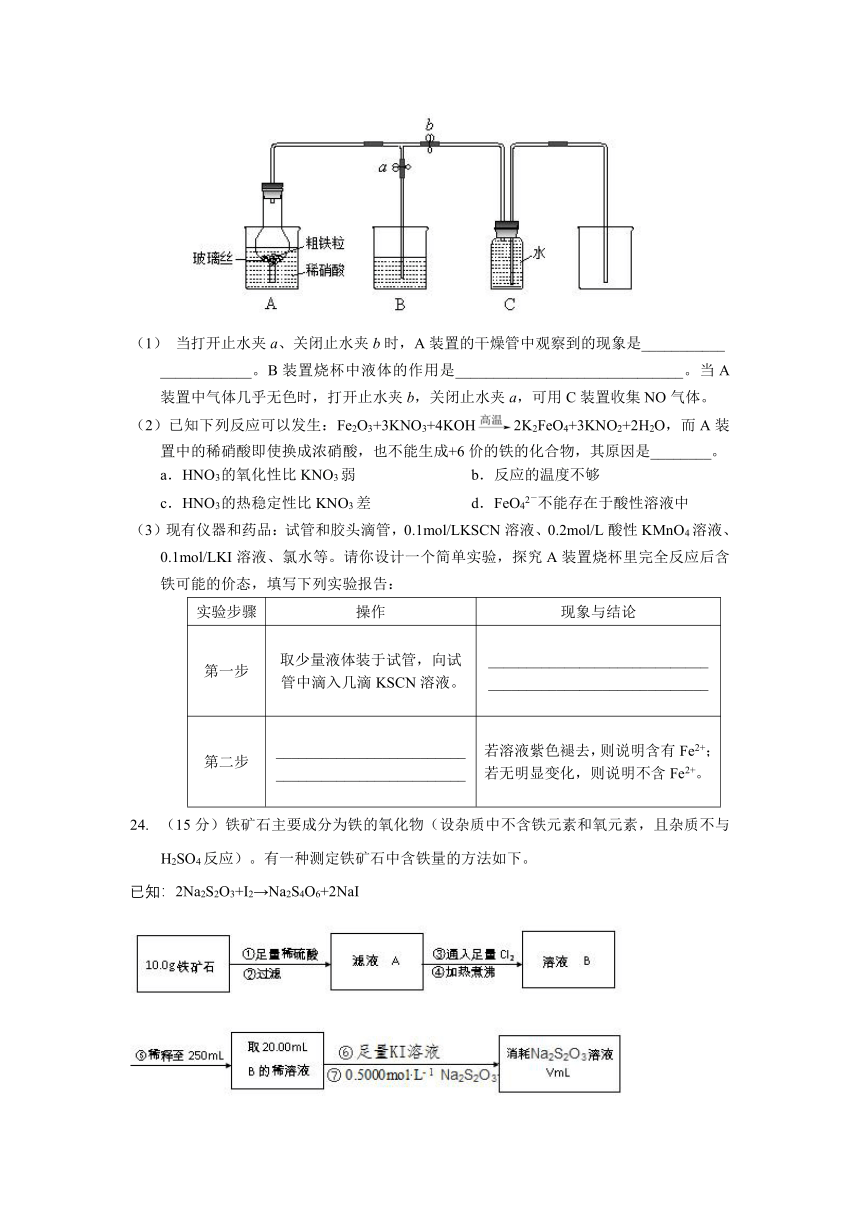
(10分)某同学设计如图所示装置,用粗铁粒与稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
(1) 当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是___________
____________。B装置烧杯中液体的作用是______________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(2)已知下列反应可以发生:Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
a.HNO3 的氧化性比KNO3弱 b.反应的温度不够
c.HNO3 的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(3)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试
管中滴入几滴KSCN溶液。
_____________________________
_____________________________
第二步
__________________________________________________
若溶液紫色褪去,则说明含有Fe2+;
若无明显变化,则说明不含Fe2+。
(15分)铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。
已知:2Na2S2O3+I2→Na2S4O6+2NaI
完成下列填空:
(1)步骤②用到的玻璃仪器除烧杯外,还有_________、_________,步骤⑤中必须用到的定量实验仪器是___________________。
(2)步骤③对应反应的离子方程式为________________________
(3)步骤④中煮沸的作用是___________________________________________________。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的颜色变化是_________________。若滴定过程中有空气进入,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
(5)若过程⑦中消耗0.5000mol·L?1 Na2S2O3溶液20.00mL,则铁矿石中铁的百分含量为 。
计算题(15分)
(10分)已知还原性Fe2+>Br-,向含有nmolFeBr2的溶液中通入Cl2,有xmolCl2发生反应。
(1)当x≤时,反应的离子方程式为________________________。
(2)当反应的离子方程式为2Fe2++4Br-+3Cl22Fe3++2Br2+6Cl-?时,x与n的大小关系为_________。
(3)当Fe2+和Br-同时被氧化时,x与n的大小关系为
________________。
(4)当x=n时,反应后氧化产物的物质的量为_______,反应的离子方程式为________________________。
已知硫铁矿(FeS2)在沸腾炉中煅烧(4FeS2 +11O22Fe2O3 +8SO2),通入沸腾炉的气体原料是空气。
(1)若其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是______________
A.0.13 B.0.15 C.0.22 D.0.30
(2)取某硫铁矿(主要杂质为SiO2)10g在足量的空气中煅烧,充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
上海市实验学校高二化学等级考第一次测试(答案版)
2020.9
(满分100分;考试时间50分钟)
班级____________学号__________姓名____________
相对原子质量:H-1 N-14 O-16 Fe-56 Cu-64 Zn-65 S-32
选择题(本题共40分,每小题2分,每题只有一个正确选项)
青铜是我国使用最早的合金。下列关于青铜性质的说法错误的是
A.硬度比纯铜小 B.能够导电 C.能够导热 D.熔点比纯铜低
钠钾合金作为金属有机中常用的干燥剂、除氧试剂、还原剂等在金属有机中有着很大的优势,用途很广。此合金属于
A.离子晶体? B.分子晶体? C.金属晶体? D.原子晶体
下列不能和铁发生反应的是
A.H+ B.OH- C. Fe3+ D.氯水
铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁与氢气 B.铁粉与硫粉加热反应生成硫化亚铁
C.铁丝在氧气中燃烧生成氧化铁 D.铁在冷的浓盐酸中会发生钝化
在常温下,下列物质中,能使铁溶解,又不能生成沉淀和气体的是
A.稀H2SO4 B.浓H2SO4 C.AgNO3溶液 D.Fe2(SO4)3
不能用单质直接化合得到的是
A.NaCl B.MgCl2 C.FeCl2 D.AlCl3
下列微粒中既有氧化性又有还原性的是
A.Fe B.Fe 2+ C.S2- D.H+
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是
A.只有④
B.只有③
C.③和④均错
D.全部错误
取2 mol/L的盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应结束后,所生成的气体体积比为2∶3,则往盐酸中加入铁粉的质量是
?? A.2.8 g????? B.5.6 g????? C.8.4 g?????? D.11.2 g
非整数比化合物Fe0.95O具有氯化钠晶体的结构,且n (Fe):n (O) < 1,在存在缺陷的该晶体中,Fe有Fe2+ 和Fe3+两种离子,则Fe3+占铁总量的
A.10% B.10.5% C.85% D.89.5%
在复杂体系中,确定化学反应先后顺序有利于解决问题。已知氧化性Fe3+>Cu2+>Fe2+。若在氯化铁溶液蚀刻铜印刷电路板后所得的溶液里加入过量锌片。下列说法正确的是
A.Fe3+首先反应,转化为Fe B.反应开始时c(Fe2+)增大,然后又减小
C. Fe2+首先反应,转化为Fe D.存在反应Fe + Cu2+Fe2+ + Cu
下列情况中固体质量会增加的是
A.Cu加入氯化铁溶液中 B. 高温下水蒸气通入Fe粉
C.氢气通入灼热氧化铜 D. Zn加入硫酸铜溶液
下列反应中调节反应物用量或浓度不会改变反应产物的是
A.铜粉加入硝酸中 B.硫化氢在氧气中燃烧
C.铁粉在氯气中燃烧 D.锌加入硫酸中
将氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.氯化铁 B.氢氧化铁 C.氧化亚铁 D.氧化铁
把铜粉、铁粉的混合物放入一定量的稀HNO3中并微热,反应完毕后发现铁粉有剩余。则溶液中含有的金属离子是
A.Cu2+ B.Fe2+ C.Cu2+和Fe2+ D.Cu2+和Fe3+
某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+的物质的量之比是
A.1∶1 B.2∶1 C.3∶2 D.4∶1
下列反应的离子方程式正确的是
A.实验室用大理石和稀盐酸制取二氧化碳:2H+ +CO32-CO2 ↑+H2O
B.铁片溶于稀硫酸中: 2Fe + 6H+ 2Fe3+ + 3H2↑
C.向FeCl3溶液中加入足量的氨水:Fe3++3OH-Fe(OH)3↓
D.氢氧化铜溶于稀盐酸中: Cu(OH)2+2H+ 2H2O +Cu2+
下列各组离子在溶液中不能同时大量存在的是
A. Ca2+ Fe2+ NO3- Cl- B. Fe3+ H+ NO3- Cl-
C. Na+ Fe3+ H+ Cl- D. S2- K+ Fe3+ SO42-
某溶液中可能含有H+、NH4+、Fe2+、SO42-、CO32-、Br-,且物质的量浓度相同;取样进行实验,结果是:①测得溶液pH=2;②加入氯水,溶液颜色变深。对原溶液描述错误的是
A.一定含有Br- B.一定含有Fe2+
C.可能同时含Fe2+、Br- D.一定不含NH4+
由5molFe2O3 、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A .4:3 B.2:3 C.3:1 D.2:l
综合分析题(60分)
(10分)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
____Fe2O3+____NH4Cl _____ Fe+ ____ FeCl3+ ____N2↑+ ______H2O
(1)配平上述反应:
__________________________________
(2)上述反应中_______元素被氧化,当生成3.36L氮气(标准状况)时,发生转移的电子数为_________个。
(3)有同学认为,该反应产物中不应该有Fe生成,其原因是(用化学方程式表示原因)____________________________________。
(4)产物之一氯化铁可做净水剂,结合离子方程式阐述其净水原理______________________________________________________________。
每空2分,共10分
(1)4Fe2O3+_6_NH4Cl __6_ Fe+ _2_ FeCl3+ _3_N2↑+ _12H2O
(2)负三价的氮,0.9NA
(3)Fe+2FeCl3→3FeCl2
(4)Fe3++3H2O Fe(OH)3+3H+
(10分)某实验小组利用下图所示装置进行“铁与水蒸气反应”和其他实验(略去了夹持仪器)。
(1)仪器A的作用是___________________;
B中发生反应的化学方程式是________________________________________。
(2)装置E中的现象是________________________________;尾气处理方法是_____________________。
(3)已知有反应:Cu2O+2H+Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.氯水
每空2分,共10分
(1)产生水蒸气 ;3Fe+4H2O(g)Fe3O4+4H2
(2)固体由黑变红,在右侧玻璃管中有小液滴出现。将尾气点燃。(3)bc
(10分)某同学设计如图所示装置,用粗铁粒与稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
(1) 当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是___________
____________。B装置烧杯中液体的作用是______________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(2)已知下列反应可以发生:Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
a.HNO3 的氧化性比KNO3弱 b.反应的温度不够
c.HNO3 的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(3)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试
管中滴入几滴KSCN溶液。
_____________________________
_____________________________
第二步
__________________________________________________
若溶液紫色褪去,则说明含有Fe2+;
若无明显变化,则说明不含Fe2+。
每空2分,共10分
铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体;吸收NO2;
d
若溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+;
取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液。
(15分)铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。
已知:2Na2S2O3+I2→Na2S4O6+2NaI
完成下列填空:
(1)步骤②用到的玻璃仪器除烧杯外,还有_________、_________,步骤⑤中必须用到的定量实验仪器是___________________。
(2)步骤③对应反应的离子方程式为________________________
(3)步骤④中煮沸的作用是___________________________________________________。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的颜色变化是_________________。若滴定过程中有空气进入,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
(5)若过程⑦中消耗0.5000mol·L?1 Na2S2O3溶液20.00mL,则铁矿石中铁的百分含量为 。
(1)漏斗 (1分) 玻璃棒 (1分) 250mL容量瓶 (2分)
(2)2Fe2++Cl2→2Fe3++2Cl-(2分)
(3)除去过量的氯气,避免影响后续滴定(2分)
(4)溶液由蓝色变为无色(2分) 偏高(2分)
(5)70% (3分)
计算题(15分)
(10分)已知还原性Fe2+>Br-,向含有nmolFeBr2的溶液中通入Cl2,有xmolCl2发生反应。
(1)当x≤时,反应的离子方程式为________________________。
(2)当反应的离子方程式为2Fe2++4Br-+3Cl22Fe3++2Br2+6Cl-?时,x与n的大小关系为_________。
(3)当Fe2+和Br-同时被氧化时,x与n的大小关系为
________________。
(4)当x=n时,反应后氧化产物的物质的量为_______,反应的离子方程式为________________________。
25.(1)2Fe2++Cl2→2Fe3++2Cl-?
(2)x≥
(3)x>
(4)mol或mol?? 2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
已知硫铁矿(FeS2)在沸腾炉中煅烧(4FeS2 +11O22Fe2O3 +8SO2),通入沸腾炉的气体原料是空气。
(1)若其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是______________
A.0.13 B.0.15 C.0.22 D.0.30
(2)取某硫铁矿(主要杂质为SiO2)10g在足量的空气中煅烧,充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
26.(1)AB 3分
(2)0.78或78% 2分
2020.9
(满分100分;考试时间50分钟)
班级____________学号__________姓名____________
相对原子质量:H-1 N-14 O-16 Fe-56 Cu-64 Zn-65 S-32
选择题(本题共40分,每小题2分,每题只有一个正确选项)
青铜是我国使用最早的合金。下列关于青铜性质的说法错误的是
A.硬度比纯铜小 B.能够导电 C.能够导热 D.熔点比纯铜低
钠钾合金作为金属有机中常用的干燥剂、除氧试剂、还原剂等在金属有机中有着很大的优势,用途很广。此合金属于
A.离子晶体? B.分子晶体? C.金属晶体? D.原子晶体
下列不能和铁发生反应的是
A.H+ B.OH- C. Fe3+ D.氯水
铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁与氢气 B.铁粉与硫粉加热反应生成硫化亚铁
C.铁丝在氧气中燃烧生成氧化铁 D.铁在冷的浓盐酸中会发生钝化
在常温下,下列物质中,能使铁溶解,又不能生成沉淀和气体的是
A.稀H2SO4 B.浓H2SO4 C.AgNO3溶液 D.Fe2(SO4)3
不能用单质直接化合得到的是
A.NaCl B.MgCl2 C.FeCl2 D.AlCl3
下列微粒中既有氧化性又有还原性的是
A.Fe B.Fe 2+ C.S2- D.H+
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是
A.只有④
B.只有③
C.③和④均错
D.全部错误
取2 mol/L的盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应结束后,所生成的气体体积比为2∶3,则往盐酸中加入铁粉的质量是
?? A.2.8 g????? B.5.6 g????? C.8.4 g?????? D.11.2 g
非整数比化合物Fe0.95O具有氯化钠晶体的结构,且n (Fe):n (O) < 1,在存在缺陷的该晶体中,Fe有Fe2+ 和Fe3+两种离子,则Fe3+占铁总量的
A.10% B.10.5% C.85% D.89.5%
在复杂体系中,确定化学反应先后顺序有利于解决问题。已知氧化性Fe3+>Cu2+>Fe2+。若在氯化铁溶液蚀刻铜印刷电路板后所得的溶液里加入过量锌片。下列说法正确的是
A.Fe3+首先反应,转化为Fe B.反应开始时c(Fe2+)增大,然后又减小
C. Fe2+首先反应,转化为Fe D.存在反应Fe + Cu2+Fe2+ + Cu
下列情况中固体质量会增加的是
A.Cu加入氯化铁溶液中 B. 高温下水蒸气通入Fe粉
C.氢气通入灼热氧化铜 D. Zn加入硫酸铜溶液
下列反应中调节反应物用量或浓度不会改变反应产物的是
A.铜粉加入硝酸中 B.硫化氢在氧气中燃烧
C.铁粉在氯气中燃烧 D.锌加入硫酸中
将氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.氯化铁 B.氢氧化铁 C.氧化亚铁 D.氧化铁
把铜粉、铁粉的混合物放入一定量的稀HNO3中并微热,反应完毕后发现铁粉有剩余。则溶液中含有的金属离子是
A.Cu2+ B.Fe2+ C.Cu2+和Fe2+ D.Cu2+和Fe3+
某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+的物质的量之比是
A.1∶1 B.2∶1 C.3∶2 D.4∶1
下列反应的离子方程式正确的是
A.实验室用大理石和稀盐酸制取二氧化碳:2H+ +CO32-CO2 ↑+H2O
B.铁片溶于稀硫酸中: 2Fe + 6H+ 2Fe3+ + 3H2↑
C.向FeCl3溶液中加入足量的氨水:Fe3++3OH-Fe(OH)3↓
D.氢氧化铜溶于稀盐酸中: Cu(OH)2+2H+ 2H2O +Cu2+
下列各组离子在溶液中不能同时大量存在的是
A. Ca2+ Fe2+ NO3- Cl- B. Fe3+ H+ NO3- Cl-
C. Na+ Fe3+ H+ Cl- D. S2- K+ Fe3+ SO42-
某溶液中可能含有H+、NH4+、Fe2+、SO42-、CO32-、Br-,且物质的量浓度相同;取样进行实验,结果是:①测得溶液pH=2;②加入氯水,溶液颜色变深。对原溶液描述错误的是
A.一定含有Br- B.一定含有Fe2+
C.可能同时含Fe2+、Br- D.一定不含NH4+
由5molFe2O3 、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A .4:3 B.2:3 C.3:1 D.2:l
综合分析题(60分)
(10分)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
____Fe2O3+____NH4Cl _____ Fe+ ____ FeCl3+ ____N2↑+ ______H2O
(1)配平上述反应:
__________________________________
(2)上述反应中_______元素被氧化,当生成3.36L氮气(标准状况)时,发生转移的电子数为_________个。
(3)有同学认为,该反应产物中不应该有Fe生成,其原因是(用化学方程式表示原因)____________________________________。
(4)产物之一氯化铁可做净水剂,结合离子方程式阐述其净水原理______________________________________________________________。
(10分)某实验小组利用下图所示装置进行“铁与水蒸气反应”和其他实验(略去了夹持仪器)。
(1)仪器A的作用是___________________;
B中发生反应的化学方程式是________________________________________。
(2)装置E中的现象是________________________________;尾气处理方法是_____________________。
(3)已知有反应:Cu2O+2H+Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.氯水
(10分)某同学设计如图所示装置,用粗铁粒与稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
(1) 当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是___________
____________。B装置烧杯中液体的作用是______________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(2)已知下列反应可以发生:Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
a.HNO3 的氧化性比KNO3弱 b.反应的温度不够
c.HNO3 的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(3)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试
管中滴入几滴KSCN溶液。
_____________________________
_____________________________
第二步
__________________________________________________
若溶液紫色褪去,则说明含有Fe2+;
若无明显变化,则说明不含Fe2+。
(15分)铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。
已知:2Na2S2O3+I2→Na2S4O6+2NaI
完成下列填空:
(1)步骤②用到的玻璃仪器除烧杯外,还有_________、_________,步骤⑤中必须用到的定量实验仪器是___________________。
(2)步骤③对应反应的离子方程式为________________________
(3)步骤④中煮沸的作用是___________________________________________________。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的颜色变化是_________________。若滴定过程中有空气进入,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
(5)若过程⑦中消耗0.5000mol·L?1 Na2S2O3溶液20.00mL,则铁矿石中铁的百分含量为 。
计算题(15分)
(10分)已知还原性Fe2+>Br-,向含有nmolFeBr2的溶液中通入Cl2,有xmolCl2发生反应。
(1)当x≤时,反应的离子方程式为________________________。
(2)当反应的离子方程式为2Fe2++4Br-+3Cl22Fe3++2Br2+6Cl-?时,x与n的大小关系为_________。
(3)当Fe2+和Br-同时被氧化时,x与n的大小关系为
________________。
(4)当x=n时,反应后氧化产物的物质的量为_______,反应的离子方程式为________________________。
已知硫铁矿(FeS2)在沸腾炉中煅烧(4FeS2 +11O22Fe2O3 +8SO2),通入沸腾炉的气体原料是空气。
(1)若其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是______________
A.0.13 B.0.15 C.0.22 D.0.30
(2)取某硫铁矿(主要杂质为SiO2)10g在足量的空气中煅烧,充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
上海市实验学校高二化学等级考第一次测试(答案版)
2020.9
(满分100分;考试时间50分钟)
班级____________学号__________姓名____________
相对原子质量:H-1 N-14 O-16 Fe-56 Cu-64 Zn-65 S-32
选择题(本题共40分,每小题2分,每题只有一个正确选项)
青铜是我国使用最早的合金。下列关于青铜性质的说法错误的是
A.硬度比纯铜小 B.能够导电 C.能够导热 D.熔点比纯铜低
钠钾合金作为金属有机中常用的干燥剂、除氧试剂、还原剂等在金属有机中有着很大的优势,用途很广。此合金属于
A.离子晶体? B.分子晶体? C.金属晶体? D.原子晶体
下列不能和铁发生反应的是
A.H+ B.OH- C. Fe3+ D.氯水
铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁与氢气 B.铁粉与硫粉加热反应生成硫化亚铁
C.铁丝在氧气中燃烧生成氧化铁 D.铁在冷的浓盐酸中会发生钝化
在常温下,下列物质中,能使铁溶解,又不能生成沉淀和气体的是
A.稀H2SO4 B.浓H2SO4 C.AgNO3溶液 D.Fe2(SO4)3
不能用单质直接化合得到的是
A.NaCl B.MgCl2 C.FeCl2 D.AlCl3
下列微粒中既有氧化性又有还原性的是
A.Fe B.Fe 2+ C.S2- D.H+
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是
A.只有④
B.只有③
C.③和④均错
D.全部错误
取2 mol/L的盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应结束后,所生成的气体体积比为2∶3,则往盐酸中加入铁粉的质量是
?? A.2.8 g????? B.5.6 g????? C.8.4 g?????? D.11.2 g
非整数比化合物Fe0.95O具有氯化钠晶体的结构,且n (Fe):n (O) < 1,在存在缺陷的该晶体中,Fe有Fe2+ 和Fe3+两种离子,则Fe3+占铁总量的
A.10% B.10.5% C.85% D.89.5%
在复杂体系中,确定化学反应先后顺序有利于解决问题。已知氧化性Fe3+>Cu2+>Fe2+。若在氯化铁溶液蚀刻铜印刷电路板后所得的溶液里加入过量锌片。下列说法正确的是
A.Fe3+首先反应,转化为Fe B.反应开始时c(Fe2+)增大,然后又减小
C. Fe2+首先反应,转化为Fe D.存在反应Fe + Cu2+Fe2+ + Cu
下列情况中固体质量会增加的是
A.Cu加入氯化铁溶液中 B. 高温下水蒸气通入Fe粉
C.氢气通入灼热氧化铜 D. Zn加入硫酸铜溶液
下列反应中调节反应物用量或浓度不会改变反应产物的是
A.铜粉加入硝酸中 B.硫化氢在氧气中燃烧
C.铁粉在氯气中燃烧 D.锌加入硫酸中
将氯化铁溶液蒸干灼烧,最后得到的固体产物是
A.氯化铁 B.氢氧化铁 C.氧化亚铁 D.氧化铁
把铜粉、铁粉的混合物放入一定量的稀HNO3中并微热,反应完毕后发现铁粉有剩余。则溶液中含有的金属离子是
A.Cu2+ B.Fe2+ C.Cu2+和Fe2+ D.Cu2+和Fe3+
某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+的物质的量之比是
A.1∶1 B.2∶1 C.3∶2 D.4∶1
下列反应的离子方程式正确的是
A.实验室用大理石和稀盐酸制取二氧化碳:2H+ +CO32-CO2 ↑+H2O
B.铁片溶于稀硫酸中: 2Fe + 6H+ 2Fe3+ + 3H2↑
C.向FeCl3溶液中加入足量的氨水:Fe3++3OH-Fe(OH)3↓
D.氢氧化铜溶于稀盐酸中: Cu(OH)2+2H+ 2H2O +Cu2+
下列各组离子在溶液中不能同时大量存在的是
A. Ca2+ Fe2+ NO3- Cl- B. Fe3+ H+ NO3- Cl-
C. Na+ Fe3+ H+ Cl- D. S2- K+ Fe3+ SO42-
某溶液中可能含有H+、NH4+、Fe2+、SO42-、CO32-、Br-,且物质的量浓度相同;取样进行实验,结果是:①测得溶液pH=2;②加入氯水,溶液颜色变深。对原溶液描述错误的是
A.一定含有Br- B.一定含有Fe2+
C.可能同时含Fe2+、Br- D.一定不含NH4+
由5molFe2O3 、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A .4:3 B.2:3 C.3:1 D.2:l
综合分析题(60分)
(10分)焊接金属时常用的焊接液为氯化铵,其作用是消除焊接金属表面的铁锈。
____Fe2O3+____NH4Cl _____ Fe+ ____ FeCl3+ ____N2↑+ ______H2O
(1)配平上述反应:
__________________________________
(2)上述反应中_______元素被氧化,当生成3.36L氮气(标准状况)时,发生转移的电子数为_________个。
(3)有同学认为,该反应产物中不应该有Fe生成,其原因是(用化学方程式表示原因)____________________________________。
(4)产物之一氯化铁可做净水剂,结合离子方程式阐述其净水原理______________________________________________________________。
每空2分,共10分
(1)4Fe2O3+_6_NH4Cl __6_ Fe+ _2_ FeCl3+ _3_N2↑+ _12H2O
(2)负三价的氮,0.9NA
(3)Fe+2FeCl3→3FeCl2
(4)Fe3++3H2O Fe(OH)3+3H+
(10分)某实验小组利用下图所示装置进行“铁与水蒸气反应”和其他实验(略去了夹持仪器)。
(1)仪器A的作用是___________________;
B中发生反应的化学方程式是________________________________________。
(2)装置E中的现象是________________________________;尾气处理方法是_____________________。
(3)已知有反应:Cu2O+2H+Cu+Cu2++H2O,则可用来检验反应后E中的红色固体中除Cu外是否含Cu2O,可用的试剂是________(填序号)
a.稀硝酸 b.稀硫酸 c.盐酸 d.氯水
每空2分,共10分
(1)产生水蒸气 ;3Fe+4H2O(g)Fe3O4+4H2
(2)固体由黑变红,在右侧玻璃管中有小液滴出现。将尾气点燃。(3)bc
(10分)某同学设计如图所示装置,用粗铁粒与稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
(1) 当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是___________
____________。B装置烧杯中液体的作用是______________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(2)已知下列反应可以发生:Fe2O3+3KNO3+4KOH2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是________。
a.HNO3 的氧化性比KNO3弱 b.反应的温度不够
c.HNO3 的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(3)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤 操作 现象与结论
第一步 取少量液体装于试管,向试
管中滴入几滴KSCN溶液。
_____________________________
_____________________________
第二步
__________________________________________________
若溶液紫色褪去,则说明含有Fe2+;
若无明显变化,则说明不含Fe2+。
每空2分,共10分
铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体;吸收NO2;
d
若溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+;
取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液。
(15分)铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。
已知:2Na2S2O3+I2→Na2S4O6+2NaI
完成下列填空:
(1)步骤②用到的玻璃仪器除烧杯外,还有_________、_________,步骤⑤中必须用到的定量实验仪器是___________________。
(2)步骤③对应反应的离子方程式为________________________
(3)步骤④中煮沸的作用是___________________________________________________。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的颜色变化是_________________。若滴定过程中有空气进入,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
(5)若过程⑦中消耗0.5000mol·L?1 Na2S2O3溶液20.00mL,则铁矿石中铁的百分含量为 。
(1)漏斗 (1分) 玻璃棒 (1分) 250mL容量瓶 (2分)
(2)2Fe2++Cl2→2Fe3++2Cl-(2分)
(3)除去过量的氯气,避免影响后续滴定(2分)
(4)溶液由蓝色变为无色(2分) 偏高(2分)
(5)70% (3分)
计算题(15分)
(10分)已知还原性Fe2+>Br-,向含有nmolFeBr2的溶液中通入Cl2,有xmolCl2发生反应。
(1)当x≤时,反应的离子方程式为________________________。
(2)当反应的离子方程式为2Fe2++4Br-+3Cl22Fe3++2Br2+6Cl-?时,x与n的大小关系为_________。
(3)当Fe2+和Br-同时被氧化时,x与n的大小关系为
________________。
(4)当x=n时,反应后氧化产物的物质的量为_______,反应的离子方程式为________________________。
25.(1)2Fe2++Cl2→2Fe3++2Cl-?
(2)x≥
(3)x>
(4)mol或mol?? 2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
已知硫铁矿(FeS2)在沸腾炉中煅烧(4FeS2 +11O22Fe2O3 +8SO2),通入沸腾炉的气体原料是空气。
(1)若其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是______________
A.0.13 B.0.15 C.0.22 D.0.30
(2)取某硫铁矿(主要杂质为SiO2)10g在足量的空气中煅烧,充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
26.(1)AB 3分
(2)0.78或78% 2分
同课章节目录
