第三节 氧气 氧气的实验室制法课件(26张PPT)
文档属性
| 名称 | 第三节 氧气 氧气的实验室制法课件(26张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 9.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-22 20:18:34 | ||
图片预览







文档简介
第三节 氧气
氧气的实验室制法
学习目标
1.理解实验室用过氧化氢制氧气的原理
2.初步学会制取氧气实验装置选择、氧气的收集方法及氧气的检验(重、难点)
3.认识催化剂及其作用
已经学过的制备氧气的方法有哪些?
分离液态空气法
光合作用
电解水
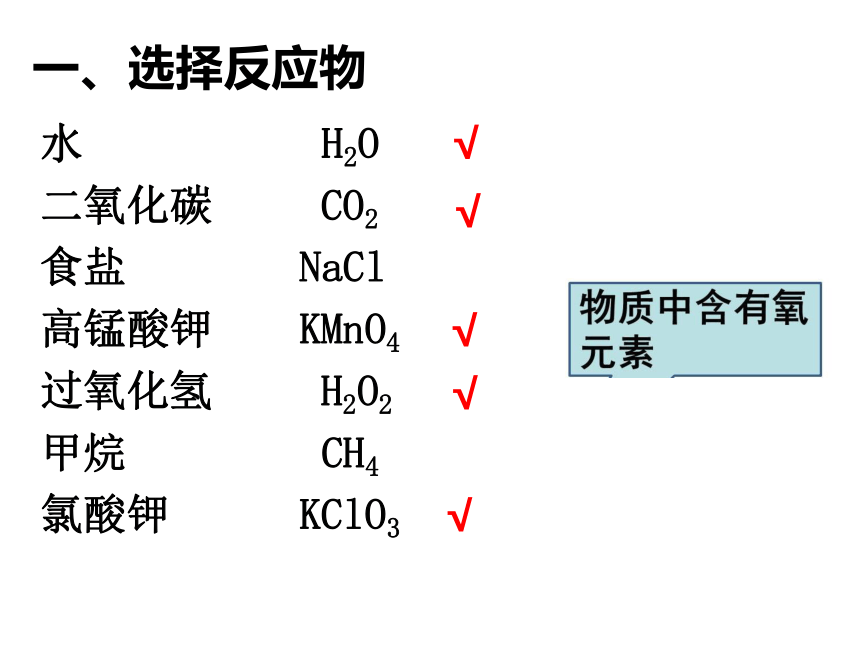
水 H2O
二氧化碳 CO2
食盐 NaCl
高锰酸钾 KMnO4
过氧化氢 H2O2
甲烷 CH4
氯酸钾 KClO3
√
√
√
√
√
一、选择反应物
(1)KMnO4高锰酸钾是一种紫黑色的固体,在加热时能产生氧气,还会产生锰酸钾能助燃且有毒。
(2)KClO3氯酸钾是一种白色固体,加热时能产生氧气,如果混有可燃性杂质可能会发生爆炸。
(3)H2O2过氧化氢溶液又称双氧水,是一种无色的液体,常温下就可生成氧气和水,反应速度适中,价格低廉。
资料介绍
加热
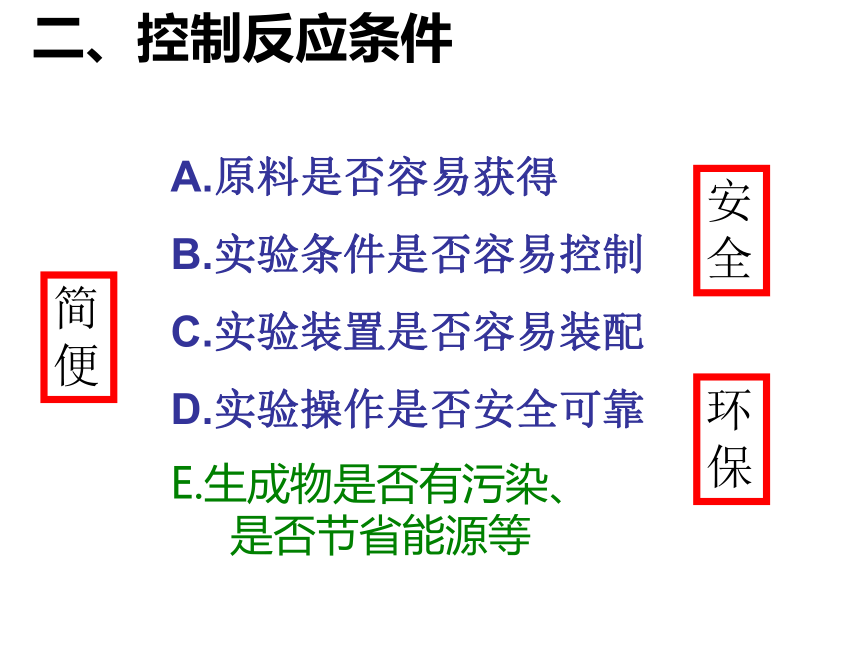
A.原料是否容易获得
B.实验条件是否容易控制
C.实验装置是否容易装配
D.实验操作是否安全可靠
二、控制反应条件
E.生成物是否有污染、 是否节省能源等
安全
环保
简便
集思广益
有什么办法可以让过氧化氢反应的速率加快?
1.提高过氧化氢的浓度
2.提高温度
3.向过氧化氢溶液中加入某物质
反应速率慢
选用药品
产生气体
速率
能否使带火星的木条复燃
A
过氧化氢
B
过氧化氢
和二氧化锰
实验现象
慢
快
否
能
实验室制取氧气的方法是:
在过氧化氢溶液中加入二氧化锰
①试管 ②烧杯 ③锥形瓶 ④ 酒精灯 ⑤铁架台
⑦分液漏斗
⑨单孔
橡皮塞和导管
⑧双孔
橡皮塞和导管
三、选择发生装置
⑥长颈漏斗
实验室制取氧气的发生装置
固体加热
固液常温
√
可控制反应速率
简易,操作简单
气体
空气
向上排空气法
空气
气体
向下排空气法
排水法
密度比空气大
密度比空气小
不溶于水,不与水反应
四、选择收集装置
小资料:通常状况下,氧气不易溶于水,且不与水反应;在 0℃,1个标准大气压下,其密度为1.429g/L,空气的密度为1.293g/L。
√
√
气体不与空气中的物质反应
收集到的气体干燥但不太纯
收集到的气体潮湿但纯净
或
实验室制取氧气的装置
制取一瓶氧气,你认为正确的操作顺序是:___________.
①连接并检查装置的气密性.
②向分液漏斗中倒入过氧化氢溶液.
③向锥形瓶中加入二氧化锰,并塞紧瓶塞.
④打开止水夹打开分液漏斗的活塞,待导管口出现均匀气泡,把导管伸入集气瓶中。
⑤将集气瓶装满水,从侧面轻推盖上毛玻璃片,翻转后,扣在水槽中.
⑥待水排净后,在水底将毛玻璃片盖紧,取出,正放。
如何检查?
①③②⑤④⑥
五、实验步骤
1.如何检查装置气密性
2.为什么要出现均匀气泡才开始收集
3.怎样判断氧气已经收集满了?
小组交流讨论
1、将反应后的二氧化锰过滤、干燥、称量,发现二氧化锰的质量不发生改变。
2、将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。
【思考】
二氧化锰在这个反应中起到了什么作用?
小资料
在化学反应中,能改变其他物质的化学反应的速率,而本身的质量和化学性质, 在反应前后都没有变化的物质。
催化剂
注:①针对特定反应而言是催化剂
③催化剂反应前后化学性质不变,但物理性质可能改变
④对于同一个反应而言,可以有多种催化剂
②正催化剂:加快反应速率;负催化剂:减慢反应速率
【说明】此反应中,二氧化锰既不是反应物也不是生成物,是催化剂,是反应条件,所以写在箭头的上方。
催化作用
催化剂在化学反应中所起的作用叫催化作用。
过氧化氢 水+氧气
二氧化锰
(文字表达式)
汽车尾气
催化剂的应用
护肤品
工业
实验室制氧气的一般环节:
一、药品:过氧化氢溶液(俗称双氧水)
氯酸钾 (用二氧化锰做催化剂)
高锰酸钾
(无色液体)
(白色固体)
(黑色粉末固体)
(暗紫色固体)
二、原理:
过氧化氢———水+氧气
二氧化锰
H2O2——H2O+O2↑
MnO2
高锰酸钾—锰酸钾+二氧化锰+氧气
KMnO4—K2MnO4+MnO2+O2↑
△
△
氯酸钾———氯化钾+氧气
二氧化锰
△
KClO3——KCl+O2↑
△
MnO2
多学一点
三、实验仪器和实验装置:
外焰加热
药品平铺
夹持在距管口约1/3处
若用高锰酸钾制氧气应在管口塞一团棉花
试管口略低于试管底部
导管伸出橡 皮塞约0.5cm
导管只能伸于集气瓶口
四、实验步骤:
1、检:检查装置的气密性;
2、装:装入药品
4、加:点酒精灯加热
5、收:收集气体
排水集气法
6、移:将导管移离水面
向上排空气法
(氧气不易溶于水)
(氧气的密度比空气大)
3、固:固定试管(试管口应略低于试管底部)
7、熄:熄灭酒精灯
1、固定试管时,为什么试管口要略低于试管底部?
防止冷凝水回流到热的试管底部,炸裂试管
2、用排水集气法应什么时候开始收集?
当气泡连续均匀放出时开始收集;
(哪种方法得到的氧气更纯?
3、实验结束时应先将导管移离水面,还是先停止加热,为什么?
先将导管移离水面,后停止加热,否则水将沿导管倒流回热的试管底部,炸裂试管
五、注意事项:
用排水法收集的气体更纯)
4.用高锰酸钾制氧气时,为什么要在试管口塞一团棉花?
可以防止加热时高锰酸钾粉末进入导管
知识回顾:
制取氧气
实验室
工业
H2O2——H2O+O2↑
MnO2
KMnO4—K2MnO4+MnO2+O2↑
△
KClO3——KCl+O2↑
△
MnO2
分离液态空气法:
膜分离技术法
H2O H2 O2
电解水
通电
水
氢气 + 氧气
实验室制取气体选择装置的方法:
原理
使用的装置
依据
制法
收集
H2O2——H2O+O2↑
MnO2
KMnO4—K2MnO4+MnO2+O2↑
△
KClO3——KCl+O2↑
△
MnO2
反应物的状态和反应条件
生成的气体密度和水溶性
△
固+固→↑
固+液→↑
与空气密度比较
不易溶于水
方案一:
方案二:
化学反应基本类型:
化合反应
分解反应
定义
一般形式
举例
由两种或两种以上物质生成另一种物质的反应
A+B+C—D
P+O2点燃P2O5 S+O2点燃SO2 Fe+O2点燃Fe3O4 Al+O2点燃Al2O3
由一种反应物生成两种或两种以上其他物质的反应
A—B+C+D
H2O2——H2O+O2↑
MnO2
KClO3——KCl+O2↑
△
KMnO4—K2MnO4+MnO2+O2↑
△
MnO2
氧气的实验室制法
学习目标
1.理解实验室用过氧化氢制氧气的原理
2.初步学会制取氧气实验装置选择、氧气的收集方法及氧气的检验(重、难点)
3.认识催化剂及其作用
已经学过的制备氧气的方法有哪些?
分离液态空气法
光合作用
电解水
水 H2O
二氧化碳 CO2
食盐 NaCl
高锰酸钾 KMnO4
过氧化氢 H2O2
甲烷 CH4
氯酸钾 KClO3
√
√
√
√
√
一、选择反应物
(1)KMnO4高锰酸钾是一种紫黑色的固体,在加热时能产生氧气,还会产生锰酸钾能助燃且有毒。
(2)KClO3氯酸钾是一种白色固体,加热时能产生氧气,如果混有可燃性杂质可能会发生爆炸。
(3)H2O2过氧化氢溶液又称双氧水,是一种无色的液体,常温下就可生成氧气和水,反应速度适中,价格低廉。
资料介绍
加热
A.原料是否容易获得
B.实验条件是否容易控制
C.实验装置是否容易装配
D.实验操作是否安全可靠
二、控制反应条件
E.生成物是否有污染、 是否节省能源等
安全
环保
简便
集思广益
有什么办法可以让过氧化氢反应的速率加快?
1.提高过氧化氢的浓度
2.提高温度
3.向过氧化氢溶液中加入某物质
反应速率慢
选用药品
产生气体
速率
能否使带火星的木条复燃
A
过氧化氢
B
过氧化氢
和二氧化锰
实验现象
慢
快
否
能
实验室制取氧气的方法是:
在过氧化氢溶液中加入二氧化锰
①试管 ②烧杯 ③锥形瓶 ④ 酒精灯 ⑤铁架台
⑦分液漏斗
⑨单孔
橡皮塞和导管
⑧双孔
橡皮塞和导管
三、选择发生装置
⑥长颈漏斗
实验室制取氧气的发生装置
固体加热
固液常温
√
可控制反应速率
简易,操作简单
气体
空气
向上排空气法
空气
气体
向下排空气法
排水法
密度比空气大
密度比空气小
不溶于水,不与水反应
四、选择收集装置
小资料:通常状况下,氧气不易溶于水,且不与水反应;在 0℃,1个标准大气压下,其密度为1.429g/L,空气的密度为1.293g/L。
√
√
气体不与空气中的物质反应
收集到的气体干燥但不太纯
收集到的气体潮湿但纯净
或
实验室制取氧气的装置
制取一瓶氧气,你认为正确的操作顺序是:___________.
①连接并检查装置的气密性.
②向分液漏斗中倒入过氧化氢溶液.
③向锥形瓶中加入二氧化锰,并塞紧瓶塞.
④打开止水夹打开分液漏斗的活塞,待导管口出现均匀气泡,把导管伸入集气瓶中。
⑤将集气瓶装满水,从侧面轻推盖上毛玻璃片,翻转后,扣在水槽中.
⑥待水排净后,在水底将毛玻璃片盖紧,取出,正放。
如何检查?
①③②⑤④⑥
五、实验步骤
1.如何检查装置气密性
2.为什么要出现均匀气泡才开始收集
3.怎样判断氧气已经收集满了?
小组交流讨论
1、将反应后的二氧化锰过滤、干燥、称量,发现二氧化锰的质量不发生改变。
2、将称量后的二氧化锰再次放入过氧化氢溶液中,发现有大量气泡冒出,该气泡能使带火星的木条复燃。
【思考】
二氧化锰在这个反应中起到了什么作用?
小资料
在化学反应中,能改变其他物质的化学反应的速率,而本身的质量和化学性质, 在反应前后都没有变化的物质。
催化剂
注:①针对特定反应而言是催化剂
③催化剂反应前后化学性质不变,但物理性质可能改变
④对于同一个反应而言,可以有多种催化剂
②正催化剂:加快反应速率;负催化剂:减慢反应速率
【说明】此反应中,二氧化锰既不是反应物也不是生成物,是催化剂,是反应条件,所以写在箭头的上方。
催化作用
催化剂在化学反应中所起的作用叫催化作用。
过氧化氢 水+氧气
二氧化锰
(文字表达式)
汽车尾气
催化剂的应用
护肤品
工业
实验室制氧气的一般环节:
一、药品:过氧化氢溶液(俗称双氧水)
氯酸钾 (用二氧化锰做催化剂)
高锰酸钾
(无色液体)
(白色固体)
(黑色粉末固体)
(暗紫色固体)
二、原理:
过氧化氢———水+氧气
二氧化锰
H2O2——H2O+O2↑
MnO2
高锰酸钾—锰酸钾+二氧化锰+氧气
KMnO4—K2MnO4+MnO2+O2↑
△
△
氯酸钾———氯化钾+氧气
二氧化锰
△
KClO3——KCl+O2↑
△
MnO2
多学一点
三、实验仪器和实验装置:
外焰加热
药品平铺
夹持在距管口约1/3处
若用高锰酸钾制氧气应在管口塞一团棉花
试管口略低于试管底部
导管伸出橡 皮塞约0.5cm
导管只能伸于集气瓶口
四、实验步骤:
1、检:检查装置的气密性;
2、装:装入药品
4、加:点酒精灯加热
5、收:收集气体
排水集气法
6、移:将导管移离水面
向上排空气法
(氧气不易溶于水)
(氧气的密度比空气大)
3、固:固定试管(试管口应略低于试管底部)
7、熄:熄灭酒精灯
1、固定试管时,为什么试管口要略低于试管底部?
防止冷凝水回流到热的试管底部,炸裂试管
2、用排水集气法应什么时候开始收集?
当气泡连续均匀放出时开始收集;
(哪种方法得到的氧气更纯?
3、实验结束时应先将导管移离水面,还是先停止加热,为什么?
先将导管移离水面,后停止加热,否则水将沿导管倒流回热的试管底部,炸裂试管
五、注意事项:
用排水法收集的气体更纯)
4.用高锰酸钾制氧气时,为什么要在试管口塞一团棉花?
可以防止加热时高锰酸钾粉末进入导管
知识回顾:
制取氧气
实验室
工业
H2O2——H2O+O2↑
MnO2
KMnO4—K2MnO4+MnO2+O2↑
△
KClO3——KCl+O2↑
△
MnO2
分离液态空气法:
膜分离技术法
H2O H2 O2
电解水
通电
水
氢气 + 氧气
实验室制取气体选择装置的方法:
原理
使用的装置
依据
制法
收集
H2O2——H2O+O2↑
MnO2
KMnO4—K2MnO4+MnO2+O2↑
△
KClO3——KCl+O2↑
△
MnO2
反应物的状态和反应条件
生成的气体密度和水溶性
△
固+固→↑
固+液→↑
与空气密度比较
不易溶于水
方案一:
方案二:
化学反应基本类型:
化合反应
分解反应
定义
一般形式
举例
由两种或两种以上物质生成另一种物质的反应
A+B+C—D
P+O2点燃P2O5 S+O2点燃SO2 Fe+O2点燃Fe3O4 Al+O2点燃Al2O3
由一种反应物生成两种或两种以上其他物质的反应
A—B+C+D
H2O2——H2O+O2↑
MnO2
KClO3——KCl+O2↑
△
KMnO4—K2MnO4+MnO2+O2↑
△
MnO2
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
