鲁科版高中必修一化学第二章第二节:电解质(26张PPT)
文档属性
| 名称 | 鲁科版高中必修一化学第二章第二节:电解质(26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 939.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-23 09:45:52 | ||
图片预览








文档简介
(共26张PPT)
§2.2
电解质
(一)电解质及其电离
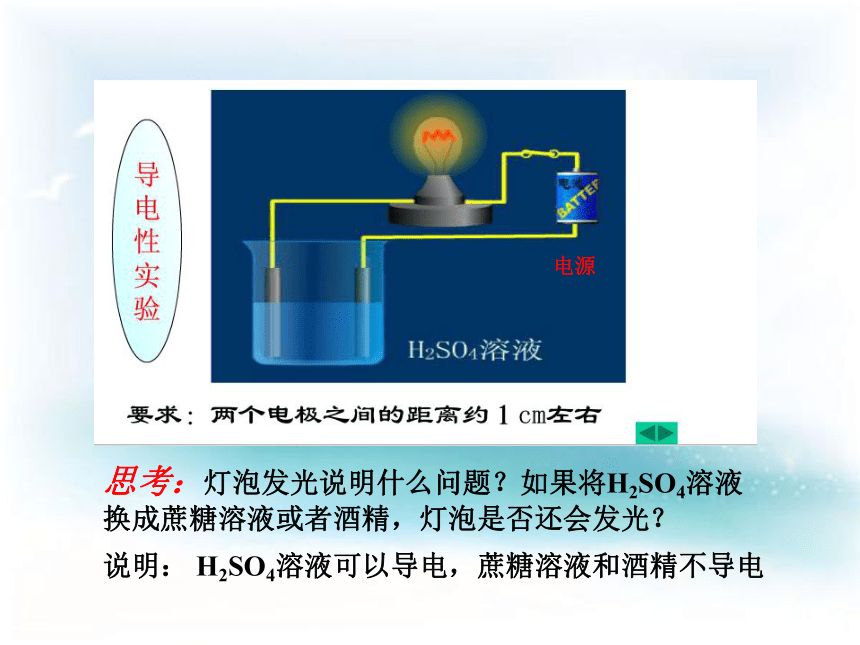
电源
思考:灯泡发光说明什么问题?如果将H2SO4溶液换成蔗糖溶液或者酒精,灯泡是否还会发光?
说明:
H2SO4溶液可以导电,蔗糖溶液和酒精不导电
在水溶液中或者熔融状态下能
导电的化合物。
在水溶液中和熔融状态下均以
分子形式存在,都不能导电的化合物。
▲
▲
化合物
{
非电解质:
电解质:
(一)电解质和非电解质
1、定义:
思考与讨论:
①电解质与非电解质都指化合物,单质及混合物既不是电解质也不是非电解质;
讨论一:判断Cu、Cl2、盐酸是电解质还是非电解质?
讨论二:电解质必须满足在水溶液中和熔融状态下都能导电吗?
②电解质不一定同时具备以上两个条件,满足其中一个
条件即可
讨论三:
CO2、SO2、NH3的水溶液也能导电,它们是电解质吗?
不是,因为导电的原因是,它们与水反应后生成的物质导电
2、注意点:
1.电解质和非电解质都是指化合物,单质和混合物既不是电解质也不是非电解质。
2.电解质不一定导电,非电解质一定不导电。
3.电解质本身能电离。
如CO2、SO2、NH3等水溶液能导电,是因为它们与水反应生成了电解质;Na2O,CaO金属氧化物在熔融状态下可电离出自由移动的离子,它们是电解质。
电解质的导电是有条件的,盐、碱(水溶液里和熔化状态下都能导电),而酸电解质(只有在水溶液里才导电)。
3、常见的电解质与非电解质
常见的电解质:酸、碱、盐、金属氧化物和水;
常见的非电解质:大部分有机物,多数非金属氧化物
小试牛刀
判断下列说法是否正确
A:NaCl溶液导电,所以NaCl溶液是电解质;
B:固体NaCl不导电,但NaCl是电解质;
C:Cu能导电,所以Cu是电解质;
D:SO3溶于水能导电,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电解质。
√
×
×
×
×
下列物质:
⑴液态氯化氢
⑵硫酸
⑶熔融MgCl2
⑷
K2SO4晶体
⑸食盐水
⑹酒精
⑺铁
⑻BaSO4
⑼
SO3
⑽石墨
其中能导电的物质有
,
属于电解质的是
,
属于非电解质的是
。
(3)(5)(7)(10)
(1)(2)(3)(4)(8)
(6)(9)
讨论三:电解质在水溶液中或熔融状态下为什么能
够导电?导电与什么因素有关?导电能力
的强弱又与什么有关?
溶液导电示意图:
离子做定向运动
自由移动的离子
电解质溶液
电离
外电场作用下
导电
(二)电解质的电离
1、定义:电解质在溶液中或熔融状态下产生自由移动的离子过程。
2、表达式:电离方程式,表示电解质电离成自由移动的离子过程的式子。
3、电离方程式书写步骤:
(3)检验“=”两边是否守恒(质量、电荷)
(1)在方程式左边写出化学式
(2)在方程式右边书写阴、阳离子符号前面配上系数
H2SO4=
HCl=
NaOH=
Ca(OH)2=
NaCl=
MgCl2=
Na++OH-
2H++SO42-
H++Cl-
Ca2++2OH-
Na++Cl-
Mg2++2Cl-
盐:电离时产生金属阳离子(或铵根离子)和酸根阴
离子的化合物
比较酸碱盐的电离方程式,比较酸碱盐电离的特点?
酸:电离时产生的阳离子全部是H+
碱:电离时产生的阴离子全部是OH-
迁移应用
1.完成下列电离方程式
(1)
=2Na++CO32-
(2)KClO3=
(3)
=
Fe3++
SO42-
(4)
=Ba2++
OH-
(5)Ca(ClO)2=
+
_
Na2CO3
K++ClO3-
Fe2(SO4)3
2
3
Ba(OH)2
2
思考:醋酸、盐酸都是电解质溶液。在相同条件下,两种物质的导电能力相同吗?
实验:体积相同条件下,0.1mol/L
盐酸和醋酸溶液的导电性情况比较。
弱电解质:
在水溶液中只能部分电离的电解质。
电
解
质
强电解质:
在水溶液里能完全电离的电解质
HCl
======
H+
+
Cl-
CH3COOH
H+
+
CH3COO-
溶液中,只存在H+和Cl-,不存在HCl分子
溶液中,既存在H+和CH3COO-
,也存在CH3COOH分子
三、强电解质和弱电解质
H+
液
面
Cl-
H+
Cl-
H+
Cl-
Cl-
H+
H+
Cl-
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
HCl电离的结果
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COO-
液
面
CH3COO-
CH3COO-
CH3COO-
H+
H+
H+
H+
CH3COOH
CH3COOH
CH3COOH
弱电解质CH3COOH的电离
思考与讨论:电解质在水溶液中或熔融状态下为什么能够导电?导电与什么因素有关?导电能力的强弱又与什么有关?
(1)因为电解质在水溶液中或熔融状态下产生了自由移动的离子,电离产生自由移动的离子是导电的前提。
(2)电解质溶液导电能力取决于溶液中离子浓度的大小,以及离子所带电荷数的多少有关(离子总浓度相同时,看离子所带的电荷数)
,离子浓度越大,离子所带电荷数越多,溶液导电能力越强。
1、相同条件下,0.1mol/L的NaCl(aq)和0.2mol/L的KNO3(aq)的导电性谁强?
2、相同条件下,均为0.1mol/L的NaCl(aq)和MgCl2(aq)哪个导电性强?
强电解质与弱电解质比较
强电解质
弱电解质
定义
电离程度
电离过程
电离方程式
电解质溶液中存在的微粒形式
水溶液中能全部电离成离子的化合物
水溶液中部分电离成离子的化合物
完全电离
只有部分电离
阴、阳离子
阴阳离子及未电离的分子
可逆过程
不可逆
常见的强电解质有哪些?
(1)强酸:
(2)强碱:
(3)大部分盐:
如NaCl等,包括部分难溶性的盐
CaCO3、BaSO4、AgCl等
(4)大部分金属氧化物:Na2O、Al2O3等
如HCl、H2SO4、HNO3等
如NaOH、KOH、Ba(OH)2等
(1)弱酸:
如CH3COOH、H2CO3、
H3PO4、
H2S、H2SO3等
(2)弱碱:
(3)水
(4)
极少数盐
如醋酸铅
(CH3COO)2Pb
常见的弱电解质有哪些?
如NH3.H2O(一水合氨)
及难溶性的Cu(OH)2、Fe(OH)3等
电离方程式的书写
[练习]:写出下列电解质电离的方程式
NH3·H2O
、
Ba(OH)2
、
Fe(OH)3、CH3COONH4、K2CO3、KHCO3、H2CO3
A
例题、下列电离方程式书写正确的是
(
)
A.CH3COOH+H2O
CH3COO-
+
H3O+
B.BaSO4
Ba2+
+
SO42-
C.H2CO3
2H+
+
CO32-
D.HCO3-
+H2O
H2CO3
+
OH-
[思考]:下列条件下如何电离
水溶液中NaHSO4
熔融状态下NaHSO4
“强电解质溶液的导电能力一定比弱电解质溶液的导电能力强”对吗?为什么?
不对,因为溶液的导电能力取决于溶液中离子浓度的大小,稀的强电解质溶液离子浓度可能小于弱电解质溶液中离子的浓度,则弱电解质溶液的导电性强于强电解质溶液的导电性!
1.BaSO4是不是电解质?为什么?
2.氯化氢和盐酸都叫电解质吗?
3.NH3、CO2、SO2、SO3溶于水都
能导电,是电解质吗?
4.蔗糖、酒精是电解质吗?
1.判断正误,将错误的分析其原因。
⑴
电解质溶液能导电,能导电的物质是电解质(
)
⑵
电解质溶液先导电,后电离(
)
⑶
固体食盐不能导电,而其水溶液有很强的导电能力,
因而食盐水是电解质(
)
⑷
硫酸钡的水溶液不能导电,所以硫酸钡是非电解质(
)
⑸
电解质本身一定含有离子(
)
⑹
BaSO4、CaCO3物质在水中溶解度很小,其水溶液导电能力弱,所以是弱电解质(
)
⑺强电解质所形成的溶液导电能力一定强,弱电解质所形成的溶液导电能力一定弱(
)
⑻
强电解质都是离子化合物(
)
⑼
不同的弱电解质只要物质的量浓度相同,其导电能力也相同(
)
2.以下各物质中:(填序号)
(1)液态HCl
(2)Fe
(3)石墨
(4)氨水
(5)纯H2SO4
(6)酒精
(7)NH4Cl(aq)
(8)NH3?H2O
(9)KOH(s)
(10)干冰
(11)BaSO4
(12)冰醋酸
(13)NaHCO3(s)
(14)HCl(g)
(15)NH3
(16)蔗糖
(17)熔融态的NaCl
(18)CO2
①其中能导电的是
②属于电解质的是
③属于非电解质的是
④属于强电解质的是
⑤属于弱电解质的是
⑥既不是电解质也不是非电解质的是
§2.2
电解质
(一)电解质及其电离
电源
思考:灯泡发光说明什么问题?如果将H2SO4溶液换成蔗糖溶液或者酒精,灯泡是否还会发光?
说明:
H2SO4溶液可以导电,蔗糖溶液和酒精不导电
在水溶液中或者熔融状态下能
导电的化合物。
在水溶液中和熔融状态下均以
分子形式存在,都不能导电的化合物。
▲
▲
化合物
{
非电解质:
电解质:
(一)电解质和非电解质
1、定义:
思考与讨论:
①电解质与非电解质都指化合物,单质及混合物既不是电解质也不是非电解质;
讨论一:判断Cu、Cl2、盐酸是电解质还是非电解质?
讨论二:电解质必须满足在水溶液中和熔融状态下都能导电吗?
②电解质不一定同时具备以上两个条件,满足其中一个
条件即可
讨论三:
CO2、SO2、NH3的水溶液也能导电,它们是电解质吗?
不是,因为导电的原因是,它们与水反应后生成的物质导电
2、注意点:
1.电解质和非电解质都是指化合物,单质和混合物既不是电解质也不是非电解质。
2.电解质不一定导电,非电解质一定不导电。
3.电解质本身能电离。
如CO2、SO2、NH3等水溶液能导电,是因为它们与水反应生成了电解质;Na2O,CaO金属氧化物在熔融状态下可电离出自由移动的离子,它们是电解质。
电解质的导电是有条件的,盐、碱(水溶液里和熔化状态下都能导电),而酸电解质(只有在水溶液里才导电)。
3、常见的电解质与非电解质
常见的电解质:酸、碱、盐、金属氧化物和水;
常见的非电解质:大部分有机物,多数非金属氧化物
小试牛刀
判断下列说法是否正确
A:NaCl溶液导电,所以NaCl溶液是电解质;
B:固体NaCl不导电,但NaCl是电解质;
C:Cu能导电,所以Cu是电解质;
D:SO3溶于水能导电,所以SO3是电解质;
E:BaSO4的水溶液不导电,所以BaSO4是非电解质。
√
×
×
×
×
下列物质:
⑴液态氯化氢
⑵硫酸
⑶熔融MgCl2
⑷
K2SO4晶体
⑸食盐水
⑹酒精
⑺铁
⑻BaSO4
⑼
SO3
⑽石墨
其中能导电的物质有
,
属于电解质的是
,
属于非电解质的是
。
(3)(5)(7)(10)
(1)(2)(3)(4)(8)
(6)(9)
讨论三:电解质在水溶液中或熔融状态下为什么能
够导电?导电与什么因素有关?导电能力
的强弱又与什么有关?
溶液导电示意图:
离子做定向运动
自由移动的离子
电解质溶液
电离
外电场作用下
导电
(二)电解质的电离
1、定义:电解质在溶液中或熔融状态下产生自由移动的离子过程。
2、表达式:电离方程式,表示电解质电离成自由移动的离子过程的式子。
3、电离方程式书写步骤:
(3)检验“=”两边是否守恒(质量、电荷)
(1)在方程式左边写出化学式
(2)在方程式右边书写阴、阳离子符号前面配上系数
H2SO4=
HCl=
NaOH=
Ca(OH)2=
NaCl=
MgCl2=
Na++OH-
2H++SO42-
H++Cl-
Ca2++2OH-
Na++Cl-
Mg2++2Cl-
盐:电离时产生金属阳离子(或铵根离子)和酸根阴
离子的化合物
比较酸碱盐的电离方程式,比较酸碱盐电离的特点?
酸:电离时产生的阳离子全部是H+
碱:电离时产生的阴离子全部是OH-
迁移应用
1.完成下列电离方程式
(1)
=2Na++CO32-
(2)KClO3=
(3)
=
Fe3++
SO42-
(4)
=Ba2++
OH-
(5)Ca(ClO)2=
+
_
Na2CO3
K++ClO3-
Fe2(SO4)3
2
3
Ba(OH)2
2
思考:醋酸、盐酸都是电解质溶液。在相同条件下,两种物质的导电能力相同吗?
实验:体积相同条件下,0.1mol/L
盐酸和醋酸溶液的导电性情况比较。
弱电解质:
在水溶液中只能部分电离的电解质。
电
解
质
强电解质:
在水溶液里能完全电离的电解质
HCl
======
H+
+
Cl-
CH3COOH
H+
+
CH3COO-
溶液中,只存在H+和Cl-,不存在HCl分子
溶液中,既存在H+和CH3COO-
,也存在CH3COOH分子
三、强电解质和弱电解质
H+
液
面
Cl-
H+
Cl-
H+
Cl-
Cl-
H+
H+
Cl-
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
Cl-
H+
HCl电离的结果
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COOH
CH3COO-
液
面
CH3COO-
CH3COO-
CH3COO-
H+
H+
H+
H+
CH3COOH
CH3COOH
CH3COOH
弱电解质CH3COOH的电离
思考与讨论:电解质在水溶液中或熔融状态下为什么能够导电?导电与什么因素有关?导电能力的强弱又与什么有关?
(1)因为电解质在水溶液中或熔融状态下产生了自由移动的离子,电离产生自由移动的离子是导电的前提。
(2)电解质溶液导电能力取决于溶液中离子浓度的大小,以及离子所带电荷数的多少有关(离子总浓度相同时,看离子所带的电荷数)
,离子浓度越大,离子所带电荷数越多,溶液导电能力越强。
1、相同条件下,0.1mol/L的NaCl(aq)和0.2mol/L的KNO3(aq)的导电性谁强?
2、相同条件下,均为0.1mol/L的NaCl(aq)和MgCl2(aq)哪个导电性强?
强电解质与弱电解质比较
强电解质
弱电解质
定义
电离程度
电离过程
电离方程式
电解质溶液中存在的微粒形式
水溶液中能全部电离成离子的化合物
水溶液中部分电离成离子的化合物
完全电离
只有部分电离
阴、阳离子
阴阳离子及未电离的分子
可逆过程
不可逆
常见的强电解质有哪些?
(1)强酸:
(2)强碱:
(3)大部分盐:
如NaCl等,包括部分难溶性的盐
CaCO3、BaSO4、AgCl等
(4)大部分金属氧化物:Na2O、Al2O3等
如HCl、H2SO4、HNO3等
如NaOH、KOH、Ba(OH)2等
(1)弱酸:
如CH3COOH、H2CO3、
H3PO4、
H2S、H2SO3等
(2)弱碱:
(3)水
(4)
极少数盐
如醋酸铅
(CH3COO)2Pb
常见的弱电解质有哪些?
如NH3.H2O(一水合氨)
及难溶性的Cu(OH)2、Fe(OH)3等
电离方程式的书写
[练习]:写出下列电解质电离的方程式
NH3·H2O
、
Ba(OH)2
、
Fe(OH)3、CH3COONH4、K2CO3、KHCO3、H2CO3
A
例题、下列电离方程式书写正确的是
(
)
A.CH3COOH+H2O
CH3COO-
+
H3O+
B.BaSO4
Ba2+
+
SO42-
C.H2CO3
2H+
+
CO32-
D.HCO3-
+H2O
H2CO3
+
OH-
[思考]:下列条件下如何电离
水溶液中NaHSO4
熔融状态下NaHSO4
“强电解质溶液的导电能力一定比弱电解质溶液的导电能力强”对吗?为什么?
不对,因为溶液的导电能力取决于溶液中离子浓度的大小,稀的强电解质溶液离子浓度可能小于弱电解质溶液中离子的浓度,则弱电解质溶液的导电性强于强电解质溶液的导电性!
1.BaSO4是不是电解质?为什么?
2.氯化氢和盐酸都叫电解质吗?
3.NH3、CO2、SO2、SO3溶于水都
能导电,是电解质吗?
4.蔗糖、酒精是电解质吗?
1.判断正误,将错误的分析其原因。
⑴
电解质溶液能导电,能导电的物质是电解质(
)
⑵
电解质溶液先导电,后电离(
)
⑶
固体食盐不能导电,而其水溶液有很强的导电能力,
因而食盐水是电解质(
)
⑷
硫酸钡的水溶液不能导电,所以硫酸钡是非电解质(
)
⑸
电解质本身一定含有离子(
)
⑹
BaSO4、CaCO3物质在水中溶解度很小,其水溶液导电能力弱,所以是弱电解质(
)
⑺强电解质所形成的溶液导电能力一定强,弱电解质所形成的溶液导电能力一定弱(
)
⑻
强电解质都是离子化合物(
)
⑼
不同的弱电解质只要物质的量浓度相同,其导电能力也相同(
)
2.以下各物质中:(填序号)
(1)液态HCl
(2)Fe
(3)石墨
(4)氨水
(5)纯H2SO4
(6)酒精
(7)NH4Cl(aq)
(8)NH3?H2O
(9)KOH(s)
(10)干冰
(11)BaSO4
(12)冰醋酸
(13)NaHCO3(s)
(14)HCl(g)
(15)NH3
(16)蔗糖
(17)熔融态的NaCl
(18)CO2
①其中能导电的是
②属于电解质的是
③属于非电解质的是
④属于强电解质的是
⑤属于弱电解质的是
⑥既不是电解质也不是非电解质的是
