苏教版必修1物质的分类及转化教学课件
图片预览







文档简介
(共28张PPT)
*
专题1
丰富多彩的化学物质
*
图书馆
1、请将下列物质进行分类,并说明分类的依据:
空气 乙醇(C2H5OH) 水 硫酸铵 铜
碘酒 碘 氧气 石墨 食盐水
交流与讨论:
一、物质的分类和转化
从组成,状态,导电性和溶解性方面分类
(2) 从状态来分 :
气态为:空气、氧气
液态为:乙醇、食盐水,碘酒
固态为:硫酸铵、铜、碘和石墨
(1)从物质组成来分:
单质有铜、碘、氧气、石墨;
化合物有:乙醇、水、硫酸铵
混合物:空气,碘酒和食盐水
(3)从导电性来分:
能导电的有:铜、石墨、水、食盐水
不能导电的有:空气、乙醇、碘、氧
气,碘酒
(4)从溶解性来分:
易溶于水的:乙醇、食盐水、硫酸铵
微溶水的:碘
难溶于水的:空气、氧气、铜、石墨
思考:
通过对以上物质进行分类,你是如何理解分类思想的?
1、分类依据怎么找?
2、分类依据不同,对分类结果有什么影响?
3、是否所有的分类都有意义?
*
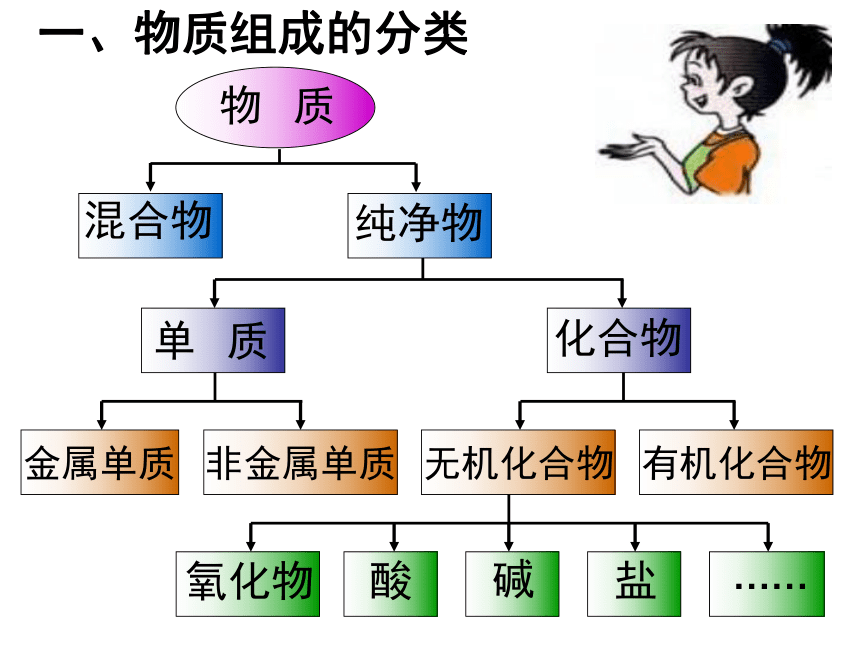
物 质
混合物
纯净物
单 质
化合物
氧化物
金属单质
非金属单质
无机化合物
有机化合物
酸
碱
盐
……
一、物质组成的分类
*
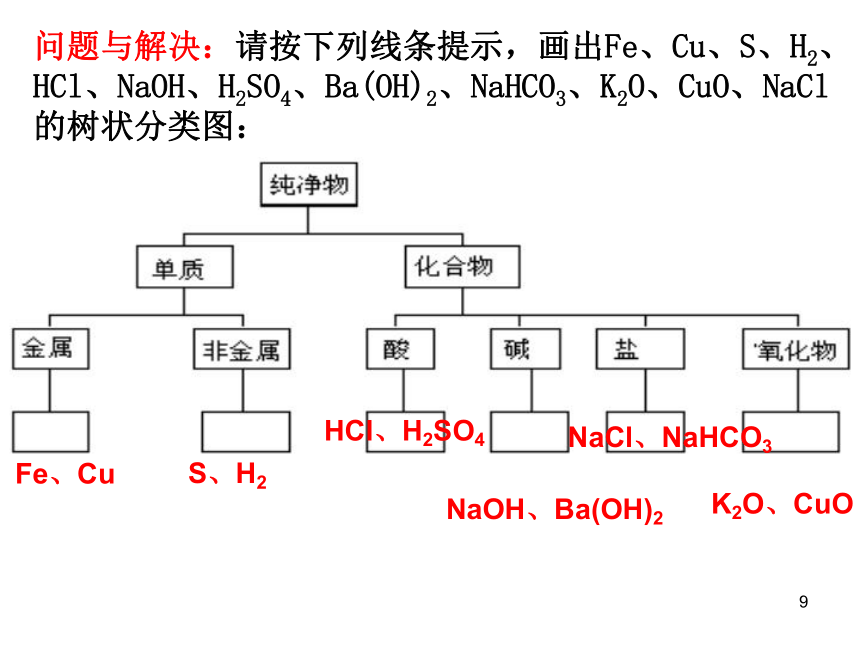
问题与解决:请按下列线条提示,画出Fe、Cu、S、H2、
HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl
的树状分类图:
Fe、Cu
S、H2
HCl、H2SO4
NaOH、Ba(OH)2
NaCl、NaHCO3
K2O、CuO
2、请根据物质的组成对下列物质进行分类:
钠(Na) 氯气(Cl2) 氯化铁(FeCl3)溶液 硫酸(H2SO4)
碳酸钙(CaCO3) 氧化钙(CaO) 氢氧化钠[NaOH]
葡萄糖(C6H12O6)二氧化碳(CO2)
混合物为:氯化铁溶液,其余为纯净物。
在纯净物中单质为:钠和氯气,其中钠为金属单质,氯气为非金属单质;
化合物有:硫酸、碳酸钙、氧化钙、氢氧化钠、葡萄糖、二氧化碳;在化合物中又可分成氧化物、酸、碱、盐。
属于氧化物为:氧化钙,二氧化碳
属于酸为:硫酸,
属于碱为:氢氧化钠,
属于盐为:碳酸钙。
*
碱性氧化物:能与酸反应生成盐和水的氧化物。如CaO、Na2O等
CaO + 2HCl = CaCl2 + H2O
酸性氧化物:能与碱反应生成盐和水的氧化物。如CO2、SO2等
CO2 + Ca(OH)2 = CaCO3↓ + H2O
酸式盐:电离时生成的阳离子除金属离子(或NH4+)外还有氢离子,阴离子为酸根离子的盐。(NaHCO3、NaHSO3、NaHSO4)
碱式盐:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐。 碱式碳酸铜Cu2(OH)2CO3和
羟基磷灰石Ca5(PO4)3·(OH)等
*
练习:下列每组物质都有一种物质与其他物质在分类上
不同,试分析每组中物质的组成规律,将这种不同于其
他物质的物质找出来
(1)NaCl、KCl、NaClO、BaCl2 理由 ;
(2)HClO3、KClO3、Cl2、NaClO3 理由 ;
(3)H3PO4、H4SiO4、HCl、H2SO4 理由 ;
(4)浊液、溶液、胶体、水 理由 ;
(5)空气、N2、HCl、CuSO4.5H2O 理由 ;
(6)铜、金、汞、钠 理由 。
(1) NaClO 理由:只有NaClO不是氯化物,即不是盐酸盐
(2) Cl2 理由:只有Cl2中Cl的化合价为0
(3)HCl 理由:只有HCl为无氧酸
(4) 水 理由: 只有水是纯净物,其它为混合物
(5) 空气 理由 :只有空气为混合物,其他为纯净物;
(6) 钠 理由:只有钠属于活泼金属,在金属活动性顺序表中排在H的前面,其他的为不
活泼金属,排在H的后面。也可以根据金属在通常情况下状态不同分类,汞通常情况下是
液态金属。
*
一、物质的转化
物质的转化类型
化学方程式
单质→ 化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
C + O2 == CO2
点燃
CaO + H2O == Ca(OH)2
CO2 + H2O == H2CO3
NaOH + HCl == NaCl + H2O
*
酸、碱、盐等物质的反应规律
[实例分析]
电解熔融的氯化钙可以得到单质钙和氯气,钙燃烧可以得到氧化钙请根据已学知识完成下列可能的转化,并写出相关的方程式。
CaCO3
CaO
Ca(OH)2
CaCl2
Ca
1
2
3
4
5
6
7
8
9
1、CaO + CO2 ==== CaCO3
2、CaCO3=== CaO + CO2
3、CaO + H2O === Ca(OH)2
4、2Ca + O2 === 2CaO
5、CaCl2 === Ca + Cl2
6、CaO + 2HCl === CaCl2 + H2O
7、CaCO3 + 2HCl === CaCl2 + H2O + CO2
8、Ca(OH)2 + 2HCl === CaCl2 + 2H2O
9、Ca(OH)2 + CO2 === CaCO3 + H2O
高温
点燃
电解
化合
分解
化合
化合
分解
复分解
复分解
复分解
复分解
*
反应类型 实例
四种基本类型的化学反应
化合反应
分解反应
置换反应
复分解反应
A+B=AB
AB=A+B
AB+C=A+BC
AB+CD=AD+CB
H2SO4 +2NaOH====Na2SO4 +2H2O
2H2+O2====2H2O
点燃
2KClO3====2KCl+3O2
点燃
H2SO4 +Zn====ZnSO4 +2H2
一、物质的转化
两类反应发生的条件
(1)在水溶液中,发生的复分解反应,至少要具备下列条件之一:
a: 生成难溶物质(沉淀,包括微溶物)b:生成挥发性物质(气体)c:生成难电离物(如水)
(2)在水溶液中,一种金属与另一种可溶性金属的盐溶液发生置换反应具备的条件是:活动性强的金属置换活动性弱的金属
金属活动性顺序(常见元素)
K Ca Na Mg Al Zn Fe … Cu Hg Ag
问题:是否所有的化学反应都可以归为这四类反应呢?
4HCl + MnO2 === MnCl2 + Cl2 + 2H2O ?
+4
+2
-1
0
氧化还原反应
Fe+CuSO4=FeSO4+Cu
反应前后元素化合价变化特征
0 +2 +2 0
概念:同种元素反应前后发生元素化合价变化的反应.
3NO2+H2O=2HNO3+NO ( )
CO2+H2O=H2CO3 ( )
H2+Cl2===2HCl ( )
Cu2(OH)2CO3===2CuO+CO2↑+H2O ( )
2AgNO3===2Ag+2NO2↑+O2↑ ( )
练习:判断下列反应是否氧化还原反应
光照
△
△
(省锡中卞恒俊)
√
×
√
×
√
*
练习:有以下6个反应(反应条件略):
A.2Na + 2H2O =2NaOH + H2↑
B. CH4 + 2O2=CO2 + 2H2O
C. KClO3=2KCl + 3O2↑
D. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
E. Na2O+CO2=Na2CO3
F. CO2+C=2CO
属于化合反应的有 (填编号,下同),
属于分解反应的有 ,
属于复分解反应的有 ,
属于置换反应的有 ,
属于氧化还原反应的有 。
EF
C
D
A
ABCF
*
化学反应的分类
根据反应物和生成物的类别
化合反应
分解反应
置换反应
复分解反应
根据反应过程中元素化合价是否发生变化
氧化还原反应
非氧化还原反应
*
氧化还原反应和四大基本反应类型的关系
氧化还原反应
置 换
化 合
分 解
复分解
1、某物质经分析知,其中仅含一种元素,
此物质
A.可能是纯净物也可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质
[补充练习]
举反例 如O2 和O3混合,所以选A
2.下列关于化学反应类型的叙述中,正确的是
A. 凡是生成盐和水的反应都是中和反应
B、复分解反应一定没有单质参加
C、生成一种单质和一种化合物的反应一定是置换反应
D、分解反应的生成物一定有单质
A:中和反应是酸和碱反应生成盐和水,能生成盐和水的反应很多,但很多不是中和反应,如酸性氧化物和碱反应
B:正确
C:举反例证明如 2KClO3=== 2KCl + O2
D:举反例证明如 CaCO3=== CaO + CO2
3、按下列要求各写出一个化学反应方程式:
(1)有水生成的化合反应________________________________
(2)生成一种碱性氧化物和一种酸性氧化物的分解反应_______
(3)有硝酸银参加反应生成硝酸铜的置换反应_______________
(4)生成两种沉淀的复分解反应_____________________________
Ba(OH)2+ CuSO4
4、下列描述正确的是
A、氧化还原反应是既得氧又失氧的反应
B、判断一个反应是否为氧化还原反应的依据是是否有
化合价的升降
C、氧化和还原是独立存在的,一个反应是氧化反应,就不可能是
还原反应。
D、氧化和还原是同时存在的,发生氧化反应的同时必然会发生
还原反应。
B、D
*
专题1
丰富多彩的化学物质
*
图书馆
1、请将下列物质进行分类,并说明分类的依据:
空气 乙醇(C2H5OH) 水 硫酸铵 铜
碘酒 碘 氧气 石墨 食盐水
交流与讨论:
一、物质的分类和转化
从组成,状态,导电性和溶解性方面分类
(2) 从状态来分 :
气态为:空气、氧气
液态为:乙醇、食盐水,碘酒
固态为:硫酸铵、铜、碘和石墨
(1)从物质组成来分:
单质有铜、碘、氧气、石墨;
化合物有:乙醇、水、硫酸铵
混合物:空气,碘酒和食盐水
(3)从导电性来分:
能导电的有:铜、石墨、水、食盐水
不能导电的有:空气、乙醇、碘、氧
气,碘酒
(4)从溶解性来分:
易溶于水的:乙醇、食盐水、硫酸铵
微溶水的:碘
难溶于水的:空气、氧气、铜、石墨
思考:
通过对以上物质进行分类,你是如何理解分类思想的?
1、分类依据怎么找?
2、分类依据不同,对分类结果有什么影响?
3、是否所有的分类都有意义?
*
物 质
混合物
纯净物
单 质
化合物
氧化物
金属单质
非金属单质
无机化合物
有机化合物
酸
碱
盐
……
一、物质组成的分类
*
问题与解决:请按下列线条提示,画出Fe、Cu、S、H2、
HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl
的树状分类图:
Fe、Cu
S、H2
HCl、H2SO4
NaOH、Ba(OH)2
NaCl、NaHCO3
K2O、CuO
2、请根据物质的组成对下列物质进行分类:
钠(Na) 氯气(Cl2) 氯化铁(FeCl3)溶液 硫酸(H2SO4)
碳酸钙(CaCO3) 氧化钙(CaO) 氢氧化钠[NaOH]
葡萄糖(C6H12O6)二氧化碳(CO2)
混合物为:氯化铁溶液,其余为纯净物。
在纯净物中单质为:钠和氯气,其中钠为金属单质,氯气为非金属单质;
化合物有:硫酸、碳酸钙、氧化钙、氢氧化钠、葡萄糖、二氧化碳;在化合物中又可分成氧化物、酸、碱、盐。
属于氧化物为:氧化钙,二氧化碳
属于酸为:硫酸,
属于碱为:氢氧化钠,
属于盐为:碳酸钙。
*
碱性氧化物:能与酸反应生成盐和水的氧化物。如CaO、Na2O等
CaO + 2HCl = CaCl2 + H2O
酸性氧化物:能与碱反应生成盐和水的氧化物。如CO2、SO2等
CO2 + Ca(OH)2 = CaCO3↓ + H2O
酸式盐:电离时生成的阳离子除金属离子(或NH4+)外还有氢离子,阴离子为酸根离子的盐。(NaHCO3、NaHSO3、NaHSO4)
碱式盐:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐。 碱式碳酸铜Cu2(OH)2CO3和
羟基磷灰石Ca5(PO4)3·(OH)等
*
练习:下列每组物质都有一种物质与其他物质在分类上
不同,试分析每组中物质的组成规律,将这种不同于其
他物质的物质找出来
(1)NaCl、KCl、NaClO、BaCl2 理由 ;
(2)HClO3、KClO3、Cl2、NaClO3 理由 ;
(3)H3PO4、H4SiO4、HCl、H2SO4 理由 ;
(4)浊液、溶液、胶体、水 理由 ;
(5)空气、N2、HCl、CuSO4.5H2O 理由 ;
(6)铜、金、汞、钠 理由 。
(1) NaClO 理由:只有NaClO不是氯化物,即不是盐酸盐
(2) Cl2 理由:只有Cl2中Cl的化合价为0
(3)HCl 理由:只有HCl为无氧酸
(4) 水 理由: 只有水是纯净物,其它为混合物
(5) 空气 理由 :只有空气为混合物,其他为纯净物;
(6) 钠 理由:只有钠属于活泼金属,在金属活动性顺序表中排在H的前面,其他的为不
活泼金属,排在H的后面。也可以根据金属在通常情况下状态不同分类,汞通常情况下是
液态金属。
*
一、物质的转化
物质的转化类型
化学方程式
单质→ 化合物
碱性氧化物→碱
酸性氧化物→酸
酸→盐
C + O2 == CO2
点燃
CaO + H2O == Ca(OH)2
CO2 + H2O == H2CO3
NaOH + HCl == NaCl + H2O
*
酸、碱、盐等物质的反应规律
[实例分析]
电解熔融的氯化钙可以得到单质钙和氯气,钙燃烧可以得到氧化钙请根据已学知识完成下列可能的转化,并写出相关的方程式。
CaCO3
CaO
Ca(OH)2
CaCl2
Ca
1
2
3
4
5
6
7
8
9
1、CaO + CO2 ==== CaCO3
2、CaCO3=== CaO + CO2
3、CaO + H2O === Ca(OH)2
4、2Ca + O2 === 2CaO
5、CaCl2 === Ca + Cl2
6、CaO + 2HCl === CaCl2 + H2O
7、CaCO3 + 2HCl === CaCl2 + H2O + CO2
8、Ca(OH)2 + 2HCl === CaCl2 + 2H2O
9、Ca(OH)2 + CO2 === CaCO3 + H2O
高温
点燃
电解
化合
分解
化合
化合
分解
复分解
复分解
复分解
复分解
*
反应类型 实例
四种基本类型的化学反应
化合反应
分解反应
置换反应
复分解反应
A+B=AB
AB=A+B
AB+C=A+BC
AB+CD=AD+CB
H2SO4 +2NaOH====Na2SO4 +2H2O
2H2+O2====2H2O
点燃
2KClO3====2KCl+3O2
点燃
H2SO4 +Zn====ZnSO4 +2H2
一、物质的转化
两类反应发生的条件
(1)在水溶液中,发生的复分解反应,至少要具备下列条件之一:
a: 生成难溶物质(沉淀,包括微溶物)b:生成挥发性物质(气体)c:生成难电离物(如水)
(2)在水溶液中,一种金属与另一种可溶性金属的盐溶液发生置换反应具备的条件是:活动性强的金属置换活动性弱的金属
金属活动性顺序(常见元素)
K Ca Na Mg Al Zn Fe … Cu Hg Ag
问题:是否所有的化学反应都可以归为这四类反应呢?
4HCl + MnO2 === MnCl2 + Cl2 + 2H2O ?
+4
+2
-1
0
氧化还原反应
Fe+CuSO4=FeSO4+Cu
反应前后元素化合价变化特征
0 +2 +2 0
概念:同种元素反应前后发生元素化合价变化的反应.
3NO2+H2O=2HNO3+NO ( )
CO2+H2O=H2CO3 ( )
H2+Cl2===2HCl ( )
Cu2(OH)2CO3===2CuO+CO2↑+H2O ( )
2AgNO3===2Ag+2NO2↑+O2↑ ( )
练习:判断下列反应是否氧化还原反应
光照
△
△
(省锡中卞恒俊)
√
×
√
×
√
*
练习:有以下6个反应(反应条件略):
A.2Na + 2H2O =2NaOH + H2↑
B. CH4 + 2O2=CO2 + 2H2O
C. KClO3=2KCl + 3O2↑
D. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
E. Na2O+CO2=Na2CO3
F. CO2+C=2CO
属于化合反应的有 (填编号,下同),
属于分解反应的有 ,
属于复分解反应的有 ,
属于置换反应的有 ,
属于氧化还原反应的有 。
EF
C
D
A
ABCF
*
化学反应的分类
根据反应物和生成物的类别
化合反应
分解反应
置换反应
复分解反应
根据反应过程中元素化合价是否发生变化
氧化还原反应
非氧化还原反应
*
氧化还原反应和四大基本反应类型的关系
氧化还原反应
置 换
化 合
分 解
复分解
1、某物质经分析知,其中仅含一种元素,
此物质
A.可能是纯净物也可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质
[补充练习]
举反例 如O2 和O3混合,所以选A
2.下列关于化学反应类型的叙述中,正确的是
A. 凡是生成盐和水的反应都是中和反应
B、复分解反应一定没有单质参加
C、生成一种单质和一种化合物的反应一定是置换反应
D、分解反应的生成物一定有单质
A:中和反应是酸和碱反应生成盐和水,能生成盐和水的反应很多,但很多不是中和反应,如酸性氧化物和碱反应
B:正确
C:举反例证明如 2KClO3=== 2KCl + O2
D:举反例证明如 CaCO3=== CaO + CO2
3、按下列要求各写出一个化学反应方程式:
(1)有水生成的化合反应________________________________
(2)生成一种碱性氧化物和一种酸性氧化物的分解反应_______
(3)有硝酸银参加反应生成硝酸铜的置换反应_______________
(4)生成两种沉淀的复分解反应_____________________________
Ba(OH)2+ CuSO4
4、下列描述正确的是
A、氧化还原反应是既得氧又失氧的反应
B、判断一个反应是否为氧化还原反应的依据是是否有
化合价的升降
C、氧化和还原是独立存在的,一个反应是氧化反应,就不可能是
还原反应。
D、氧化和还原是同时存在的,发生氧化反应的同时必然会发生
还原反应。
B、D
