苏教版必修1物质的量
图片预览





文档简介
(共18张PPT)
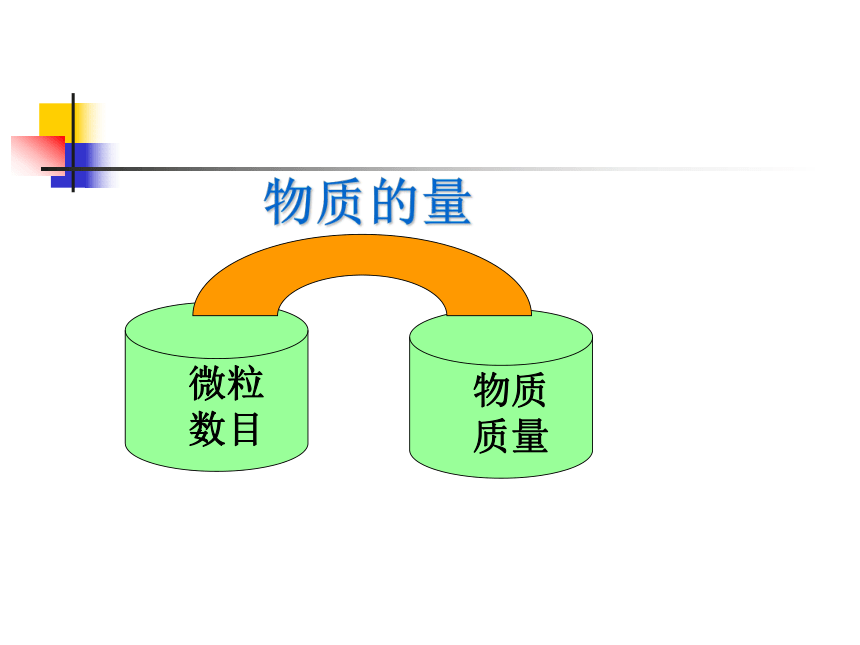
物质的量
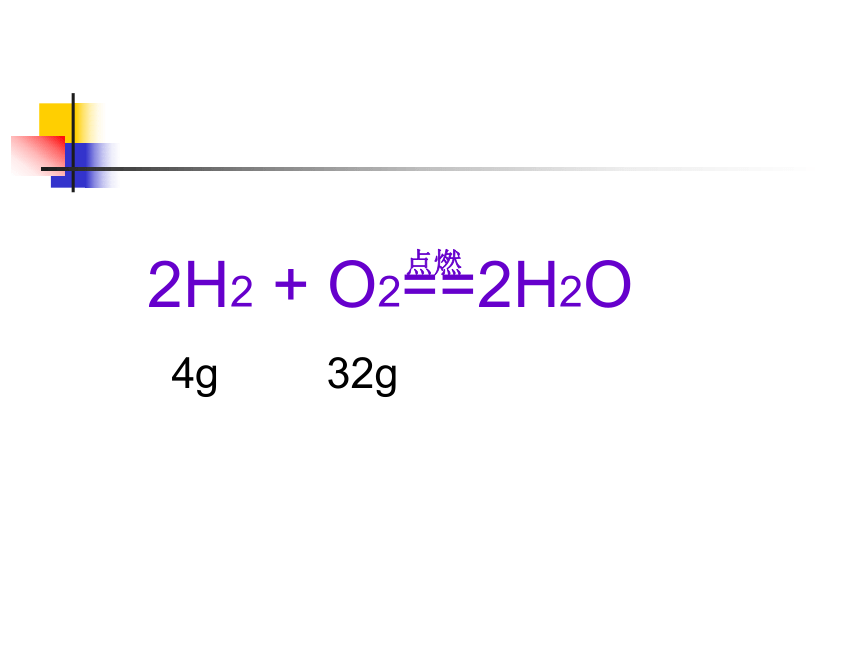
2H2 + O2==2H2O
4g 32g
点燃
微粒数目
物质质量
物质的量
自学提示:
1. 物质的量:符号、单位。
2. 1mol某种微粒集合体中所含的微粒数
与__________中所含的原子数相同。
3. 阿伏加德罗常数:符号、近似值。
4. 物质的量、阿伏加德罗常数和微粒数
之间的关系。
*物质的量
国际单位制中的基本物理量之一
符号:n
单位:摩尔(mol)
* 1mol某种微粒集合体中所含的微粒数与 0.012 kg C-12 中所含的原子数相同。
* 0.012kg C-12中所含的原子数称为阿伏加德罗常数,
符号:NA
近似值:6.02×1023 mol-1
1mol O2中约含6.02×1023个氧分子;
1mol C 中约含6.02×1023个碳原子;
1mol H2SO4中约含6.02×1023个硫酸分子;
1mol NaOH中约6.02×1023个Na+和
6.02×1023个OH-。
n mol某种微粒集合体中所含微粒数约为n×6.02×1023
*物质的量(n)、阿伏加德罗常数(NA)和微粒数(N)之间的关系
微粒数=物质的量×阿伏加德罗常数
N = n · NA
问题解决:
(1)0.5 mol H2中的氢分子数____________
(2)1 mol NaCl 中的氯离子数____________
(3)1 mol H2SO4中的氧原子数___________
(4)1.204×1024个水分子的物质的量________
(5)9.03×1023个铁原子的物质的量_________
3.01×1023
6.02×1023
2.408×1024
2 mol
1.5 mol
物质的量的概念在化学方程式中的应用
2H2 + O2==2H2O
点燃
物质的量 2mol 1mol 2mol
2molH2和1molO2完全反应可以生成2molH2O
交流与讨论
写出下列反应的化学方程式,并说明反应
物和生成物之间物质的量的关系。
(1)氢氧化钠溶液与盐酸反应
(2)氧化铁在高温下与一氧化碳反应
(3)氯酸钾受热分解生成氧气和氯化钾
(4)过氧化氢(H2O2)分解生成氧气与水
NaOH+HCl==NaCl+H2O
Fe2O3+3CO == 2Fe+3CO2
2KClO3 == 2KCl+3O2↑
2H2O2==2H2O+O2↑
△
高温
MnO2
练习:
1.下列说法正确的是( )
A.摩尔是七个基本物理量之一
B.1mol氢
C.摩尔是表示物质的数量的单位
D.每摩尔物质都含有阿伏加德罗常数个指定粒子
D
2.下列叙述正确的是( )
A.等物质的量的SO2和SO3,它们的O数目之比为3:2
B. 1molH+中含有的H+数为NA
C.1mol任何物质都含有约6.02×1023 个原子
D.0.1molH3PO4所含的原子数目与 0.1molH2SO4所含的原子数目相等
B
3.下列物质中,与0.3molH2O含相同氢原子数的物质是( )
A.0.3 mol HNO3
B.3.612×1023个HNO3分子
C.0.1 mol H3PO4
D.0.2 mol CH4
B
4. 1 mol Na转变为Na+时失去的电子数为( )
A.3.01×1023 B. 6.02×1023
C.1.204×1023 D.6.02×10-23
B
5. (1)0.3 mol NH3分子中所含原子数
与______mol H2O分子中所
含原子数相同;
(2)等物质的量的CO和CO2所含的原子
个数之比是_________
0.4
2:3
物质的量
2H2 + O2==2H2O
4g 32g
点燃
微粒数目
物质质量
物质的量
自学提示:
1. 物质的量:符号、单位。
2. 1mol某种微粒集合体中所含的微粒数
与__________中所含的原子数相同。
3. 阿伏加德罗常数:符号、近似值。
4. 物质的量、阿伏加德罗常数和微粒数
之间的关系。
*物质的量
国际单位制中的基本物理量之一
符号:n
单位:摩尔(mol)
* 1mol某种微粒集合体中所含的微粒数与 0.012 kg C-12 中所含的原子数相同。
* 0.012kg C-12中所含的原子数称为阿伏加德罗常数,
符号:NA
近似值:6.02×1023 mol-1
1mol O2中约含6.02×1023个氧分子;
1mol C 中约含6.02×1023个碳原子;
1mol H2SO4中约含6.02×1023个硫酸分子;
1mol NaOH中约6.02×1023个Na+和
6.02×1023个OH-。
n mol某种微粒集合体中所含微粒数约为n×6.02×1023
*物质的量(n)、阿伏加德罗常数(NA)和微粒数(N)之间的关系
微粒数=物质的量×阿伏加德罗常数
N = n · NA
问题解决:
(1)0.5 mol H2中的氢分子数____________
(2)1 mol NaCl 中的氯离子数____________
(3)1 mol H2SO4中的氧原子数___________
(4)1.204×1024个水分子的物质的量________
(5)9.03×1023个铁原子的物质的量_________
3.01×1023
6.02×1023
2.408×1024
2 mol
1.5 mol
物质的量的概念在化学方程式中的应用
2H2 + O2==2H2O
点燃
物质的量 2mol 1mol 2mol
2molH2和1molO2完全反应可以生成2molH2O
交流与讨论
写出下列反应的化学方程式,并说明反应
物和生成物之间物质的量的关系。
(1)氢氧化钠溶液与盐酸反应
(2)氧化铁在高温下与一氧化碳反应
(3)氯酸钾受热分解生成氧气和氯化钾
(4)过氧化氢(H2O2)分解生成氧气与水
NaOH+HCl==NaCl+H2O
Fe2O3+3CO == 2Fe+3CO2
2KClO3 == 2KCl+3O2↑
2H2O2==2H2O+O2↑
△
高温
MnO2
练习:
1.下列说法正确的是( )
A.摩尔是七个基本物理量之一
B.1mol氢
C.摩尔是表示物质的数量的单位
D.每摩尔物质都含有阿伏加德罗常数个指定粒子
D
2.下列叙述正确的是( )
A.等物质的量的SO2和SO3,它们的O数目之比为3:2
B. 1molH+中含有的H+数为NA
C.1mol任何物质都含有约6.02×1023 个原子
D.0.1molH3PO4所含的原子数目与 0.1molH2SO4所含的原子数目相等
B
3.下列物质中,与0.3molH2O含相同氢原子数的物质是( )
A.0.3 mol HNO3
B.3.612×1023个HNO3分子
C.0.1 mol H3PO4
D.0.2 mol CH4
B
4. 1 mol Na转变为Na+时失去的电子数为( )
A.3.01×1023 B. 6.02×1023
C.1.204×1023 D.6.02×10-23
B
5. (1)0.3 mol NH3分子中所含原子数
与______mol H2O分子中所
含原子数相同;
(2)等物质的量的CO和CO2所含的原子
个数之比是_________
0.4
2:3
