常见物质的检验
图片预览




文档简介
(共21张PPT)
常见物质的检验
复习
我们常用的物质分离方法 了解原理和操作要点
过滤
蒸发
结晶
降温
结晶
萃取
分液
蒸馏
分馏
层析
升华
渗析
盐析
洗气
了解:
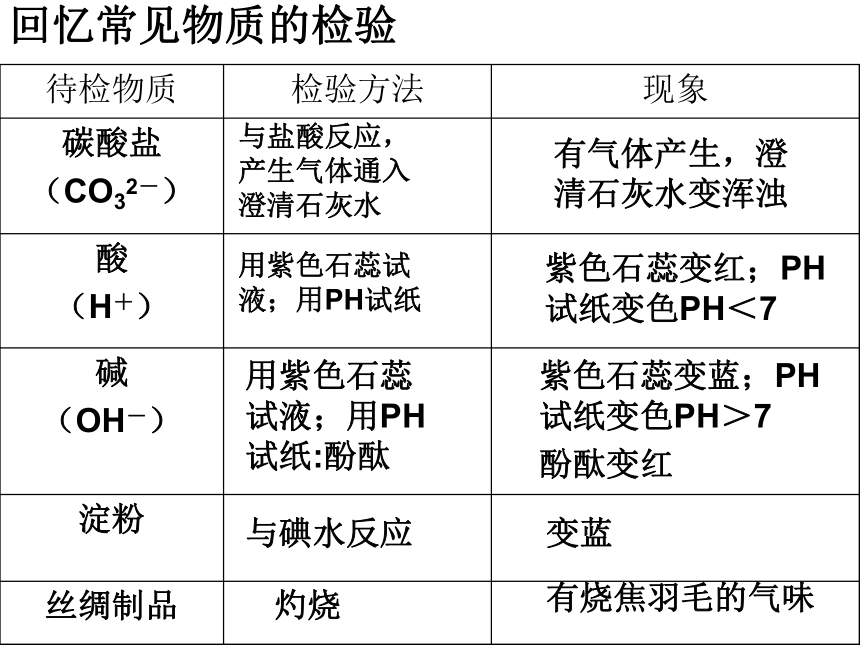
回忆常见物质的检验
待检物质 检验方法 现象
碳酸盐
(CO32-)
酸
(H+)
碱
(OH-)
淀粉
丝绸制品
与盐酸反应,产生气体通入澄清石灰水
有气体产生,澄清石灰水变浑浊
用紫色石蕊试液;用PH试纸
紫色石蕊变红;PH试纸变色PH<7
用紫色石蕊试液;用PH试纸:酚酞
紫色石蕊变蓝;PH试纸变色PH>7
酚酞变红
与碘水反应
变蓝
灼烧
有烧焦羽毛的气味
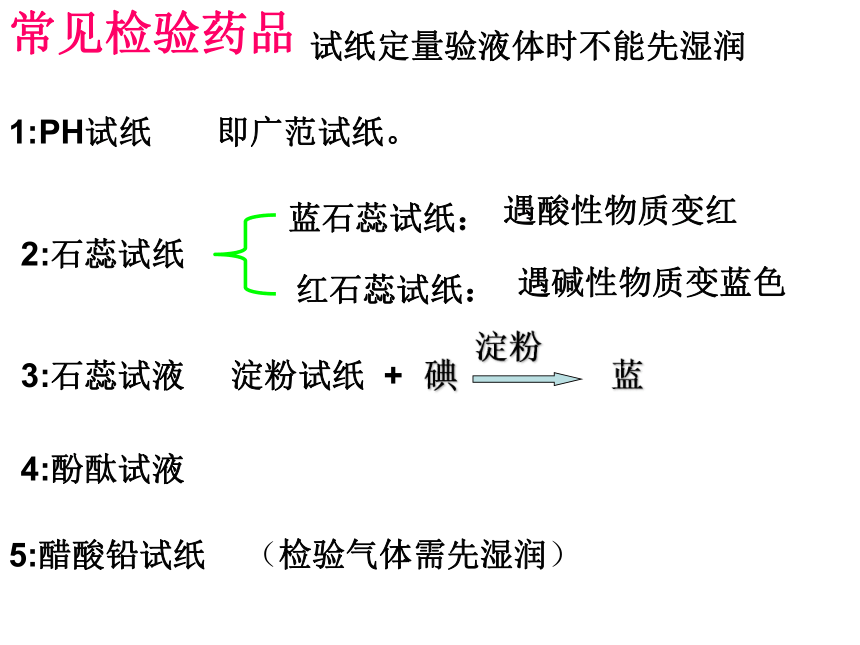
常见检验药品
1:PH试纸
即广范试纸。
试纸定量验液体时不能先湿润
2:石蕊试纸
红石蕊试纸:
遇碱性物质变蓝色
蓝石蕊试纸:
遇酸性物质变红
5:醋酸铅试纸
(检验气体需先湿润)
淀粉试纸 +
碘
淀粉
蓝
3:石蕊试液
4:酚酞试液
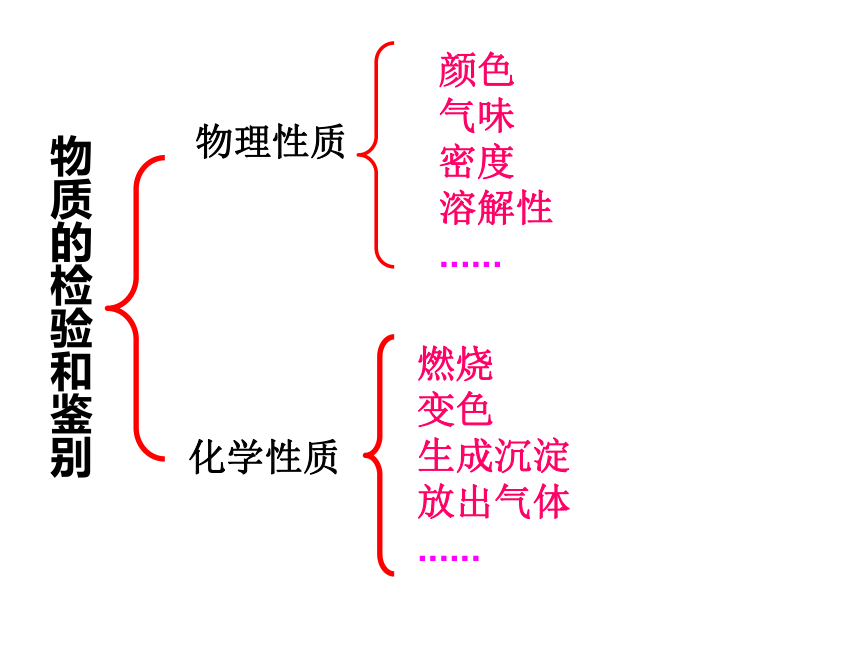
物质的检验和鉴别
物理性质
颜色
气味
密度
溶解性
......
燃烧
变色
生成沉淀
放出气体
......
化学性质
特殊颜色的物质:
①黑色粉末:
Fe3O4、CuO、MnO2、
木炭粉、铁粉...
②红色固体:
Cu、Fe2O3、HgO...
③一些离子在溶液中的颜色:
Cu2+--蓝色、 Fe3+--棕黄色、
Fe2+--浅绿色、 MnO4- --紫红色。
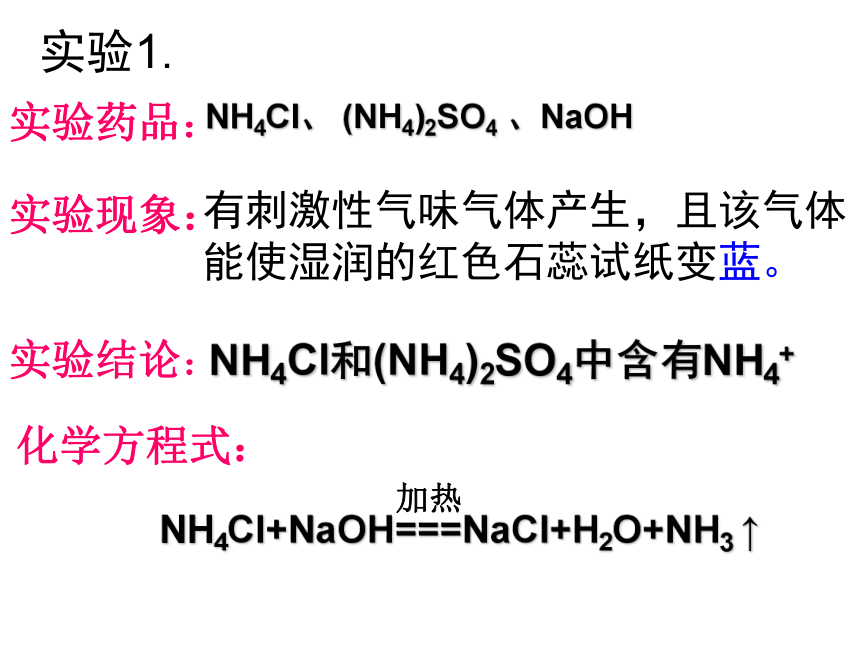
实验1:
NH4Cl和(NH4)2SO4各2mL,分别加入
2mLNaOH,稍加热,将先准备好的
湿润的红色石蕊试纸靠近试管口
实验步骤:
实验现象:闻气味及观察试纸颜色的变化
实验2:
实验步骤:
NH4Cl和KCl各少量(1~2)mL,各滴几滴稀HNO3,再各滴几滴Ag NO 3
实验现象:观察液体变化
实验3:
实验步骤:
(NH4)2SO4和K2SO4溶液各少量,各滴几滴稀盐酸,再各滴几滴BaCl2溶液
实验现象:观察液体变化
实验现象:
实验药品:
有刺激性气味气体产生,且该气体能使湿润的红色石蕊试纸变蓝。
NH4Cl和(NH4)2SO4中含有NH4+
实验1.
NH4Cl、 (NH4)2SO4 、NaOH
实验现象:
实验药品:
实验结论:
化学方程式:
加热
NH4Cl+NaOH===NaCl+H2O+NH3 ↑
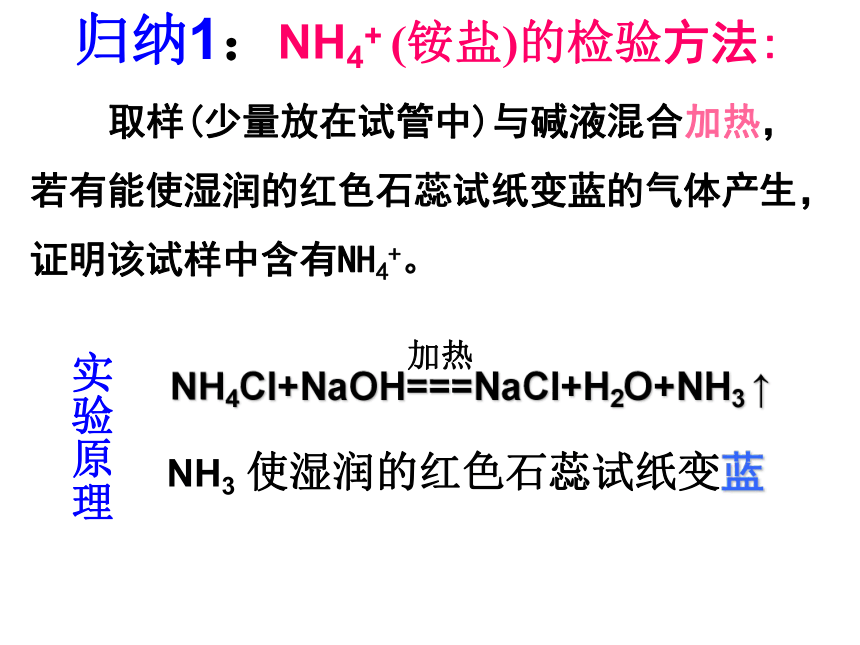
取样(少量放在试管中)与碱液混合加热,若有能使湿润的红色石蕊试纸变蓝的气体产生,证明该试样中含有NH4+。
归纳1:NH4+ (铵盐)的检验方法:
NH3 使湿润的红色石蕊试纸变蓝
加热
NH4Cl+NaOH===NaCl+H2O+NH3 ↑
实验原理
实验2.
实验药品:
NH4Cl、KCl、稀硝酸和AgNO 3
实验现象:
实验结论:
稀硝酸的作用是什么,能用稀盐酸或稀硫酸代替吗
反应生成不溶于稀硝酸的白色沉淀
NH4Cl和KCl中含有Cl-
讨论与思考:
排除CO32-和SO32-的干扰
Ag++ Cl-= AgCl
取样并向内加入稀HNO3,再加入AgNO3溶液,若生成白色沉淀,证明该试样中含有Cl- 。
归纳2: Cl-的检验方法:
实验3:
实验药品:
(NH4)2SO4、K2SO4、稀盐酸 和BaCl2
实验现象:
反应生成不溶于稀盐酸的白色沉淀
实验结论:
硫酸铵、硫酸钾中含有SO42-
稀盐酸的作用是什么,能用稀硝酸代替吗
化学方程式:
(NH4)2SO4 + BaCl2==BaSO4 + 2NH4Cl
排除CO32-和SO32-的干扰
SO32- 硝酸 SO42-
取样并向内加稀盐酸,无沉淀生成,再加入BaCl2溶液,若生成白色沉淀,证明该试样中含有SO42-。
归纳3: SO42- (硫酸盐)的检验方法
思考:
某白色晶体可能是氯化铵,怎样证明?请写出你所需的实验药品、操作步骤、实验现象及相关化学方程式。
练习1:某溶液中含有大量的Cl-、SO42-、OH- 三
种离子,如果只取一次就能够将3种阴离子依次检
验出来,正确的实验操作顺序是:
① 滴加Mg(NO3)2溶液 ② 过滤
③ 滴加Ba(NO3)2 ④滴加AgNO3
①②③②④ 或 ③②①②④
2:如果实验室里有两瓶失去标签的试剂,它们分别是碳酸钠溶液和碳酸钾溶液,你该怎样鉴别?
4.焰色反应
金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,这在化学上叫做焰色反应。
一根铂丝,在酒精灯火焰上灼烧,若火焰有颜色,可将铂丝在稀盐酸中蘸一下,再灼烧至无色。用灼烧后的铂丝蘸取少许待测物,火焰中灼烧透过钴玻璃观察到不同颜色的火焰
Na 为黄色 K为紫色(透过钴玻璃观察)
除杂
洗、烧、蘸、烧
几种金属的焰色反应
Na(Na+)
K(K+)透过钴玻璃观察
Li(Li+)
用红外光谱仪来确定:物质中是否含有某些有机基团
用元素分析仪测定:物质中是否含C、H、O、N、S等元素
5. 仪器分析法:课本P21
用原子吸收光谱确定:物质中是否含有哪些金属元素
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
A.NaOH B.Na2CO3
C.AgNO3 D.BaCl2
练习
B
A
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液做焰色反应时火焰呈黄色,则该溶液中一定有钾离子
D.验证烧碱溶液中是否含有Cl-,先加足量稀硝酸,再加入AgNO3溶液,若有白色沉淀,证明含Cl-
3、对下列实验过程的评价,正确的是
√
2、在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO、KCl、MgCl2和Fe2(SO4)3溶液,这种试剂是( ) A.NaOH B.Na2CO3 C.AgNO3 D.BaCl2
3、以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量 的CO
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
2-
3
C
常见物质的检验
复习
我们常用的物质分离方法 了解原理和操作要点
过滤
蒸发
结晶
降温
结晶
萃取
分液
蒸馏
分馏
层析
升华
渗析
盐析
洗气
了解:
回忆常见物质的检验
待检物质 检验方法 现象
碳酸盐
(CO32-)
酸
(H+)
碱
(OH-)
淀粉
丝绸制品
与盐酸反应,产生气体通入澄清石灰水
有气体产生,澄清石灰水变浑浊
用紫色石蕊试液;用PH试纸
紫色石蕊变红;PH试纸变色PH<7
用紫色石蕊试液;用PH试纸:酚酞
紫色石蕊变蓝;PH试纸变色PH>7
酚酞变红
与碘水反应
变蓝
灼烧
有烧焦羽毛的气味
常见检验药品
1:PH试纸
即广范试纸。
试纸定量验液体时不能先湿润
2:石蕊试纸
红石蕊试纸:
遇碱性物质变蓝色
蓝石蕊试纸:
遇酸性物质变红
5:醋酸铅试纸
(检验气体需先湿润)
淀粉试纸 +
碘
淀粉
蓝
3:石蕊试液
4:酚酞试液
物质的检验和鉴别
物理性质
颜色
气味
密度
溶解性
......
燃烧
变色
生成沉淀
放出气体
......
化学性质
特殊颜色的物质:
①黑色粉末:
Fe3O4、CuO、MnO2、
木炭粉、铁粉...
②红色固体:
Cu、Fe2O3、HgO...
③一些离子在溶液中的颜色:
Cu2+--蓝色、 Fe3+--棕黄色、
Fe2+--浅绿色、 MnO4- --紫红色。
实验1:
NH4Cl和(NH4)2SO4各2mL,分别加入
2mLNaOH,稍加热,将先准备好的
湿润的红色石蕊试纸靠近试管口
实验步骤:
实验现象:闻气味及观察试纸颜色的变化
实验2:
实验步骤:
NH4Cl和KCl各少量(1~2)mL,各滴几滴稀HNO3,再各滴几滴Ag NO 3
实验现象:观察液体变化
实验3:
实验步骤:
(NH4)2SO4和K2SO4溶液各少量,各滴几滴稀盐酸,再各滴几滴BaCl2溶液
实验现象:观察液体变化
实验现象:
实验药品:
有刺激性气味气体产生,且该气体能使湿润的红色石蕊试纸变蓝。
NH4Cl和(NH4)2SO4中含有NH4+
实验1.
NH4Cl、 (NH4)2SO4 、NaOH
实验现象:
实验药品:
实验结论:
化学方程式:
加热
NH4Cl+NaOH===NaCl+H2O+NH3 ↑
取样(少量放在试管中)与碱液混合加热,若有能使湿润的红色石蕊试纸变蓝的气体产生,证明该试样中含有NH4+。
归纳1:NH4+ (铵盐)的检验方法:
NH3 使湿润的红色石蕊试纸变蓝
加热
NH4Cl+NaOH===NaCl+H2O+NH3 ↑
实验原理
实验2.
实验药品:
NH4Cl、KCl、稀硝酸和AgNO 3
实验现象:
实验结论:
稀硝酸的作用是什么,能用稀盐酸或稀硫酸代替吗
反应生成不溶于稀硝酸的白色沉淀
NH4Cl和KCl中含有Cl-
讨论与思考:
排除CO32-和SO32-的干扰
Ag++ Cl-= AgCl
取样并向内加入稀HNO3,再加入AgNO3溶液,若生成白色沉淀,证明该试样中含有Cl- 。
归纳2: Cl-的检验方法:
实验3:
实验药品:
(NH4)2SO4、K2SO4、稀盐酸 和BaCl2
实验现象:
反应生成不溶于稀盐酸的白色沉淀
实验结论:
硫酸铵、硫酸钾中含有SO42-
稀盐酸的作用是什么,能用稀硝酸代替吗
化学方程式:
(NH4)2SO4 + BaCl2==BaSO4 + 2NH4Cl
排除CO32-和SO32-的干扰
SO32- 硝酸 SO42-
取样并向内加稀盐酸,无沉淀生成,再加入BaCl2溶液,若生成白色沉淀,证明该试样中含有SO42-。
归纳3: SO42- (硫酸盐)的检验方法
思考:
某白色晶体可能是氯化铵,怎样证明?请写出你所需的实验药品、操作步骤、实验现象及相关化学方程式。
练习1:某溶液中含有大量的Cl-、SO42-、OH- 三
种离子,如果只取一次就能够将3种阴离子依次检
验出来,正确的实验操作顺序是:
① 滴加Mg(NO3)2溶液 ② 过滤
③ 滴加Ba(NO3)2 ④滴加AgNO3
①②③②④ 或 ③②①②④
2:如果实验室里有两瓶失去标签的试剂,它们分别是碳酸钠溶液和碳酸钾溶液,你该怎样鉴别?
4.焰色反应
金属或它们的化合物在灼烧时都会使火焰呈现出特殊的颜色,这在化学上叫做焰色反应。
一根铂丝,在酒精灯火焰上灼烧,若火焰有颜色,可将铂丝在稀盐酸中蘸一下,再灼烧至无色。用灼烧后的铂丝蘸取少许待测物,火焰中灼烧透过钴玻璃观察到不同颜色的火焰
Na 为黄色 K为紫色(透过钴玻璃观察)
除杂
洗、烧、蘸、烧
几种金属的焰色反应
Na(Na+)
K(K+)透过钴玻璃观察
Li(Li+)
用红外光谱仪来确定:物质中是否含有某些有机基团
用元素分析仪测定:物质中是否含C、H、O、N、S等元素
5. 仪器分析法:课本P21
用原子吸收光谱确定:物质中是否含有哪些金属元素
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的
试剂是( )
A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸
2、在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
A.NaOH B.Na2CO3
C.AgNO3 D.BaCl2
练习
B
A
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液做焰色反应时火焰呈黄色,则该溶液中一定有钾离子
D.验证烧碱溶液中是否含有Cl-,先加足量稀硝酸,再加入AgNO3溶液,若有白色沉淀,证明含Cl-
3、对下列实验过程的评价,正确的是
√
2、在允许加热的条件下,只用一种试剂就可以鉴别(NH4)2SO、KCl、MgCl2和Fe2(SO4)3溶液,这种试剂是( ) A.NaOH B.Na2CO3 C.AgNO3 D.BaCl2
3、以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A、先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀,溶液中一定含有大量SO
B、加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量 的CO
C、加入足量浓NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的NH
D、先加适量的盐酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-
2-
3
C
