新人教版选修4高中化学第三章 第一节 弱电解质的电离(36张PPT)
文档属性
| 名称 | 新人教版选修4高中化学第三章 第一节 弱电解质的电离(36张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-24 22:03:23 | ||
图片预览








文档简介
(共36张PPT)
弱电解质的电离
第三章
水溶液中的离子平衡
第一节
弱电解质的电离
思考:1
、什么叫电解质?试举例说明。
知识回顾:
电解质:在水溶液中或熔化状态下能够导电
的化合物。
思考:2
、什么叫非电解质?试举例说明。
非电解质:在水溶液中和熔化状态下都不能够导电的化合物。
弱电解质的电离
电解质和非电解质比较
电解质
非电解质
概念:在水溶液中或熔化状态下
在水溶液和熔化状态
能够导电的化合物。
下都不能导电的化合物。
和结构关系:大多数离子化合物
极性键或非极性键构成
强极性键共价化合物
的化合物
实例:
酸
碱
盐,H2O
大多数有机物,SO3、CO2
等
说明:溶液导电与否是由内外因共同作用的结果,内因为必须有电解质,外因在水的作用下两者缺一不可,可用下列图示表示:
电解质
电离
导电
溶液导电性强弱是由溶液中自由移动离子浓度决定。
弱电解质的电离
等浓度的盐酸、醋酸溶液中的H+浓度的大小?
醋酸和盐酸是常见的两种酸,根据你的经
验,你认为它们的电离程度有无差异?
你能设计实验验证你的猜想吗?请写出实
验方案并与大家交流。
弱电解质的电离
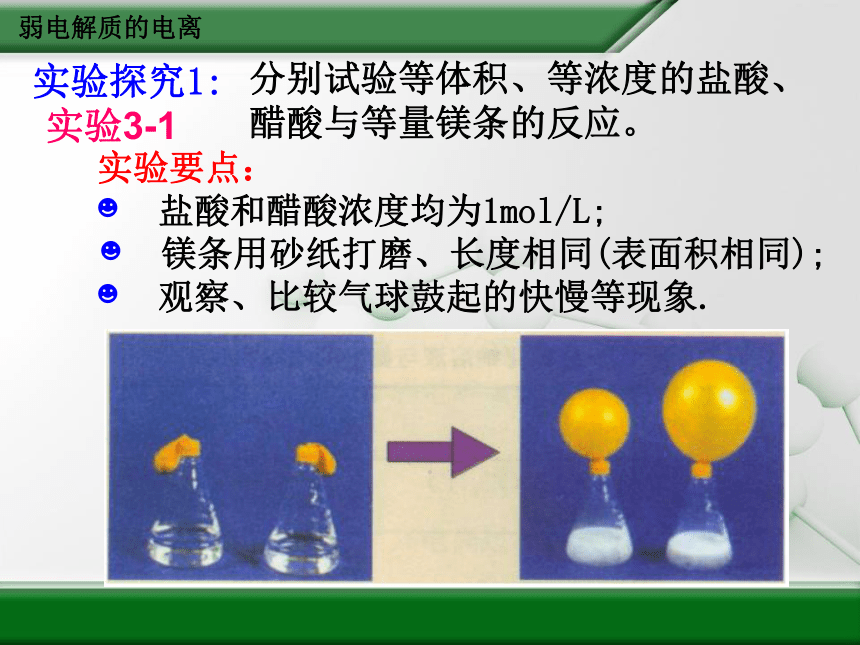
实验探究1:
分别试验等体积、等浓度的盐酸、醋酸与等量镁条的反应。
实验要点:
盐酸和醋酸浓度均为1mol/L;
镁条用砂纸打磨、长度相同(表面积相同);
观察、比较气球鼓起的快慢等现象.
实验3-1
弱电解质的电离
与镁条反应的现象
1mol/L
CH3COOH
1mol/L
HCl
对实验现象的解释
镁与等浓度的盐酸、醋酸反应
的速率,
前者快于后者。
镁与盐酸反应非常剧烈,产生大量的气泡,气球鼓起很快。
等浓度的盐酸中c(H+)比醋酸大.
镁与醋酸反应较快,产生气泡,
气球鼓起较慢。
弱电解质的电离
实验探究2:
用pH试纸测定0.1mol/L的盐酸、醋酸pH。
实验数据:pH(HCl)
=
1
pH(CH3COOH)
=
3
数据处理:
结
论:
盐酸完全电离,
电离程度(即电离度)为100%;
醋酸不完全电离,
电离程度较小,且小于100%,
即醋酸的电离是可逆的。
0.1mol/L
HCl
c(H+)
=
0.1mol/L
0.1mol/L
CH3COOH
c(H+)
=
0.001mol/L
弱电解质的电离
盐酸中存在H+、Cl-
无HCl分子
醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子
弱电解质的电离
强电解质:
包括:强酸、强碱、大多数盐类
包括:
弱酸
(如CH3COOH)、弱碱
(如NH3·H2O)
、水
HCl
=
H+
+
Cl–
能全部电离的电解质称强电解质.
不完全电离的电解质称弱电解质.
CH3COOH
H+
+CH3COO–
弱电解质:
1、概念
一、强弱电解质
弱电解质的电离
2、电离方程式的书写
强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“
”
多元弱酸分步电离,可分步书写电离方程式(一般只写第一步),多元弱碱也是分步电离,但可按一步电离写出。
NaCl
=
Na++Cl-
CH3COOH
H++CH3COO-
弱电解质的电离
请写出Na2SO4、HClO、NH3·H2O
、H2CO3、Fe(OH)3
、Al(OH)3、NaHCO3
、
NaHSO4
、Ba(OH)2在水溶液中的电离方程式。
Na2SO4
=
2Na+
+SO42-
HClO
H++ClO-
NH3·H2O
NH4++OH-
H2CO3
H++HCO3-
HCO3-
H++CO32-
Fe(OH)3
Fe3++3OH-
弱电解质的电离
Al(OH)3
Al3++3OH-
(碱式电离)
Al(OH)3
AlO2-+H++H2O(酸式电离)
NaHCO3
=
Na++HCO3-
HCO3-
H+
+CO32-
NaHSO4
=
Na+
+H+
+SO42-
Ba(OH)2
=
Ba2+
+
2OH-
弱电解质的电离
①先判断强、弱电解质,决定符号,强电解质一步电离
③多元弱碱的电离,以一步电离表示。
②多元弱酸分步电离,电离能力逐渐降低,以一级电离为主。
电离方程式的书写要点
④Al(OH)3有酸式和碱式电离。
弱电解质的电离
⑤弱酸的酸式盐的电离是分步电离,先完全电离成金属离子和酸式酸根,酸式酸根再部分电离。
⑥强酸的酸式盐在水溶液中完全电离,在稀溶液中不存在酸式酸根;而在熔融状态,则电离成金属离子和酸式酸根离子
强等号、弱可逆、多元弱酸分步写,多元弱碱一步完
弱电解质的电离
3.强电解质与弱电解质的比较
强电解质
弱电解质
相同点
电离程度
表示方法
电解质在溶液中的微粒形式
物质种类
完全电离
部分电离
离子
分子、离子
强酸、强碱、多数盐、
活泼金属氧化物
弱酸、弱碱、水
电离方程式用“
”
电离方程式用
“=”
在水溶液中或熔化状态下都能电离。
弱电解质的电离
电解质的强弱与其溶解度有何关系?
电解质的强弱与其水溶液的导电能力
有何关系?
强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离。
问题探讨
CaCO3、Fe(OH)3的溶解度都很小,CaCO3属于强电解质,而Fe(OH)3属于弱电解质;CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH
属于弱电解质。
弱电解质的电离
强弱电解质≠溶液的导电能力强弱
强弱电解质≠物质的溶解性大小
弱电解质的电离
思考与交流:
(1)当醋酸溶于水后,
V(电离)和
V(结合)
怎
样变化?
CH3COOH
CH3COO
-
+
H+
二、弱电解质的电离平衡
(2)
当V(电离)
=
V(结合)
时,可逆过程达到一
种怎样的状态?画出V~t图。
CH3COO
-
+
H+
→
CH3COOH
CH3COOH
→
CH3COO
-
+
H+
弱电解质的电离
V(速率)
t
(时间)
V电离
V结合
V电离=V结合≠
0
t1
电离平衡状态
弱电解质电离的V-t图像
弱电解质的电离
2.特征
1.定义:在一定条件(如温度、浓度)下,当电解质
分子电离成离子的速率和离子重新结合成
分子的速率相等时,
电离过程就达到了平
衡状态
―
电离平衡
动:电离平衡是一种动态平衡
定:条件不变,溶液中各分子、离子的浓
度不变,溶液里既有离子又有分子.
变:
条件改变时,电离平衡发生移动。
等:V电离
=
V结合≠0
逆:弱电解质的电离是可逆过程
弱电解质的电离
思考与交流:
根据上图及化学平衡理论,分析一元弱酸(HA)
一元弱碱(BOH)的电离平衡过程,并完成问题:
1.写出电离方程式
2.填表
0
0
最大
增大
增大
减小
不变
不变
不变
弱电解质的电离
最大
最大
0
减小
减小
增大
弱电解质的电离
小结
离子化合物
大部分的盐类
强
碱
共价化合物
强
酸
弱
酸
弱
碱
水
弱
电
解
质
强电解质
离子型氧化物
电解质
非
电
解
质
多数有机物
某些非金属氧化物
化合物
弱电解质的电离
3.影响电离平衡的条件
(1)内因:电解质本身的性质。通常电解质越弱电离程
度越小。
(2)
影响电离平衡移动的条件——外因
②温度:电离过程是吸热过程,温度升高,平衡向电离方向移动。
③浓度:溶液稀释平衡向电离方向移动
①加入试剂:加入增大弱电解质电离出离子浓度的物质,
使电离平衡向逆方向移动
加入减小弱电解质电离出离子浓度的物质,
使电离平衡向电离方向移动
电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。
弱电解质的电离
电离平衡的影响因素
CH3COOH
CH3COO-
+H+
方式
所引起的浓度变化
平衡移动
C(CH3COOH
)
C(CH3COO-)
C(H+)
加少量冰醋酸
加水稀释
加醋酸钠固体
加适量盐酸
加NaOH溶液
CH3COOH
CH3COOH
CH3COO-
H+
H+
逆方向
逆方向
增大
增大
增大
增大
增大
增大
增大
增大
减少
减少
减少
减少
减少
减少
减少
正方向
正方向
正方向
升温
——
正方向
增大
减少
增大
弱电解质的电离
三、电离常数(K)
看课本自学相关内容并思考:
(1)什么叫电离常数?
(2)怎样用电离常数比较弱电解质的相对强弱?
(3)影响电离平衡常数的因素是什么?
问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
弱电解质的电离
三、电离常数——
对于一元弱酸
HA
H++A-
Ka=
c
(
H+)
.c(
A-)
c(HA)
对于一元弱碱
BOH
B++OH-
Kb=
c
(
B+).c(
OH-
)
c(BOH)
注意:K值只随温度变化。
弱电解质的电离
探究实验室
[实验3-2]
课本P42
你能否推测CH3COOH、H3BO3、H2CO3三种弱酸的相对强弱,及其与电离常数大小的关系?
实验结论:
酸性强弱:CH3COOH﹥H2CO3﹥H3BO3
弱电解质的电离
写出H3PO4在水溶液中的电离方程式。
H3PO4
H+
+
H2PO4-
H2PO4-
H+
+
HPO42-
HPO42-
H+
+
PO43-
你推测每一步的电离程度如何变化,为什么?
多元弱酸是分步电离的,K1》K2》K3
多元弱酸的酸性由第一步电离决定。
弱电解质的电离
试根据课本中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
意义:K值越大,电离程度越大,相应酸
(或碱)的酸(或碱)性越强。
弱电解质的电离
有关电离常数的简单计算:
课本p44第4题
解析:设电离平衡时H+物质的量浓度为x
CH3COOH
CH3COO-
+
H+
c(起始)
c(平衡)
因醋酸的电离程度很小,
故0.010-x≈0.010
0.010
0
0
0.010-x
x
x
即
x2/0.010=1.75×10-5
x=4.2×10-4mol/L
K=
=1.75×10-5
c(H+)
·c(CH3COO-)
c(CH3COOH)
x2
0.010-x
=
弱电解质的电离
知识网络
弱电解质的电离
弱电解质
电离平衡
电离
特点
1)部分电离
2)存在电解质分子和阴阳离子
3)电离方程式用“
”连接
举例:弱酸、弱碱、水
特点:逆、等、动、定、变
影响因素
温度
浓度
同离子效应
平衡常数K只与温度有关
弱电解质的电离
1、下列电解质中,
①
NaCl、
②
NaOH,
③
NH3·H2O、
④
CH3COOH、
⑤
BaSO4、
⑥
AgCl
、
⑦
Na2O、
⑧
K2O,
⑨
H2O
哪些是强电解质,那些是弱电解质?
①
②
⑤
⑥
⑦
⑧
弱电解质:
③
④
⑨
强电解质:
弱电解质的电离
练习
2、讨论以下两种说法是否正确,并说明原因:
①石墨、铜、铝合金都能导电,所以它们都是
电解质。
②强电解质溶液的导电能力一定强于弱电解
质溶液的导电能力。
①电解质的研究对象是化合物,所以单质、
混合物都不是电解质。
②导电能力和溶液中离子浓度有关,而强弱电
解质是指电离能力的。
弱电解质的电离
3、有物质的量浓度相同、体积相等的三种酸:a、盐酸
b、硫酸
c、醋酸,同时加入足量的锌,则开始反应时速率________。(用<、=、>
表示)
b>a>c
4、把0.05
mol
NaOH固体分别加入100
mL下列液体中,溶液的导电性变化不大的是(
)
A.自来水
B.
0.5
mol/L
NH4Cl溶液
C.
0.5
mol/L
醋酸
D.
0.5
mol/L
盐酸
BD
弱电解质的电离
5、写出下列物质的电离方程式
(1)
HClO
(2)
KHSO4
(3)
CaCO3
(4)
Cu(OH)2
H
+
+ClO-
=K
+
+H
+
+SO42-
=
Ca2+
+CO32-
Cu
2+
+2OH-
弱电解质的电离
弱电解质的电离
第三章
水溶液中的离子平衡
第一节
弱电解质的电离
思考:1
、什么叫电解质?试举例说明。
知识回顾:
电解质:在水溶液中或熔化状态下能够导电
的化合物。
思考:2
、什么叫非电解质?试举例说明。
非电解质:在水溶液中和熔化状态下都不能够导电的化合物。
弱电解质的电离
电解质和非电解质比较
电解质
非电解质
概念:在水溶液中或熔化状态下
在水溶液和熔化状态
能够导电的化合物。
下都不能导电的化合物。
和结构关系:大多数离子化合物
极性键或非极性键构成
强极性键共价化合物
的化合物
实例:
酸
碱
盐,H2O
大多数有机物,SO3、CO2
等
说明:溶液导电与否是由内外因共同作用的结果,内因为必须有电解质,外因在水的作用下两者缺一不可,可用下列图示表示:
电解质
电离
导电
溶液导电性强弱是由溶液中自由移动离子浓度决定。
弱电解质的电离
等浓度的盐酸、醋酸溶液中的H+浓度的大小?
醋酸和盐酸是常见的两种酸,根据你的经
验,你认为它们的电离程度有无差异?
你能设计实验验证你的猜想吗?请写出实
验方案并与大家交流。
弱电解质的电离
实验探究1:
分别试验等体积、等浓度的盐酸、醋酸与等量镁条的反应。
实验要点:
盐酸和醋酸浓度均为1mol/L;
镁条用砂纸打磨、长度相同(表面积相同);
观察、比较气球鼓起的快慢等现象.
实验3-1
弱电解质的电离
与镁条反应的现象
1mol/L
CH3COOH
1mol/L
HCl
对实验现象的解释
镁与等浓度的盐酸、醋酸反应
的速率,
前者快于后者。
镁与盐酸反应非常剧烈,产生大量的气泡,气球鼓起很快。
等浓度的盐酸中c(H+)比醋酸大.
镁与醋酸反应较快,产生气泡,
气球鼓起较慢。
弱电解质的电离
实验探究2:
用pH试纸测定0.1mol/L的盐酸、醋酸pH。
实验数据:pH(HCl)
=
1
pH(CH3COOH)
=
3
数据处理:
结
论:
盐酸完全电离,
电离程度(即电离度)为100%;
醋酸不完全电离,
电离程度较小,且小于100%,
即醋酸的电离是可逆的。
0.1mol/L
HCl
c(H+)
=
0.1mol/L
0.1mol/L
CH3COOH
c(H+)
=
0.001mol/L
弱电解质的电离
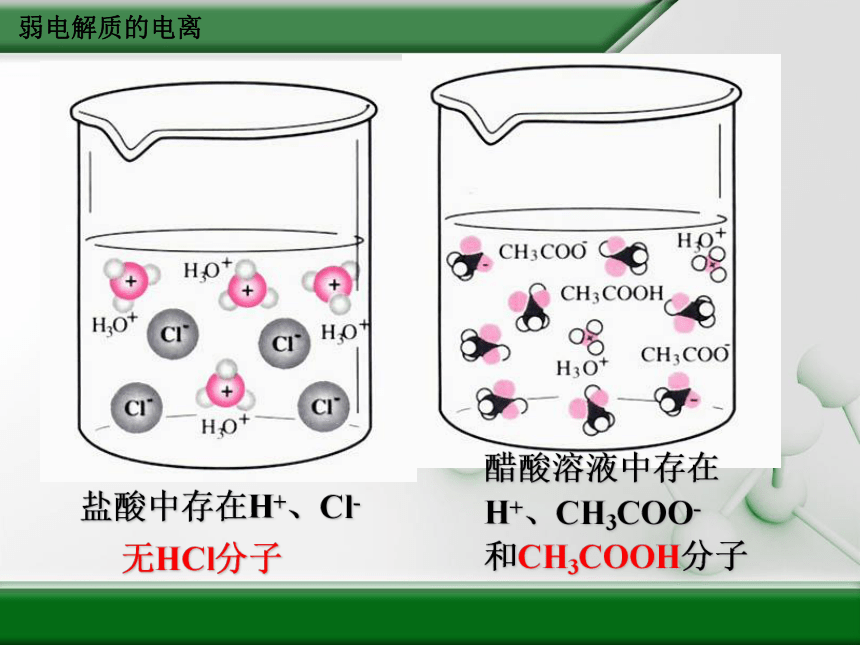
盐酸中存在H+、Cl-
无HCl分子
醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子
弱电解质的电离
强电解质:
包括:强酸、强碱、大多数盐类
包括:
弱酸
(如CH3COOH)、弱碱
(如NH3·H2O)
、水
HCl
=
H+
+
Cl–
能全部电离的电解质称强电解质.
不完全电离的电解质称弱电解质.
CH3COOH
H+
+CH3COO–
弱电解质:
1、概念
一、强弱电解质
弱电解质的电离
2、电离方程式的书写
强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“
”
多元弱酸分步电离,可分步书写电离方程式(一般只写第一步),多元弱碱也是分步电离,但可按一步电离写出。
NaCl
=
Na++Cl-
CH3COOH
H++CH3COO-
弱电解质的电离
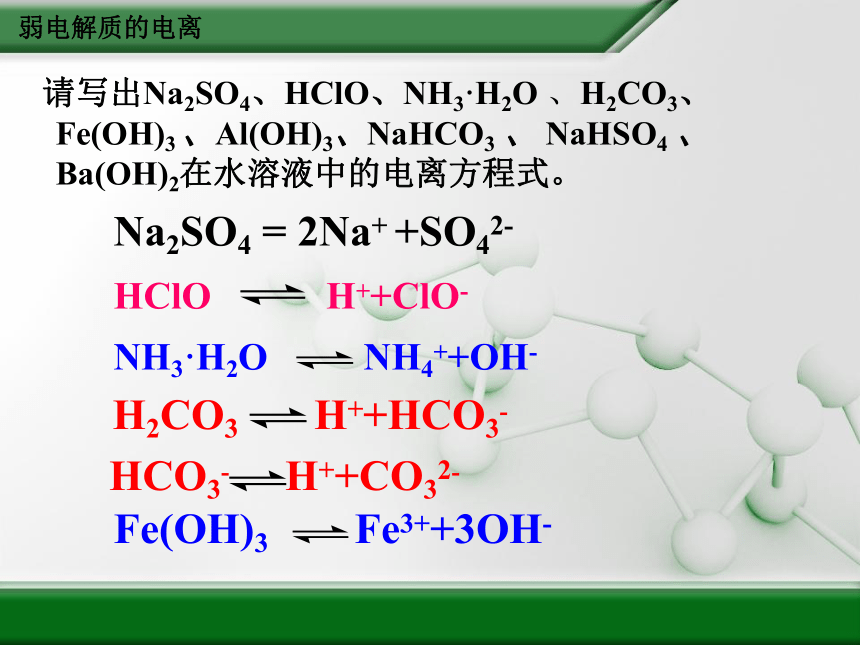
请写出Na2SO4、HClO、NH3·H2O
、H2CO3、Fe(OH)3
、Al(OH)3、NaHCO3
、
NaHSO4
、Ba(OH)2在水溶液中的电离方程式。
Na2SO4
=
2Na+
+SO42-
HClO
H++ClO-
NH3·H2O
NH4++OH-
H2CO3
H++HCO3-
HCO3-
H++CO32-
Fe(OH)3
Fe3++3OH-
弱电解质的电离
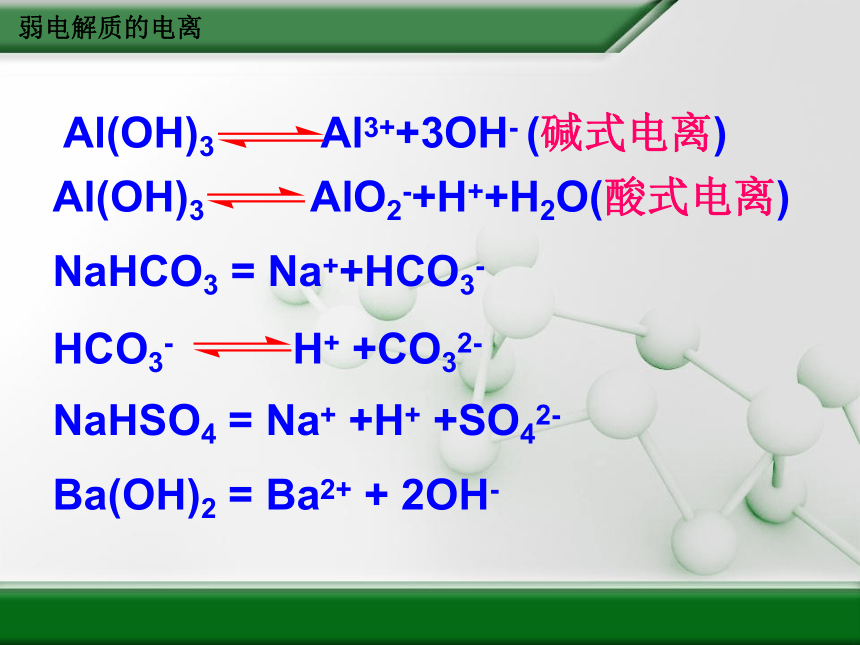
Al(OH)3
Al3++3OH-
(碱式电离)
Al(OH)3
AlO2-+H++H2O(酸式电离)
NaHCO3
=
Na++HCO3-
HCO3-
H+
+CO32-
NaHSO4
=
Na+
+H+
+SO42-
Ba(OH)2
=
Ba2+
+
2OH-
弱电解质的电离
①先判断强、弱电解质,决定符号,强电解质一步电离
③多元弱碱的电离,以一步电离表示。
②多元弱酸分步电离,电离能力逐渐降低,以一级电离为主。
电离方程式的书写要点
④Al(OH)3有酸式和碱式电离。
弱电解质的电离
⑤弱酸的酸式盐的电离是分步电离,先完全电离成金属离子和酸式酸根,酸式酸根再部分电离。
⑥强酸的酸式盐在水溶液中完全电离,在稀溶液中不存在酸式酸根;而在熔融状态,则电离成金属离子和酸式酸根离子
强等号、弱可逆、多元弱酸分步写,多元弱碱一步完
弱电解质的电离
3.强电解质与弱电解质的比较
强电解质
弱电解质
相同点
电离程度
表示方法
电解质在溶液中的微粒形式
物质种类
完全电离
部分电离
离子
分子、离子
强酸、强碱、多数盐、
活泼金属氧化物
弱酸、弱碱、水
电离方程式用“
”
电离方程式用
“=”
在水溶液中或熔化状态下都能电离。
弱电解质的电离
电解质的强弱与其溶解度有何关系?
电解质的强弱与其水溶液的导电能力
有何关系?
强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离。
问题探讨
CaCO3、Fe(OH)3的溶解度都很小,CaCO3属于强电解质,而Fe(OH)3属于弱电解质;CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH
属于弱电解质。
弱电解质的电离
强弱电解质≠溶液的导电能力强弱
强弱电解质≠物质的溶解性大小
弱电解质的电离
思考与交流:
(1)当醋酸溶于水后,
V(电离)和
V(结合)
怎
样变化?
CH3COOH
CH3COO
-
+
H+
二、弱电解质的电离平衡
(2)
当V(电离)
=
V(结合)
时,可逆过程达到一
种怎样的状态?画出V~t图。
CH3COO
-
+
H+
→
CH3COOH
CH3COOH
→
CH3COO
-
+
H+
弱电解质的电离
V(速率)
t
(时间)
V电离
V结合
V电离=V结合≠
0
t1
电离平衡状态
弱电解质电离的V-t图像
弱电解质的电离
2.特征
1.定义:在一定条件(如温度、浓度)下,当电解质
分子电离成离子的速率和离子重新结合成
分子的速率相等时,
电离过程就达到了平
衡状态
―
电离平衡
动:电离平衡是一种动态平衡
定:条件不变,溶液中各分子、离子的浓
度不变,溶液里既有离子又有分子.
变:
条件改变时,电离平衡发生移动。
等:V电离
=
V结合≠0
逆:弱电解质的电离是可逆过程
弱电解质的电离
思考与交流:
根据上图及化学平衡理论,分析一元弱酸(HA)
一元弱碱(BOH)的电离平衡过程,并完成问题:
1.写出电离方程式
2.填表
0
0
最大
增大
增大
减小
不变
不变
不变
弱电解质的电离
最大
最大
0
减小
减小
增大
弱电解质的电离
小结
离子化合物
大部分的盐类
强
碱
共价化合物
强
酸
弱
酸
弱
碱
水
弱
电
解
质
强电解质
离子型氧化物
电解质
非
电
解
质
多数有机物
某些非金属氧化物
化合物
弱电解质的电离
3.影响电离平衡的条件
(1)内因:电解质本身的性质。通常电解质越弱电离程
度越小。
(2)
影响电离平衡移动的条件——外因
②温度:电离过程是吸热过程,温度升高,平衡向电离方向移动。
③浓度:溶液稀释平衡向电离方向移动
①加入试剂:加入增大弱电解质电离出离子浓度的物质,
使电离平衡向逆方向移动
加入减小弱电解质电离出离子浓度的物质,
使电离平衡向电离方向移动
电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。
弱电解质的电离
电离平衡的影响因素
CH3COOH
CH3COO-
+H+
方式
所引起的浓度变化
平衡移动
C(CH3COOH
)
C(CH3COO-)
C(H+)
加少量冰醋酸
加水稀释
加醋酸钠固体
加适量盐酸
加NaOH溶液
CH3COOH
CH3COOH
CH3COO-
H+
H+
逆方向
逆方向
增大
增大
增大
增大
增大
增大
增大
增大
减少
减少
减少
减少
减少
减少
减少
正方向
正方向
正方向
升温
——
正方向
增大
减少
增大
弱电解质的电离
三、电离常数(K)
看课本自学相关内容并思考:
(1)什么叫电离常数?
(2)怎样用电离常数比较弱电解质的相对强弱?
(3)影响电离平衡常数的因素是什么?
问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
弱电解质的电离
三、电离常数——
对于一元弱酸
HA
H++A-
Ka=
c
(
H+)
.c(
A-)
c(HA)
对于一元弱碱
BOH
B++OH-
Kb=
c
(
B+).c(
OH-
)
c(BOH)
注意:K值只随温度变化。
弱电解质的电离
探究实验室
[实验3-2]
课本P42
你能否推测CH3COOH、H3BO3、H2CO3三种弱酸的相对强弱,及其与电离常数大小的关系?
实验结论:
酸性强弱:CH3COOH﹥H2CO3﹥H3BO3
弱电解质的电离
写出H3PO4在水溶液中的电离方程式。
H3PO4
H+
+
H2PO4-
H2PO4-
H+
+
HPO42-
HPO42-
H+
+
PO43-
你推测每一步的电离程度如何变化,为什么?
多元弱酸是分步电离的,K1》K2》K3
多元弱酸的酸性由第一步电离决定。
弱电解质的电离
试根据课本中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
意义:K值越大,电离程度越大,相应酸
(或碱)的酸(或碱)性越强。
弱电解质的电离
有关电离常数的简单计算:
课本p44第4题
解析:设电离平衡时H+物质的量浓度为x
CH3COOH
CH3COO-
+
H+
c(起始)
c(平衡)
因醋酸的电离程度很小,
故0.010-x≈0.010
0.010
0
0
0.010-x
x
x
即
x2/0.010=1.75×10-5
x=4.2×10-4mol/L
K=
=1.75×10-5
c(H+)
·c(CH3COO-)
c(CH3COOH)
x2
0.010-x
=
弱电解质的电离
知识网络
弱电解质的电离
弱电解质
电离平衡
电离
特点
1)部分电离
2)存在电解质分子和阴阳离子
3)电离方程式用“
”连接
举例:弱酸、弱碱、水
特点:逆、等、动、定、变
影响因素
温度
浓度
同离子效应
平衡常数K只与温度有关
弱电解质的电离
1、下列电解质中,
①
NaCl、
②
NaOH,
③
NH3·H2O、
④
CH3COOH、
⑤
BaSO4、
⑥
AgCl
、
⑦
Na2O、
⑧
K2O,
⑨
H2O
哪些是强电解质,那些是弱电解质?
①
②
⑤
⑥
⑦
⑧
弱电解质:
③
④
⑨
强电解质:
弱电解质的电离
练习
2、讨论以下两种说法是否正确,并说明原因:
①石墨、铜、铝合金都能导电,所以它们都是
电解质。
②强电解质溶液的导电能力一定强于弱电解
质溶液的导电能力。
①电解质的研究对象是化合物,所以单质、
混合物都不是电解质。
②导电能力和溶液中离子浓度有关,而强弱电
解质是指电离能力的。
弱电解质的电离
3、有物质的量浓度相同、体积相等的三种酸:a、盐酸
b、硫酸
c、醋酸,同时加入足量的锌,则开始反应时速率________。(用<、=、>
表示)
b>a>c
4、把0.05
mol
NaOH固体分别加入100
mL下列液体中,溶液的导电性变化不大的是(
)
A.自来水
B.
0.5
mol/L
NH4Cl溶液
C.
0.5
mol/L
醋酸
D.
0.5
mol/L
盐酸
BD
弱电解质的电离
5、写出下列物质的电离方程式
(1)
HClO
(2)
KHSO4
(3)
CaCO3
(4)
Cu(OH)2
H
+
+ClO-
=K
+
+H
+
+SO42-
=
Ca2+
+CO32-
Cu
2+
+2OH-
弱电解质的电离
