2020-2021学年上学期高一化学(苏教版2019必修第一册)专题3(基础卷)(含答案)
文档属性
| 名称 | 2020-2021学年上学期高一化学(苏教版2019必修第一册)专题3(基础卷)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 225.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-24 16:46:53 | ||
图片预览



文档简介
2020-2021学年上学期高一化学(苏教版2019必修第一册)专题3(基础卷)
单元检测(基础卷)
一、单选题
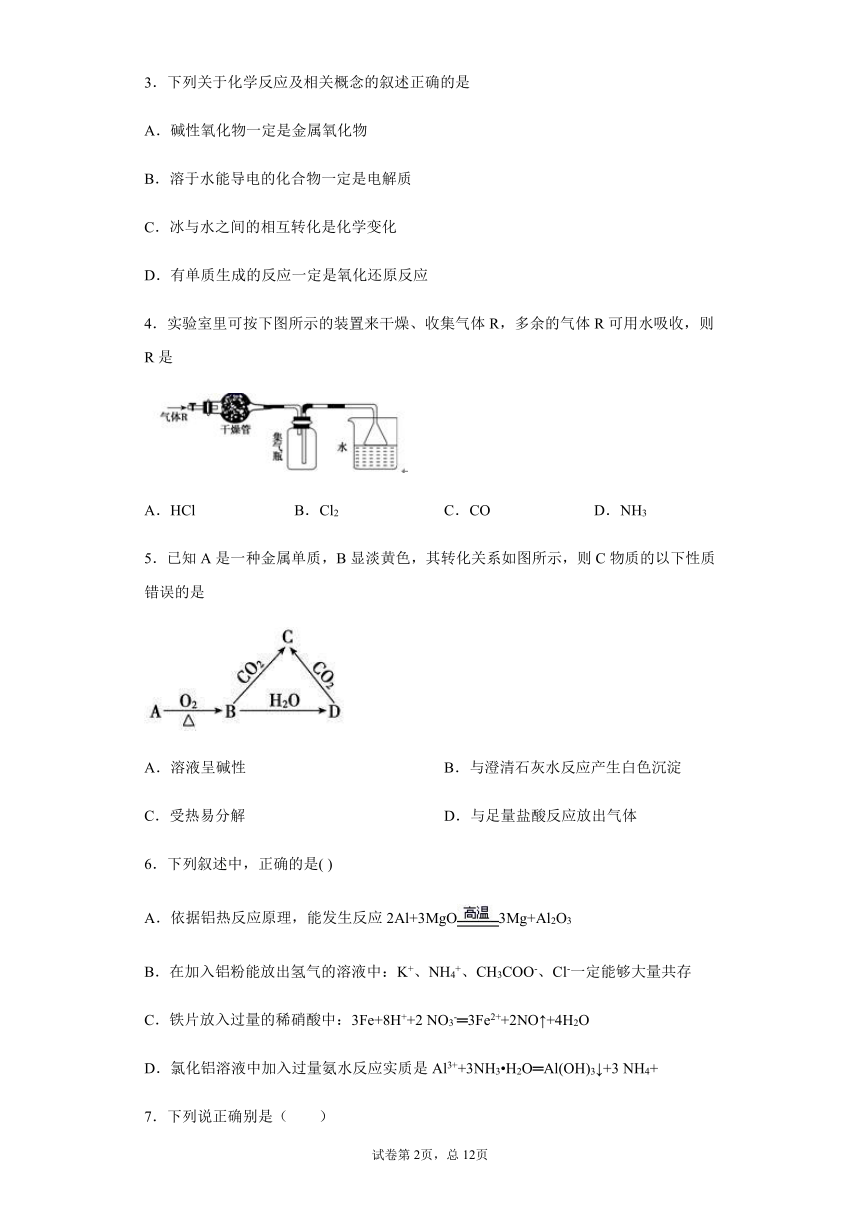
1.“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是( )
①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①②④ D.①③④
2.下列操作错误的是
①给烧瓶加热必须使用石棉网
②制取蒸馏水的装置必须要插入温度计
③分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗颈上的小孔
④容量瓶需要干燥后才能使用
⑤实验室制取氯气时,为了防止环境污染,多余的氯气用氢氧化钙溶液吸收
A.①②③ B.③④⑤ C.②④⑤ D.③④⑤
3.下列关于化学反应及相关概念的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.溶于水能导电的化合物一定是电解质
C.冰与水之间的相互转化是化学变化
D.有单质生成的反应一定是氧化还原反应
4.实验室里可按下图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
A.HCl B.Cl2 C.CO D.NH3
5.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C物质的以下性质错误的是
A.溶液呈碱性 B.与澄清石灰水反应产生白色沉淀
C.受热易分解 D.与足量盐酸反应放出气体
6.下列叙述中,正确的是( )
A.依据铝热反应原理,能发生反应2Al+3MgO3Mg+Al2O3
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、CH3COO-、Cl-一定能够大量共存
C.铁片放入过量的稀硝酸中:3Fe+8H++2 NO3-═3Fe2++2NO↑+4H2O
D.氯化铝溶液中加入过量氨水反应实质是Al3++3NH3 H2O═Al(OH)3↓+3 NH4+
7.下列说正确别是( )
A.将氯化氢溶于水形成溶液得到的盐酸溶液
B.C70的摩尔质量为840
C.做焰色反应后,铂丝用稀硫酸洗,再燃烧到无色
D.蒸发结晶时,当加热到有大量固体出现时停止加热,用余热蒸干
8.化学与社会、生活密切相关。下列现象或事实的解释不正确的是( )
选项 现象或事实 化学解释
A Fe3O4用于人民币票面文字等处的油墨 Fe3O4是一种红棕色物质
B 祖国七十华诞焰火五彩缤纷 金属元素的焰色反应
C 现代旧房拆除定向爆破用铝热剂 铝热反应放热使建筑物的钢筋熔化
D 金属焊接前用NH4Cl溶液处理焊接处 NH4Cl溶液呈弱酸性
A.A B.B. C.C D.D
9.用化学用语解释相关现象正确的是( )
A.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
B.常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2OH3O++F-
C.KHSO4在熔融状态下可导电:KHSO4 = K++H++SO42-
D.BaSO4的水溶液导电性极弱:BaSO4Ba2++SO42-
10.1820年,德贝莱纳用MnO2催化KClO3分解制O2发现制得的氧气有异常气味,将该气体通过淀粉碘化钾溶液,溶液变蓝。则所制得的氧气中可能混有
A.Cl2 B.Br2 C.I2 D.HCl
11.某化肥厂排出的废水中可能含有、、、、、、,化学兴趣小组为检测其中的离子进行了下列实验,具体流程如图所示:
下列说法不正确的是
A.该废水遇KSCN溶液显红色
B.不能确定是否存在
C.的物质的最浓度不小于
D.实验室吸收气体a的装置可以为
12.中华文化源远流长,如本草图经中曾有对青矾的描述:“形似朴硝而绿色,取此物置于铁板上,聚碳,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金升者是真也。”对于文中描述,下列说法正确的是
A.朴硝既不属于电解质也不属于非电解质
B.青矾的成分为
C.文中使用了蒸发结晶的分离方法
D.文中的反应涉及了氧化还原反应
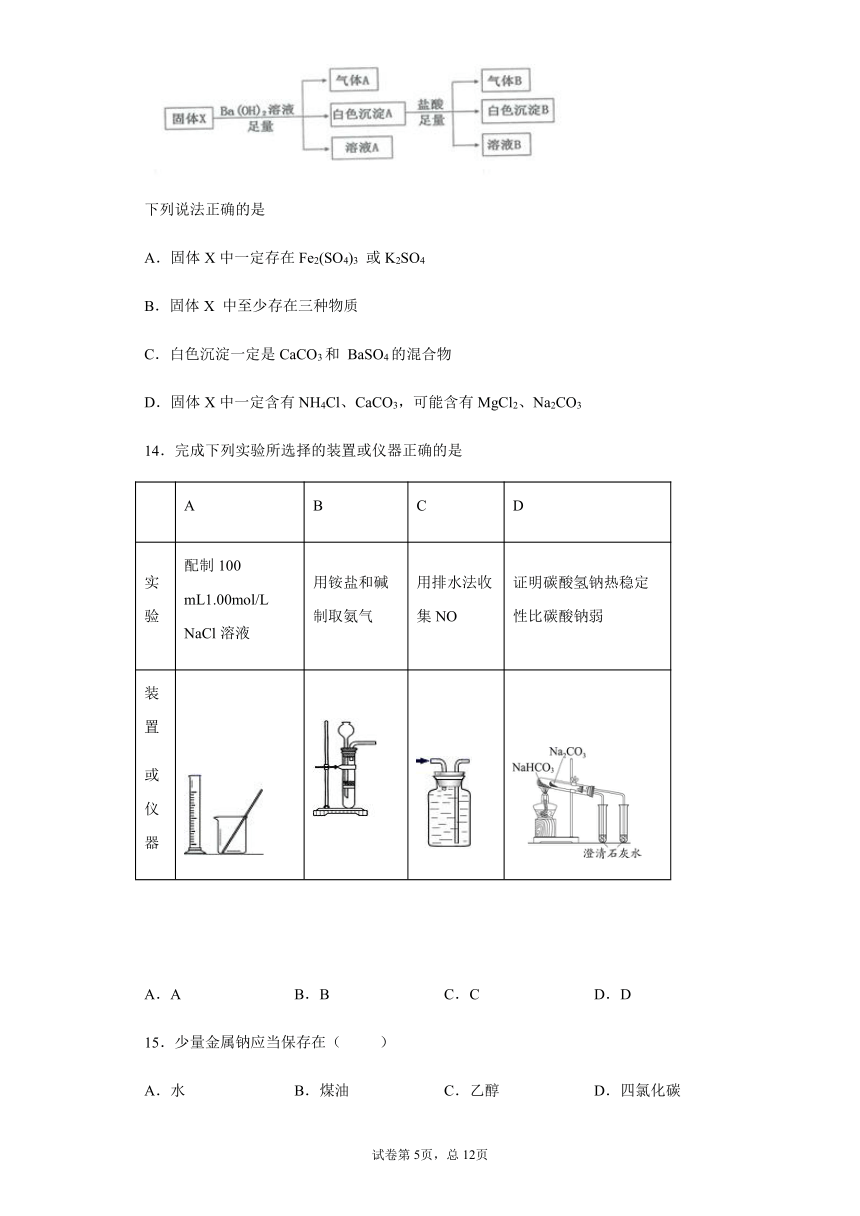
13.现有一份由含有Na2CO3、Fe2(SO4)3、K2SO4、MgCl2、CaCO3、NH4Cl中的某几种物质组成的固体混合物X。某化学课外小组取样品进行了如图实验:
下列说法正确的是
A.固体X中一定存在Fe2(SO4)3 或K2SO4
B.固体X 中至少存在三种物质
C.白色沉淀一定是CaCO3和 BaSO4的混合物
D.固体X中一定含有NH4Cl、CaCO3,可能含有MgCl2、Na2CO3
14.完成下列实验所选择的装置或仪器正确的是
A B C D
实验 配制100 mL1.00mol/L NaCl溶液 用铵盐和碱制取氨气 用排水法收集NO 证明碳酸氢钠热稳定性比碳酸钠弱
装置 或仪器
A.A B.B C.C D.D
15.少量金属钠应当保存在( )
A.水 B.煤油 C.乙醇 D.四氯化碳
16.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片,振荡,得到橙色溶液,气体颜色消失,再移走玻璃片后,瓶中气体又变为红棕色,该气体可能是下列混合气体中的( )
A.N2、NO2、Br2
B.NO2、NO、N2
C.NO2、O2、NO
D.NO2、O2、Br2
17.下列各组物质相互作用时,生成物不随反应条件或反应物的量变化而变化的是( )
A.Na和 B.NaOH和 C.和NaOH D.和HCl
18.对于一个反应可以从多个角度认识。下列关于盐酸与NaOH溶液反应的说法不正确的是
A.属于复分解反应 B.属于离子反应
C.属于中和反应 D.属于氧化还原反应
19.下列实验操作、现象及结论均正确的是( )
选项 操作及现象 结论
A 加热钠块,钠先熔化成光亮的小球,燃烧时火焰为黄色,产生白色固体 钠可与空气中的氧气反应
B 在空气中久置的铝条放入NaOH溶液中,立刻产生大量气泡,铝条逐渐变细且逐渐发热 Al和Al2O3均可与NaOH反应
C 淀粉溶液与稀硫酸混合加热后,滴加碘水,溶液变为蓝色 淀粉溶液未发生水解
D 蔗糖溶液与稀硫酸混合加热后,先加入足量NaOH溶液,再加入新制Cu(OH)2,加热,产生砖红色沉淀 蔗糖的水解产物含有醛基
A.A B.B C.C D.D
20.下列各组物质,不需要经过化学变化就能够从海水中获得的是( )
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
二、多选题
21.下列离子方程式书写正确的是( )
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B.稀硝酸中加入少量碳酸亚铁:FeCO3+2H+=Fe2++CO2↑+H2O
C.硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H++OH-=H2O
D.饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO32-+CO2+H2O=2NaHCO3↓
22.将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I。下列对溶液I中溶质分析正确的是
A.溶液I中含有溶质的组合可能有4种
B.已知V和a的具体数值可以确定溶液I的溶质
C.已知溶液I中溶质的种类和a值,一定能求出V
D.向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克。由W和V的值可确定溶液I的溶质
三、有机推断题
23.甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种.为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生3.36L气体(标准状况);
②向另一份溶液中加入0.4mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得43g沉淀及滤液;
③向上述滤液中加入1mol/L AgNO3溶液450mL,恰好可完全反应;
④向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清石灰水中,得到沉淀C;
据此,请回答下列问题(用相应的离子符号表示):
(1)实验④中得到沉淀C的质量为________;
(2)甲溶液中一定不存在的离子是_________;可能存在的离子是__________。
(3)甲溶液一定存在的离子中,物质的量最大的离子是_____;物质的量最小的离子是______,此物质的量最小的离子其物质的量为________。
四、填空题
24.(1)向某溶液中加入KSCN溶液无明显现象,再滴入数滴氯水后,溶液立即变成红色,则原溶液中一定含有________离子,要除去FeCl3溶液中少量的氯化亚铁,可行的办法是________(填字母)。
A.加入铜粉 B.加入铁粉 C.通入氯气 D.加入KSCN溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 。
(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 。
(3)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是________(填字母)。
A.铜粉 B.氯气 C.铁粉 D.KSCN溶液
(4)向沸水中逐滴滴加1 mol·L-1FeCl3溶液至液体呈透明的红褐色,该分散系中微粒直径的范围是____nm,区别该液体和FeCl3溶液可用 方法。
25.“生活无处不化学”,请你回答下列问题。
(1)厨房中的调味品,①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)。主要成分中具有碱性的是_____(填序号,下同);属于盐类的是______;相互间能发生反应的是________。
(2)食盐不慎洒落在天然气的火焰上,观察的现象是_______________,该变化称为______反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是__________________。
(4)家庭中常用“84”消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。
“消毒液”与“洁厕灵”同时使用会产生有毒的氯气,写出该反应的离子方程式:____________________________________________。
(5)纯碱(Na2CO3)、小苏打(NaHCO3)广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程中,小苏打发生分解反应,该反应的化学方程式是_____________________________________;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的离子方程式是__________________________________________。
(6)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:______________。
26.(1)氢氧化铁受热分解化学方程式:___。
(2)Al(OH)3与NaOH溶液反应的离子方程式:___。
(3)铁溶于盐酸的离子方程式:___。
(4)Na2O2与CO2反应的化学方程式:___。
(5)乙烯的结构式:___。
(6)乙烯的电子式:___。
(7)Na2O2的电子式:___。
五、计算题
27.将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进行如图实验,进行如图实验(Na2CO3受热不分).
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是______.
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是______克.
(3)B样品中含有结晶水的质量是______克.
(4)化学式Na2CO3·nH2O中n的数值是. ______
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是______(精确到0.01%)
28.将物质的量浓度相等的盐酸和硫酸混合,取100mL该混合溶液,加入10mL 3.0mol/L的溶液时,溶液显中性,请计算:
(1)原混合液中的物质的量浓度为____________.
(2)原混合中硫酸的物质的量为____________mol.
(3)当加入的体积为7.5mL时,产生的沉淀质量为____________g.
六、实验题
29.向炙热的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为___,B中加入的试剂是___,D中盛放的试剂____。
(2)制取无水氯化亚铁的实验中,装置A用来制取____,尾气的成分是___,仍用D装置进行尾气处理,存在的问题是____、____。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,原因可能是____,欲制得纯净的FeCl2,在实验操作中应先___,再____。
30.如下图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。
提示:实验室中所用的少量氯气可以用下述原理制取:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
(1)氧化剂与还原剂物质的量之比为____________ ,氧化产物为____________。
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是(工业上用此原理制取漂白粉。)______________________,
(4)b处离子方程式是_______________________________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4 用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:__________________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
_____MnO4-+______H2C2O4+______ H+=____Mn2++_____CO2↑+_____ ________
试卷第12页,总12页
试卷第11页,总12页
参考答案
1.C
2.C
3.A
4.D
5.C
6.D
7.D
8.A
9.B
10.A
11.B
12.D
13.B
14.C
15.B
16.A
17.C
18.D
19.D
20.D
21.CD
22.AB
23.10g Ca2+、Cu2+ NO3- K+ Cl- 0.1mol
24.(1) Fe2+C 2Fe2++Cl2=2Fe3++2Cl- (2)2Fe3++Cu=2Fe2++Cu2+ (3)C (4) 1~100
丁达尔效应
25.② ①② ②③ 发出黄色火焰 焰色反应 3Fe+4H2O(g) Fe3O4+4H2 ClO-+Cl-+2H+=Cl2↑+H2O 2NaHCO3 Na2CO3+H2O+CO2↑ HCO+H+=CO2↑+H2O 2Na2O2+2CO2=2Na2CO3+O2
26.2Fe(OH)3Fe2O3+3H2O Al(OH)3+OH-=AlO2-+2H2O Fe+2H+=Fe2++H ↑ 2Na2O2+2CO2=2Na2CO3 + O2
27.过滤 5.3 9 10 4.26%
28.0.6 0.02 4.66
29.MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O 浓硫酸 NaOH溶液 HCl HCl和H2 发生倒吸 可燃性气体H2不能被吸收 氯化亚铁被装置内的氧气氧化 通入HCl气体一段时间(排出装置内空气) 点燃C处酒精灯
30.1:5 Cl2 0.2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Fe2++Cl2=2Fe3++2Cl-; CaC2O4(s) + 2H+(aq) + SO42 (aq) CaSO4(s) + H2C2O4(aq) 2 5 6 2 10 8 H2O
答案第2页,总2页
答案第1页,总2页
单元检测(基础卷)
一、单选题
1.“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是( )
①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①②④ D.①③④
2.下列操作错误的是
①给烧瓶加热必须使用石棉网
②制取蒸馏水的装置必须要插入温度计
③分液时要将分液漏斗上口玻璃塞打开,或使塞上凹槽对准漏斗颈上的小孔
④容量瓶需要干燥后才能使用
⑤实验室制取氯气时,为了防止环境污染,多余的氯气用氢氧化钙溶液吸收
A.①②③ B.③④⑤ C.②④⑤ D.③④⑤
3.下列关于化学反应及相关概念的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.溶于水能导电的化合物一定是电解质
C.冰与水之间的相互转化是化学变化
D.有单质生成的反应一定是氧化还原反应
4.实验室里可按下图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
A.HCl B.Cl2 C.CO D.NH3
5.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C物质的以下性质错误的是
A.溶液呈碱性 B.与澄清石灰水反应产生白色沉淀
C.受热易分解 D.与足量盐酸反应放出气体
6.下列叙述中,正确的是( )
A.依据铝热反应原理,能发生反应2Al+3MgO3Mg+Al2O3
B.在加入铝粉能放出氢气的溶液中:K+、NH4+、CH3COO-、Cl-一定能够大量共存
C.铁片放入过量的稀硝酸中:3Fe+8H++2 NO3-═3Fe2++2NO↑+4H2O
D.氯化铝溶液中加入过量氨水反应实质是Al3++3NH3 H2O═Al(OH)3↓+3 NH4+
7.下列说正确别是( )
A.将氯化氢溶于水形成溶液得到的盐酸溶液
B.C70的摩尔质量为840
C.做焰色反应后,铂丝用稀硫酸洗,再燃烧到无色
D.蒸发结晶时,当加热到有大量固体出现时停止加热,用余热蒸干
8.化学与社会、生活密切相关。下列现象或事实的解释不正确的是( )
选项 现象或事实 化学解释
A Fe3O4用于人民币票面文字等处的油墨 Fe3O4是一种红棕色物质
B 祖国七十华诞焰火五彩缤纷 金属元素的焰色反应
C 现代旧房拆除定向爆破用铝热剂 铝热反应放热使建筑物的钢筋熔化
D 金属焊接前用NH4Cl溶液处理焊接处 NH4Cl溶液呈弱酸性
A.A B.B. C.C D.D
9.用化学用语解释相关现象正确的是( )
A.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
B.常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2OH3O++F-
C.KHSO4在熔融状态下可导电:KHSO4 = K++H++SO42-
D.BaSO4的水溶液导电性极弱:BaSO4Ba2++SO42-
10.1820年,德贝莱纳用MnO2催化KClO3分解制O2发现制得的氧气有异常气味,将该气体通过淀粉碘化钾溶液,溶液变蓝。则所制得的氧气中可能混有
A.Cl2 B.Br2 C.I2 D.HCl
11.某化肥厂排出的废水中可能含有、、、、、、,化学兴趣小组为检测其中的离子进行了下列实验,具体流程如图所示:
下列说法不正确的是
A.该废水遇KSCN溶液显红色
B.不能确定是否存在
C.的物质的最浓度不小于
D.实验室吸收气体a的装置可以为
12.中华文化源远流长,如本草图经中曾有对青矾的描述:“形似朴硝而绿色,取此物置于铁板上,聚碳,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金升者是真也。”对于文中描述,下列说法正确的是
A.朴硝既不属于电解质也不属于非电解质
B.青矾的成分为
C.文中使用了蒸发结晶的分离方法
D.文中的反应涉及了氧化还原反应
13.现有一份由含有Na2CO3、Fe2(SO4)3、K2SO4、MgCl2、CaCO3、NH4Cl中的某几种物质组成的固体混合物X。某化学课外小组取样品进行了如图实验:
下列说法正确的是
A.固体X中一定存在Fe2(SO4)3 或K2SO4
B.固体X 中至少存在三种物质
C.白色沉淀一定是CaCO3和 BaSO4的混合物
D.固体X中一定含有NH4Cl、CaCO3,可能含有MgCl2、Na2CO3
14.完成下列实验所选择的装置或仪器正确的是
A B C D
实验 配制100 mL1.00mol/L NaCl溶液 用铵盐和碱制取氨气 用排水法收集NO 证明碳酸氢钠热稳定性比碳酸钠弱
装置 或仪器
A.A B.B C.C D.D
15.少量金属钠应当保存在( )
A.水 B.煤油 C.乙醇 D.四氯化碳
16.某集气瓶中的气体呈红棕色,加入足量水,盖上玻璃片,振荡,得到橙色溶液,气体颜色消失,再移走玻璃片后,瓶中气体又变为红棕色,该气体可能是下列混合气体中的( )
A.N2、NO2、Br2
B.NO2、NO、N2
C.NO2、O2、NO
D.NO2、O2、Br2
17.下列各组物质相互作用时,生成物不随反应条件或反应物的量变化而变化的是( )
A.Na和 B.NaOH和 C.和NaOH D.和HCl
18.对于一个反应可以从多个角度认识。下列关于盐酸与NaOH溶液反应的说法不正确的是
A.属于复分解反应 B.属于离子反应
C.属于中和反应 D.属于氧化还原反应
19.下列实验操作、现象及结论均正确的是( )
选项 操作及现象 结论
A 加热钠块,钠先熔化成光亮的小球,燃烧时火焰为黄色,产生白色固体 钠可与空气中的氧气反应
B 在空气中久置的铝条放入NaOH溶液中,立刻产生大量气泡,铝条逐渐变细且逐渐发热 Al和Al2O3均可与NaOH反应
C 淀粉溶液与稀硫酸混合加热后,滴加碘水,溶液变为蓝色 淀粉溶液未发生水解
D 蔗糖溶液与稀硫酸混合加热后,先加入足量NaOH溶液,再加入新制Cu(OH)2,加热,产生砖红色沉淀 蔗糖的水解产物含有醛基
A.A B.B C.C D.D
20.下列各组物质,不需要经过化学变化就能够从海水中获得的是( )
A.氯、溴、碘 B.钠、镁、铝 C.烧碱、氢气 D.食盐、淡水
二、多选题
21.下列离子方程式书写正确的是( )
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B.稀硝酸中加入少量碳酸亚铁:FeCO3+2H+=Fe2++CO2↑+H2O
C.硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H++OH-=H2O
D.饱和碳酸钠溶液中通入二氧化碳气体:2Na++CO32-+CO2+H2O=2NaHCO3↓
22.将标准状况下的VL CO2通入含有a mol氢氧化钠的溶液中经充分反应得溶液I。下列对溶液I中溶质分析正确的是
A.溶液I中含有溶质的组合可能有4种
B.已知V和a的具体数值可以确定溶液I的溶质
C.已知溶液I中溶质的种类和a值,一定能求出V
D.向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克。由W和V的值可确定溶液I的溶质
三、有机推断题
23.甲溶液可能含有K+、Ca2+、NH4+、Cu2+、NO3-、Cl-、SO42-、CO32-八种离子中的若干种.为确定甲溶液的组成,将其分成两等份,进行如下实验:
①向一份溶液中加入足量的NaOH浓溶液并加热,产生3.36L气体(标准状况);
②向另一份溶液中加入0.4mol/L的BaCl2溶液500mL,恰好可以与溶液中的离子完全反应,过滤得43g沉淀及滤液;
③向上述滤液中加入1mol/L AgNO3溶液450mL,恰好可完全反应;
④向上述沉淀中加入过量的盐酸,产生的气体通入足量澄清石灰水中,得到沉淀C;
据此,请回答下列问题(用相应的离子符号表示):
(1)实验④中得到沉淀C的质量为________;
(2)甲溶液中一定不存在的离子是_________;可能存在的离子是__________。
(3)甲溶液一定存在的离子中,物质的量最大的离子是_____;物质的量最小的离子是______,此物质的量最小的离子其物质的量为________。
四、填空题
24.(1)向某溶液中加入KSCN溶液无明显现象,再滴入数滴氯水后,溶液立即变成红色,则原溶液中一定含有________离子,要除去FeCl3溶液中少量的氯化亚铁,可行的办法是________(填字母)。
A.加入铜粉 B.加入铁粉 C.通入氯气 D.加入KSCN溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 。
(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 。
(3)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是________(填字母)。
A.铜粉 B.氯气 C.铁粉 D.KSCN溶液
(4)向沸水中逐滴滴加1 mol·L-1FeCl3溶液至液体呈透明的红褐色,该分散系中微粒直径的范围是____nm,区别该液体和FeCl3溶液可用 方法。
25.“生活无处不化学”,请你回答下列问题。
(1)厨房中的调味品,①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)。主要成分中具有碱性的是_____(填序号,下同);属于盐类的是______;相互间能发生反应的是________。
(2)食盐不慎洒落在天然气的火焰上,观察的现象是_______________,该变化称为______反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是__________________。
(4)家庭中常用“84”消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。
“消毒液”与“洁厕灵”同时使用会产生有毒的氯气,写出该反应的离子方程式:____________________________________________。
(5)纯碱(Na2CO3)、小苏打(NaHCO3)广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程中,小苏打发生分解反应,该反应的化学方程式是_____________________________________;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的离子方程式是__________________________________________。
(6)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:______________。
26.(1)氢氧化铁受热分解化学方程式:___。
(2)Al(OH)3与NaOH溶液反应的离子方程式:___。
(3)铁溶于盐酸的离子方程式:___。
(4)Na2O2与CO2反应的化学方程式:___。
(5)乙烯的结构式:___。
(6)乙烯的电子式:___。
(7)Na2O2的电子式:___。
五、计算题
27.将质量为44.4克含有少量NaCl的纯碱晶体(Na2CO3·nH2O)样品,平均分成A、B、C三份,进行如图实验,进行如图实验(Na2CO3受热不分).
(1)将A样品与BaCl2溶液反应生成的白色沉淀分离出来的方法是______.
(2)A样品中与BaCl2溶液反应的Na2CO3的质量是______克.
(3)B样品中含有结晶水的质量是______克.
(4)化学式Na2CO3·nH2O中n的数值是. ______
(5)对C样品的操作结束后,所得NaCl溶液的溶质质量分数是______(精确到0.01%)
28.将物质的量浓度相等的盐酸和硫酸混合,取100mL该混合溶液,加入10mL 3.0mol/L的溶液时,溶液显中性,请计算:
(1)原混合液中的物质的量浓度为____________.
(2)原混合中硫酸的物质的量为____________mol.
(3)当加入的体积为7.5mL时,产生的沉淀质量为____________g.
六、实验题
29.向炙热的铁屑中通入氯气生产无水氯化铁;向炽热铁屑中通入氯化氢生产无水氯化亚铁。现用如图所示的装置模拟上述过程进行实验。
回答下列问题:
(1)制取无水氯化铁的实验中,A中反应的化学方程式为___,B中加入的试剂是___,D中盛放的试剂____。
(2)制取无水氯化亚铁的实验中,装置A用来制取____,尾气的成分是___,仍用D装置进行尾气处理,存在的问题是____、____。
(3)若操作不当,制得的FeCl2会含有少量FeCl3,原因可能是____,欲制得纯净的FeCl2,在实验操作中应先___,再____。
30.如下图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。
提示:实验室中所用的少量氯气可以用下述原理制取:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
(1)氧化剂与还原剂物质的量之比为____________ ,氧化产物为____________。
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是(工业上用此原理制取漂白粉。)______________________,
(4)b处离子方程式是_______________________________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4 用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:__________________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
_____MnO4-+______H2C2O4+______ H+=____Mn2++_____CO2↑+_____ ________
试卷第12页,总12页
试卷第11页,总12页
参考答案
1.C
2.C
3.A
4.D
5.C
6.D
7.D
8.A
9.B
10.A
11.B
12.D
13.B
14.C
15.B
16.A
17.C
18.D
19.D
20.D
21.CD
22.AB
23.10g Ca2+、Cu2+ NO3- K+ Cl- 0.1mol
24.(1) Fe2+C 2Fe2++Cl2=2Fe3++2Cl- (2)2Fe3++Cu=2Fe2++Cu2+ (3)C (4) 1~100
丁达尔效应
25.② ①② ②③ 发出黄色火焰 焰色反应 3Fe+4H2O(g) Fe3O4+4H2 ClO-+Cl-+2H+=Cl2↑+H2O 2NaHCO3 Na2CO3+H2O+CO2↑ HCO+H+=CO2↑+H2O 2Na2O2+2CO2=2Na2CO3+O2
26.2Fe(OH)3Fe2O3+3H2O Al(OH)3+OH-=AlO2-+2H2O Fe+2H+=Fe2++H ↑ 2Na2O2+2CO2=2Na2CO3 + O2
27.过滤 5.3 9 10 4.26%
28.0.6 0.02 4.66
29.MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O 浓硫酸 NaOH溶液 HCl HCl和H2 发生倒吸 可燃性气体H2不能被吸收 氯化亚铁被装置内的氧气氧化 通入HCl气体一段时间(排出装置内空气) 点燃C处酒精灯
30.1:5 Cl2 0.2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Fe2++Cl2=2Fe3++2Cl-; CaC2O4(s) + 2H+(aq) + SO42 (aq) CaSO4(s) + H2C2O4(aq) 2 5 6 2 10 8 H2O
答案第2页,总2页
答案第1页,总2页
