鲁科版必修1高中化学第2章第2节-电解质-2课时课件(38张PPT)
文档属性
| 名称 | 鲁科版必修1高中化学第2章第2节-电解质-2课时课件(38张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-25 00:00:00 | ||
图片预览










文档简介
(共38张PPT)
第二章元素与世界
第二节电解质
鲁科版必修1
第一课时
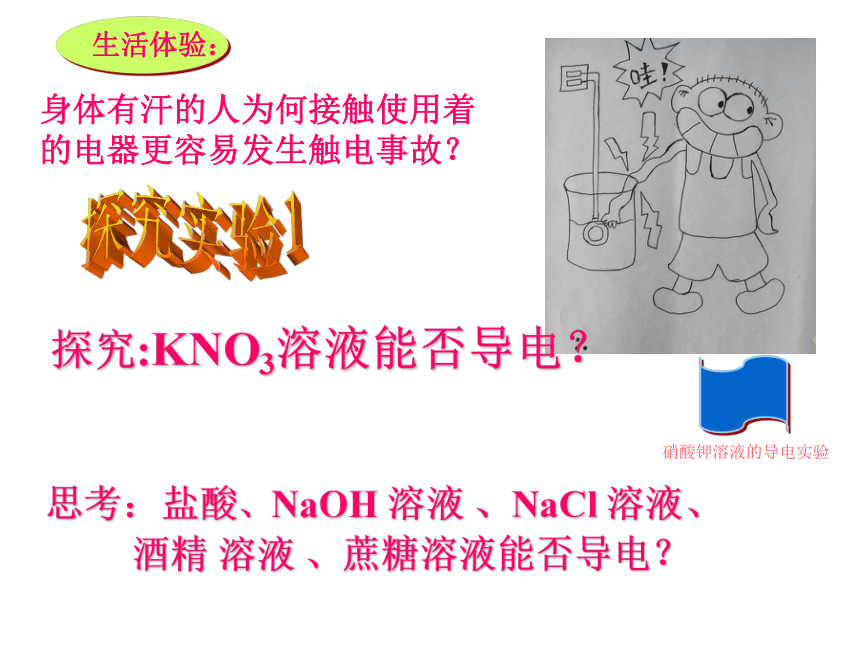
思考:盐酸、NaOH
溶液
、NaCl
溶液、
酒精
溶液
、蔗糖溶液能否导电?
身体有汗的人为何接触使用着
的电器更容易发生触电事故?
生活体验:
硝酸钾溶液的导电实验
探究:KNO3溶液能否导电?
导电:
不导电:
NaOH
溶液
、HCl
溶液
、NaCl
溶液、KNO3溶液。
(都是酸、碱、盐的溶液)
蔗糖溶液、酒精溶液
KNO3晶体以及其熔融状态的导电性实验
思考:电解质在水溶液里能够导电,
在受热熔化时能否导电呢?
KNO3在受热熔化时也能导电。
实验结论:
熔融硝酸钾的导电实验
在水溶液里和熔融状态下
都不能够导电的化合物
在水溶液里或熔融状态下
能够导电的化合物
酸、碱、盐、活泼金属氧化物、
水都是电解质
蔗糖、酒精、CO2、SO2、NH3等。
一、电解质及其电离
电解质:
非电解质:
(一:)电解质和非电解质
定义:
范围:
NaCl、HNO3、NaOH、Na2O等。
例如:
定义:
例如:
范围:
氨、非金属氧化物、大多数的有机物等
①电解质、非电解质一定是化合物
②判断化合物是电解质的条件是指:
在溶液中或熔化状态下有导电性
二者居一即可
例如:
硫酸、氢氯酸等都是电解质只在
水溶液里有导电性。
?
氯化钠电离动画
?
氯化钠电离动画
原因:含有K+和NO3-,但不能自由移动,故不能导电。
原因:原来在晶体中被束缚的离子在水分子的作用下解离为可自由移动的离子,从而能够导电。
原因:
受热熔化后,
KNO3晶体中的K+和NO3-也成为自由移动的离子,可以导电。
KNO3晶体:
KNO3溶液:
熔融状态下的KNO3:
答:不导电
是否导电?
是否导电?
答:导电
答:导电
是否导电?
金属导电:
自由电子的定向移动
(结合上述三个实验回答)
电解质在溶解于水或受热熔化时,
离解成能够自由移动的离子的过程。
(二、)电解质的电离
1.电离
定义:
表示电解质电离为自由移动
离子的式子
NaOH
=
Na+
+
OH-
NaCl
=
Na+
+
Cl-
HCl
=
H
+
+
Cl-
2.
电离方程式:
练习:写出盐酸、氢氧化钠、氯化钠、硫酸铝的电离方程式
Al2(SO4)3=2Al3++3SO42-
书写时要注意等式两边离子的正负电荷守恒、
元素原子个数是否守恒!
你能否从以上三组物质电离后的阴阳离子类型及共同特点入手,给酸、碱、盐下定义呢?
书写电离方程式注意:
举例:
H2SO4=
Ba(OH)2=
CuCl2=
2H++SO42-
Ba2++2OH-
Cu2++2Cl-
类别
定义
实例
电离特点
酸
碱
盐
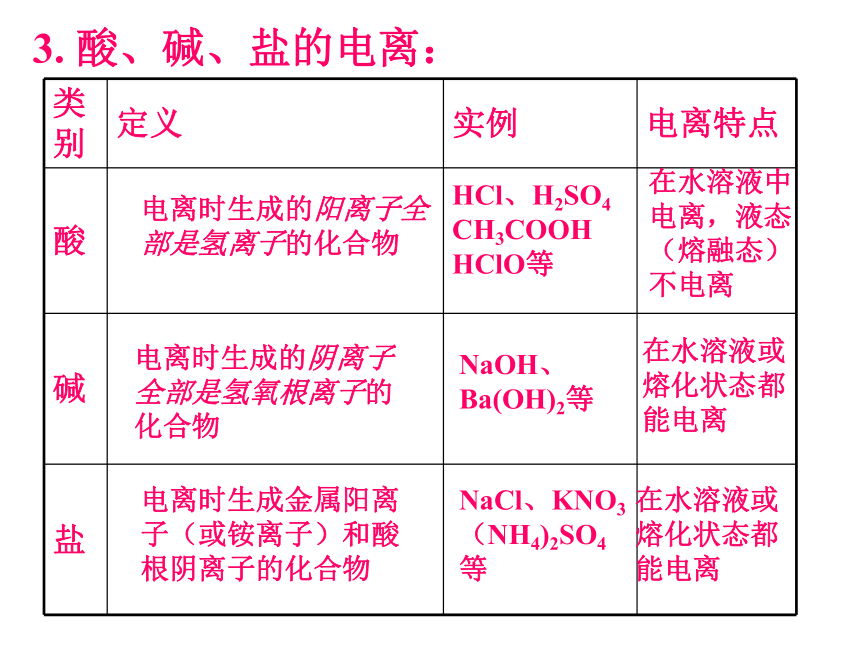
3.
酸、碱、盐的电离:
电离时生成的阳离子全部是氢离子的化合物
电离时生成的阴离子全部是氢氧根离子的化合物
电离时生成金属阳离子(或铵离子)和酸根阴离子的化合物
HCl、H2SO4
CH3COOH
HClO等
NaOH、Ba(OH)2等
NaCl、KNO3
(NH4)2SO4等
在水溶液中电离,液态(熔融态)不电离
在水溶液或熔化状态都能电离
在水溶液或熔化状态都能电离
知识点击:强电解质和弱电解质(课后自学了解)
1、强电解质:
定义:
微粒存在状态:
范围:
在水溶液里能完全电离的电解质
阴、阳离子
强酸、强碱、盐等
2、弱电解质
定义:
微粒存在状态:
范围:
在水溶液里只部分电离的电解质
阴、阳离子和分子
弱酸、弱碱、水
注意:
弱电解质的电离方程式用
连接。强电解质
用=连接。(如:弱碱氨水的电离方程式)
如:N3H.H2O
NH4++OH-
1、下列电离方程式中,错误的是(
)
A.
Al2(SO4)3
=
2Al+3
+
3SO4-2
B.
FeCl3
=
Fe3+
+
3Cl-
C.
HI
=
H+
+
I-
D.
Na2CO3
=
2Na+
+
CO32-
A
自己动手,考一考!
2.下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜
②固态NaCl
③O2
④
H2SO4
⑤碳棒
⑥酒精水溶液
⑦KOH水溶液
⑧熔融状态的KNO3
⑨葡萄糖
⑩CO2
电解质:
非电解质:
能导电:
②④⑧
⑨⑩
①⑤⑦⑧
感悟!CO2、NH3等溶于H2O时与H2O反应生成电
解质H2CO3和NH3.H2O,使其水溶液产生导电性,
但CO2、NH3本身都是非电解质!
非电解质但水溶液导电:
⑩
3.下列物质能导电的是(
)
A.熔融的氯化钠
B.硝酸钾溶液
C.硫酸铜晶体
D.无水乙醇
4.下列物质中,导电性能最差的是(
)
A.熔融氢氧化钠
B.石墨棒
C.盐酸溶液
D.固态氯化钾
A、B
D
学案练习:
1.下列说法正确的是
(
)
A.氯化钠在溶液中受电流作用电离成自由移动的阴阳离子
B.溶于水后能电离出氢离子都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.水难电离,纯水几乎不电离,所以水是非电解质
2.含有自由移动的Cl-
的是(
)
A.KClO3溶液
B
液态HCl
C
固体NaCl
D.
KCl溶液
C
D
3、下列说法正确的是
(
)
A.将AgCl放入水中不能导电,故AgCl
不是电解质
B.CO2溶于水得到的溶液能导电,所以CO2是电解质
C.金属能导电,所以金属是电解质
D.固态的NaCl不导电,熔融态的NaCl能导电,故NaCl是电解质
4.
下列说法正确的是
(
)
A.在水溶液中能够电离出离子的化合物是电解质
B.固态时不能导电的物质一定是非电解质
C.能导电的物质一定是电解质
D.某物质不是电解质就一定是非电解质
D
A
作业:
写出下列物质在水溶液中的电离方程式
Na2SO4
=
H2SO4
=
Ba(OH)2
=
NaHSO4
=
KHCO3
=
5、.为了维持人体内电解质平衡,人在大量出汗后
应及时补充(
)
A.Mg2+
B.
Ca2+
C.
Na+
D.
Fe3+
C
第二章元素与世界
第二节电解质
第二课时
鲁科版必修1
知识回顾
电解质:
在水溶液或熔融状态下能够导电
的化合物。
非电解质:
在水溶液和熔融状态下都不能导
电的化合物。
(如酸、碱、盐、活泼金属的氧化
物、水等物质)
(如氨、非金属氧化物、大多数的有
机物等)
常见例子:
常见例子:
【观察·思考】
实验现象
原因分析
2.电流表指针逐渐偏向零,再滴加时,又不断偏大.
1.滴有酚酞溶液的氢氧化钡溶液由红色变成无色,说明H+与OH-发生了反应
2.指针的偏转反映出溶液中离子浓度的减小
3.生成白色沉淀,说明Ba2+与SO42-发生了反应;
实验:向0.01mol·L-1Ba(OH)2溶液中滴入几滴酚酞溶液,然后向溶液中滴加0.2mol·L-1H2SO4溶液,观察溶液中的现象和电流表指针的变化.
H2SO4在水溶液中以H+和SO42-形式存在,Ba(OH)2在水溶液中以Ba+和OH-形式存在。如果将两溶液混合,这四种离子是否还依然存在呢?
1.溶液中不断产生白色沉淀,红色逐渐变浅,直至消失.
硫酸与氢氧化钡的反应
【分析·结论】
结论:稀硫酸与氢氧化钡溶液的反应,实质上是H+与OH-发生反应、Ba2+与SO42-发生反应,反应物中离子浓度减少,即离子间发生了反应。
H2SO4
=
2H+
+
SO42―
Ba(OH)2
=
2OH―
+
Ba2+
即:Ba2+
+
2OH―
+
2H+
+
SO42―
=
BaSO4↓+
2H2O
+
2H2O
+
BaSO4
(一、)离子反应
1、离子反应的概念
在溶液中有离子参加的化学反应叫做离子反应。
即:发生离子反应需要一定的条件。
〖思考〗判断下列电解质溶液间能否发生复分解反应?
①
MgCl2与NaOH
;
②
(NH4)2CO3与K2SO4
。
二、电解质在水溶液中的反应
定义:
强调:⑴、复分解反应都是离子反应。
⑵、电解质溶液之间发生的反应都是离子反应。
(3)、离子反应实质:反应物中离子浓度的减小。
(
能
)
(不能)
2.
离子反应发生的条件
有难溶性物质、难电离的物质或挥发性的物质生成
(1)
牢记溶解性表
常见酸、碱、盐的溶解性表
OH-
NO3-
Cl-
SO42-
CO32-
H+
?
挥
挥
溶
挥
NH4+
挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
-
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
-
Cu2+
不
溶
溶
溶
不
Ag+
-
溶
不
微
不
(2)记住常见的弱电解质
(3)常见挥发性的物质,
如:
常见的难电离物质
弱酸:
弱碱:
水:
H2O
条件
注意:
H2CO3、CH3COOH、HClO等
NH3·H2O、Al(OH)3等不
溶性碱。
CO2、H2等
在无色、酸性溶液中,能大量共存的是(
)
A.
Ba2+、Cl-、NO3-、Na+
B.
K+、Cu2+、SO42-、Cl-
C.
Na+、K+、CO32-、SO42-
D.
Mg2+、SO42-、OH-、NO3-
现学现用:
A
H+
H+
H+
H+
结论:
1、在溶液里发生离子反应的离子不共存!
2、鉴定离子是否存在。如
SO42-、Cl-的鉴定。
隐
含
条
件
1、下列有色溶液中,能在溶液中大量共存的是(
)。
A、K+、H+、SO42-、OH-
B、Fe3+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、CO32-
D、Na+、
Cu2+、Cl-、SO42-
体会:
判断离子共存时还要注意题目中的隐含条件:
如溶液是否无色、酸性、碱性还是中性。
几种离子在水溶液中的颜色:(记住!)
Cu2+(蓝色);Fe3+(黄色);
Fe2+(浅绿色);MnO4-(紫红色)
D
二、离子方程式
用实际参加反应的离子符号表示
离子反应的式子称为离子方程式。
如:Mg2++2OH-=
Mg(OH)2↓
OH-+
H+
=H2O
等。
2、离子方程式的书写
书写步骤:(切记!)
一写、写出化学方程式:
二拆、将易溶于水且易电离的物质拆开
写成离子形式
三删、删去两边相同的离子
四查、检查反应前后电荷是否守恒,
质量是否守恒。
1、定义:
Ag+
+
NO3
-
+
K+
+
Cl-=
AgCl↓+
K+
+
NO3
-
实例:离子反应方程式的书写步骤:
(以硝酸银和氯化钾反应为例)
删去两边相同的离子:
检查反应前后电荷是否守恒,
质量是否守恒。
写出化学方程式:
将易溶于水且易电离的
物质拆开写成离子形式:
AgNO3+KCl=AgCl↓+KNO3
Ag+
+
NO3
-
+
K++Cl-=AgCl↓+
K+
+
NO3
-
Ag+
+Cl-=AgCl↓
(1)(一写):
(2)(二拆):
(3)(三删)
(4)(四查)
3、离子方程式中的书写规则
(切记!)
⑴(拆)易溶易电离的物质用离子表示:
⑶、多元弱酸的酸式酸根离子在离子方程式中
不能拆开写.如:碳酸氢钠与盐酸反应
写作:
HCO3-
+
H+
=
H2O
+
CO2↑
⑵(不拆)单质、氧化物(包括H2O)、气体、沉淀、
弱电解质(即:弱酸、弱碱)用化学式表示。
即:
强酸、强碱、可溶盐
1、请写出下列反应的离子方程式:
NaOH溶液和H2SO4溶液混合:
KOH溶液和HNO3溶液混合:
BaCl2溶液和Na2SO4溶液混合:
Ba(NO3)2和CuSO4溶液混合:
练习与感悟:
H++OH-=H2O
H++OH-=H2O
Ba2+
+
SO42―
=
BaSO4↓
Ba2+
+
SO42―
=
BaSO4↓
离子方程式能够表示一类化学反应的本质!
C
2、在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓来表示的是( )
A、Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
B、BaCl2+Na2SO4=BaSO4↓+2NaCl
C、BaCO3+H2SO4=BaSO4↓+H2O+CO2↑
D、BaCl2+H2SO4=BaSO4↓+2HCl
4、离子方程式正误的判断
⑷、没有参加离子反应的离子
不能写入离子反应方程式:
Cu
+
Ag+
=
Cu2+
+
Ag(错)
2Fe+6H+=2Fe3++3H2↑(错)
Ca(OH)2
+2
H+
=
Ca2+
+H2O
(错)
MgCO3+2H++2Cl-=Mg2++H2O+CO2↑+2Cl-(错)
⑴、要符合反应事实:
⑵、要符合电荷守恒:
⑶、要符合质量守恒定律:
3、下列离子方程式正确的是(
)
A.硫酸镁溶液跟氢氧化钡溶液的反应:
Ba2++SO42-=BaSO4↓
B.氢氧化钡溶液跟稀硫酸溶液的反应:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.铜片插入硝酸银溶液中:
Cu+2Ag+=Cu2++2Ag
D.氢氧化钠溶液中加入醋酸:
OH-+H+=H2O
C
4、下列离子方程式正确的是(
)
A.澄清的石灰水与盐酸反应
Ca(OH)2+
H+
=
Ca2+
+
2H2O
B.钠与水的反应
Na
+
2H2O
=
Na+
+
2OH-
+
H2↑
C、稀硫酸滴在铜片上:
Cu+2H+=Cu2++H2↑
D.大理石溶于醋酸的反应
CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
D
C
5、下列离子方程式中正确的是( )
A、铁跟稀硫酸反应:2Fe+H+=2Fe3++3H2↑
B、碳酸氢钙溶液与稀盐酸反应:
Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
C、醋酸与氢氧化钾溶液:
CH3COOH+OH-=CH3COO-+H2O
D、碳酸镁跟硫酸反应:
MgCO3+2H+=Mg2++H2O+CO2
作业:
书写下列反应的离子方程式:
(1)Cu(OH)2与H2SO4反应
(2)Ba(OH)2与HCl反应
(3)硫酸钠溶液与氯化钡溶液混合:
(4)盐酸滴在石灰石上:
(5)氧化铜与硫酸混合:
离子方程式中微溶物的处理方法:
[典型代表是Ca(OH)2
]
①在生成物中微溶物写成化学式。
②当反应物里微溶物如处于溶液状态,
写成离子形式。
③当反应物里微溶物处于浊液或固态,
写成化学式。(如石灰乳)
例如:氯气通入石灰乳里制漂白粉
2Ca(OH)2+2Cl2==2Ca2++2Cl-+2ClO-+2H2O
如:澄清石灰水和盐酸混合Ca(OH)2+2HCl==CaCl2+2H2O
离子方程式:OH-
+
H+==
H2O
拓展
第二章元素与世界
第二节电解质
鲁科版必修1
第一课时
思考:盐酸、NaOH
溶液
、NaCl
溶液、
酒精
溶液
、蔗糖溶液能否导电?
身体有汗的人为何接触使用着
的电器更容易发生触电事故?
生活体验:
硝酸钾溶液的导电实验
探究:KNO3溶液能否导电?
导电:
不导电:
NaOH
溶液
、HCl
溶液
、NaCl
溶液、KNO3溶液。
(都是酸、碱、盐的溶液)
蔗糖溶液、酒精溶液
KNO3晶体以及其熔融状态的导电性实验
思考:电解质在水溶液里能够导电,
在受热熔化时能否导电呢?
KNO3在受热熔化时也能导电。
实验结论:
熔融硝酸钾的导电实验
在水溶液里和熔融状态下
都不能够导电的化合物
在水溶液里或熔融状态下
能够导电的化合物
酸、碱、盐、活泼金属氧化物、
水都是电解质
蔗糖、酒精、CO2、SO2、NH3等。
一、电解质及其电离
电解质:
非电解质:
(一:)电解质和非电解质
定义:
范围:
NaCl、HNO3、NaOH、Na2O等。
例如:
定义:
例如:
范围:
氨、非金属氧化物、大多数的有机物等
①电解质、非电解质一定是化合物
②判断化合物是电解质的条件是指:
在溶液中或熔化状态下有导电性
二者居一即可
例如:
硫酸、氢氯酸等都是电解质只在
水溶液里有导电性。
?
氯化钠电离动画
?
氯化钠电离动画
原因:含有K+和NO3-,但不能自由移动,故不能导电。
原因:原来在晶体中被束缚的离子在水分子的作用下解离为可自由移动的离子,从而能够导电。
原因:
受热熔化后,
KNO3晶体中的K+和NO3-也成为自由移动的离子,可以导电。
KNO3晶体:
KNO3溶液:
熔融状态下的KNO3:
答:不导电
是否导电?
是否导电?
答:导电
答:导电
是否导电?
金属导电:
自由电子的定向移动
(结合上述三个实验回答)
电解质在溶解于水或受热熔化时,
离解成能够自由移动的离子的过程。
(二、)电解质的电离
1.电离
定义:
表示电解质电离为自由移动
离子的式子
NaOH
=
Na+
+
OH-
NaCl
=
Na+
+
Cl-
HCl
=
H
+
+
Cl-
2.
电离方程式:
练习:写出盐酸、氢氧化钠、氯化钠、硫酸铝的电离方程式
Al2(SO4)3=2Al3++3SO42-
书写时要注意等式两边离子的正负电荷守恒、
元素原子个数是否守恒!
你能否从以上三组物质电离后的阴阳离子类型及共同特点入手,给酸、碱、盐下定义呢?
书写电离方程式注意:
举例:
H2SO4=
Ba(OH)2=
CuCl2=
2H++SO42-
Ba2++2OH-
Cu2++2Cl-
类别
定义
实例
电离特点
酸
碱
盐
3.
酸、碱、盐的电离:
电离时生成的阳离子全部是氢离子的化合物
电离时生成的阴离子全部是氢氧根离子的化合物
电离时生成金属阳离子(或铵离子)和酸根阴离子的化合物
HCl、H2SO4
CH3COOH
HClO等
NaOH、Ba(OH)2等
NaCl、KNO3
(NH4)2SO4等
在水溶液中电离,液态(熔融态)不电离
在水溶液或熔化状态都能电离
在水溶液或熔化状态都能电离
知识点击:强电解质和弱电解质(课后自学了解)
1、强电解质:
定义:
微粒存在状态:
范围:
在水溶液里能完全电离的电解质
阴、阳离子
强酸、强碱、盐等
2、弱电解质
定义:
微粒存在状态:
范围:
在水溶液里只部分电离的电解质
阴、阳离子和分子
弱酸、弱碱、水
注意:
弱电解质的电离方程式用
连接。强电解质
用=连接。(如:弱碱氨水的电离方程式)
如:N3H.H2O
NH4++OH-
1、下列电离方程式中,错误的是(
)
A.
Al2(SO4)3
=
2Al+3
+
3SO4-2
B.
FeCl3
=
Fe3+
+
3Cl-
C.
HI
=
H+
+
I-
D.
Na2CO3
=
2Na+
+
CO32-
A
自己动手,考一考!
2.下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜
②固态NaCl
③O2
④
H2SO4
⑤碳棒
⑥酒精水溶液
⑦KOH水溶液
⑧熔融状态的KNO3
⑨葡萄糖
⑩CO2
电解质:
非电解质:
能导电:
②④⑧
⑨⑩
①⑤⑦⑧
感悟!CO2、NH3等溶于H2O时与H2O反应生成电
解质H2CO3和NH3.H2O,使其水溶液产生导电性,
但CO2、NH3本身都是非电解质!
非电解质但水溶液导电:
⑩
3.下列物质能导电的是(
)
A.熔融的氯化钠
B.硝酸钾溶液
C.硫酸铜晶体
D.无水乙醇
4.下列物质中,导电性能最差的是(
)
A.熔融氢氧化钠
B.石墨棒
C.盐酸溶液
D.固态氯化钾
A、B
D
学案练习:
1.下列说法正确的是
(
)
A.氯化钠在溶液中受电流作用电离成自由移动的阴阳离子
B.溶于水后能电离出氢离子都是酸
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.水难电离,纯水几乎不电离,所以水是非电解质
2.含有自由移动的Cl-
的是(
)
A.KClO3溶液
B
液态HCl
C
固体NaCl
D.
KCl溶液
C
D
3、下列说法正确的是
(
)
A.将AgCl放入水中不能导电,故AgCl
不是电解质
B.CO2溶于水得到的溶液能导电,所以CO2是电解质
C.金属能导电,所以金属是电解质
D.固态的NaCl不导电,熔融态的NaCl能导电,故NaCl是电解质
4.
下列说法正确的是
(
)
A.在水溶液中能够电离出离子的化合物是电解质
B.固态时不能导电的物质一定是非电解质
C.能导电的物质一定是电解质
D.某物质不是电解质就一定是非电解质
D
A
作业:
写出下列物质在水溶液中的电离方程式
Na2SO4
=
H2SO4
=
Ba(OH)2
=
NaHSO4
=
KHCO3
=
5、.为了维持人体内电解质平衡,人在大量出汗后
应及时补充(
)
A.Mg2+
B.
Ca2+
C.
Na+
D.
Fe3+
C
第二章元素与世界
第二节电解质
第二课时
鲁科版必修1
知识回顾
电解质:
在水溶液或熔融状态下能够导电
的化合物。
非电解质:
在水溶液和熔融状态下都不能导
电的化合物。
(如酸、碱、盐、活泼金属的氧化
物、水等物质)
(如氨、非金属氧化物、大多数的有
机物等)
常见例子:
常见例子:
【观察·思考】
实验现象
原因分析
2.电流表指针逐渐偏向零,再滴加时,又不断偏大.
1.滴有酚酞溶液的氢氧化钡溶液由红色变成无色,说明H+与OH-发生了反应
2.指针的偏转反映出溶液中离子浓度的减小
3.生成白色沉淀,说明Ba2+与SO42-发生了反应;
实验:向0.01mol·L-1Ba(OH)2溶液中滴入几滴酚酞溶液,然后向溶液中滴加0.2mol·L-1H2SO4溶液,观察溶液中的现象和电流表指针的变化.
H2SO4在水溶液中以H+和SO42-形式存在,Ba(OH)2在水溶液中以Ba+和OH-形式存在。如果将两溶液混合,这四种离子是否还依然存在呢?
1.溶液中不断产生白色沉淀,红色逐渐变浅,直至消失.
硫酸与氢氧化钡的反应
【分析·结论】
结论:稀硫酸与氢氧化钡溶液的反应,实质上是H+与OH-发生反应、Ba2+与SO42-发生反应,反应物中离子浓度减少,即离子间发生了反应。
H2SO4
=
2H+
+
SO42―
Ba(OH)2
=
2OH―
+
Ba2+
即:Ba2+
+
2OH―
+
2H+
+
SO42―
=
BaSO4↓+
2H2O
+
2H2O
+
BaSO4
(一、)离子反应
1、离子反应的概念
在溶液中有离子参加的化学反应叫做离子反应。
即:发生离子反应需要一定的条件。
〖思考〗判断下列电解质溶液间能否发生复分解反应?
①
MgCl2与NaOH
;
②
(NH4)2CO3与K2SO4
。
二、电解质在水溶液中的反应
定义:
强调:⑴、复分解反应都是离子反应。
⑵、电解质溶液之间发生的反应都是离子反应。
(3)、离子反应实质:反应物中离子浓度的减小。
(
能
)
(不能)
2.
离子反应发生的条件
有难溶性物质、难电离的物质或挥发性的物质生成
(1)
牢记溶解性表
常见酸、碱、盐的溶解性表
OH-
NO3-
Cl-
SO42-
CO32-
H+
?
挥
挥
溶
挥
NH4+
挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
-
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
-
Cu2+
不
溶
溶
溶
不
Ag+
-
溶
不
微
不
(2)记住常见的弱电解质
(3)常见挥发性的物质,
如:
常见的难电离物质
弱酸:
弱碱:
水:
H2O
条件
注意:
H2CO3、CH3COOH、HClO等
NH3·H2O、Al(OH)3等不
溶性碱。
CO2、H2等
在无色、酸性溶液中,能大量共存的是(
)
A.
Ba2+、Cl-、NO3-、Na+
B.
K+、Cu2+、SO42-、Cl-
C.
Na+、K+、CO32-、SO42-
D.
Mg2+、SO42-、OH-、NO3-
现学现用:
A
H+
H+
H+
H+
结论:
1、在溶液里发生离子反应的离子不共存!
2、鉴定离子是否存在。如
SO42-、Cl-的鉴定。
隐
含
条
件
1、下列有色溶液中,能在溶液中大量共存的是(
)。
A、K+、H+、SO42-、OH-
B、Fe3+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、CO32-
D、Na+、
Cu2+、Cl-、SO42-
体会:
判断离子共存时还要注意题目中的隐含条件:
如溶液是否无色、酸性、碱性还是中性。
几种离子在水溶液中的颜色:(记住!)
Cu2+(蓝色);Fe3+(黄色);
Fe2+(浅绿色);MnO4-(紫红色)
D
二、离子方程式
用实际参加反应的离子符号表示
离子反应的式子称为离子方程式。
如:Mg2++2OH-=
Mg(OH)2↓
OH-+
H+
=H2O
等。
2、离子方程式的书写
书写步骤:(切记!)
一写、写出化学方程式:
二拆、将易溶于水且易电离的物质拆开
写成离子形式
三删、删去两边相同的离子
四查、检查反应前后电荷是否守恒,
质量是否守恒。
1、定义:
Ag+
+
NO3
-
+
K+
+
Cl-=
AgCl↓+
K+
+
NO3
-
实例:离子反应方程式的书写步骤:
(以硝酸银和氯化钾反应为例)
删去两边相同的离子:
检查反应前后电荷是否守恒,
质量是否守恒。
写出化学方程式:
将易溶于水且易电离的
物质拆开写成离子形式:
AgNO3+KCl=AgCl↓+KNO3
Ag+
+
NO3
-
+
K++Cl-=AgCl↓+
K+
+
NO3
-
Ag+
+Cl-=AgCl↓
(1)(一写):
(2)(二拆):
(3)(三删)
(4)(四查)
3、离子方程式中的书写规则
(切记!)
⑴(拆)易溶易电离的物质用离子表示:
⑶、多元弱酸的酸式酸根离子在离子方程式中
不能拆开写.如:碳酸氢钠与盐酸反应
写作:
HCO3-
+
H+
=
H2O
+
CO2↑
⑵(不拆)单质、氧化物(包括H2O)、气体、沉淀、
弱电解质(即:弱酸、弱碱)用化学式表示。
即:
强酸、强碱、可溶盐
1、请写出下列反应的离子方程式:
NaOH溶液和H2SO4溶液混合:
KOH溶液和HNO3溶液混合:
BaCl2溶液和Na2SO4溶液混合:
Ba(NO3)2和CuSO4溶液混合:
练习与感悟:
H++OH-=H2O
H++OH-=H2O
Ba2+
+
SO42―
=
BaSO4↓
Ba2+
+
SO42―
=
BaSO4↓
离子方程式能够表示一类化学反应的本质!
C
2、在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓来表示的是( )
A、Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
B、BaCl2+Na2SO4=BaSO4↓+2NaCl
C、BaCO3+H2SO4=BaSO4↓+H2O+CO2↑
D、BaCl2+H2SO4=BaSO4↓+2HCl
4、离子方程式正误的判断
⑷、没有参加离子反应的离子
不能写入离子反应方程式:
Cu
+
Ag+
=
Cu2+
+
Ag(错)
2Fe+6H+=2Fe3++3H2↑(错)
Ca(OH)2
+2
H+
=
Ca2+
+H2O
(错)
MgCO3+2H++2Cl-=Mg2++H2O+CO2↑+2Cl-(错)
⑴、要符合反应事实:
⑵、要符合电荷守恒:
⑶、要符合质量守恒定律:
3、下列离子方程式正确的是(
)
A.硫酸镁溶液跟氢氧化钡溶液的反应:
Ba2++SO42-=BaSO4↓
B.氢氧化钡溶液跟稀硫酸溶液的反应:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.铜片插入硝酸银溶液中:
Cu+2Ag+=Cu2++2Ag
D.氢氧化钠溶液中加入醋酸:
OH-+H+=H2O
C
4、下列离子方程式正确的是(
)
A.澄清的石灰水与盐酸反应
Ca(OH)2+
H+
=
Ca2+
+
2H2O
B.钠与水的反应
Na
+
2H2O
=
Na+
+
2OH-
+
H2↑
C、稀硫酸滴在铜片上:
Cu+2H+=Cu2++H2↑
D.大理石溶于醋酸的反应
CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
D
C
5、下列离子方程式中正确的是( )
A、铁跟稀硫酸反应:2Fe+H+=2Fe3++3H2↑
B、碳酸氢钙溶液与稀盐酸反应:
Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
C、醋酸与氢氧化钾溶液:
CH3COOH+OH-=CH3COO-+H2O
D、碳酸镁跟硫酸反应:
MgCO3+2H+=Mg2++H2O+CO2
作业:
书写下列反应的离子方程式:
(1)Cu(OH)2与H2SO4反应
(2)Ba(OH)2与HCl反应
(3)硫酸钠溶液与氯化钡溶液混合:
(4)盐酸滴在石灰石上:
(5)氧化铜与硫酸混合:
离子方程式中微溶物的处理方法:
[典型代表是Ca(OH)2
]
①在生成物中微溶物写成化学式。
②当反应物里微溶物如处于溶液状态,
写成离子形式。
③当反应物里微溶物处于浊液或固态,
写成化学式。(如石灰乳)
例如:氯气通入石灰乳里制漂白粉
2Ca(OH)2+2Cl2==2Ca2++2Cl-+2ClO-+2H2O
如:澄清石灰水和盐酸混合Ca(OH)2+2HCl==CaCl2+2H2O
离子方程式:OH-
+
H+==
H2O
拓展
