高中化学选修四1.2燃烧热能源 课时作业(含解析)
文档属性
| 名称 | 高中化学选修四1.2燃烧热能源 课时作业(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-28 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
课时作业3 燃烧热 能源
时间:45分钟 满分:100分
一、选择题(每小题4分,共48分)
1.下列热化学方程式正确的是(ΔH的绝对值均正确)( B )
A.Hg+O2===HgO ΔH=-90.7 kJ·mol-1(反应热)
B.P(s)+Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1(反应热)
C.CH3OH(l)+O2(g)===CO2(g)+2H2O(g)
ΔH=-725.76 kJ·mol-1(燃烧热)
D.NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
解析:热化学_????¨???????é??è??_注明各物质的状态,A项错误;燃烧热是指在101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时释放出的能量,CH3OH完全燃烧应生成二氧化碳气体和液态水,C项错误;中和反应是放热反应,ΔH应小于0,D项错误。
2.已知:
①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1
②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1
下列判断正确的是( B )
A.氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B.相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ2·1·c·n·j·y
C.由①②知,水的热稳定性小于硫化氢
D.②中若生成固态硫,ΔH将增大
解析:由①可知_???H2(g)_+O2(g)===H2O(g) ΔH=-483.6 kJ·mol-1×=-241.8 kJ·mol-1,燃烧热中生成的水应是液态水,A错误;②表示的是1 mol H2S(g)所含有的能量比1 mol H2(g)与1 mol S(g)的混合物所含有的能量少20.1 kJ,故相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ,B项正确;由①②知,水分解比硫化氢分解要多吸收能量,即水不易分解,说明水的稳定性大于硫化氢,C项错误;由于S(g)→S(s),要放热,故②中若生成固态硫,ΔH将减小,D项错误。
3.下列说法不正确的是( D )
A.固体煤变为气体燃料后,燃烧效率将提高
B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.化石燃料在任何条件下都能充分燃烧
解析:固体煤变为气体_????????????????¤§_燃料接触面积,燃烧充分,燃烧效率将提高,A正确;化石燃料中含C、S等元素,在燃烧过程中能产生污染环境的CO、SO2等有害气体,B正确;直接燃烧煤的能源利用率低且产生的污染物多,将煤进行深加工后再燃烧,产生的污染物少,燃烧效率更高,因此效果更好,C正确;化石燃料只有在适当的温度和有足量氧气的条件下才能充分燃烧,D错误。21·世纪*教育网
4.已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g)
ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1
③H2(g)+O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
④H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
下列结论正确的是( A )
A.碳的燃烧热大于110.5 kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量
C.氢气的燃烧热为241.8 kJ·mol-1
D.碳的燃烧热为110.5 kJ·mol-1
解析:燃烧热是指1 m_ol_??????è?¨_完全燃烧生成稳定的氧化物所放出的热量,C完全燃烧的产物是CO2,CO继续燃烧生成CO2放出热量,则C的燃烧热大于110.5 kJ·mol-1;浓硫酸中的H+与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量,但是浓硫酸的稀释又有热量释放,所以该反应过程放出的热量大于57.3 kJ。www-2-1-cnjy-com
5.下列说法正确的是( B )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol21*cnjy*com
B.已知NaOH(aq)_???HCl(a_q)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含0.5 mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.7 kJ
C.可燃物的系数为1的燃烧反应的焓变即为该可燃物的燃烧热
D.已知2C(s)+2_O2(g)=_==2CO2(g) ΔH=a kJ/mol,2C(s)+O2(g)===2CO(g) ΔH=b kJ/mol,则a>b
解析:A选项错误,燃烧热指_?????????????°????_出的热量,不是生成气态水;B选项正确,因为醋酸电离吸收热量,所以放出的热量会略小;C选项错误,表示燃烧热的反应除可燃物系数为1,还必须注意产物及各物质的状态;D选项错误,生成CO放出的热量数值偏小,则ΔH的值偏大,故选B。
6.已知化学反应:CO2(g)===CO(g) ΔH1<0;CO(g)+O2(g)===CO2(g) ΔH2<0;C(s)+O2(g)===CO2(g) ΔH3<0;下列说法正确的是(相同条件下)( B )
A.56 g CO和32 g O2 的总能量小于88 g CO2的能量
B.碳的燃烧热是ΔH3
C.ΔH1<ΔH3
D.28 g CO的能量比44 g CO2的能量高
解析:CO燃烧是放热反应,反应物的总能量大于生成物的总能量,A错误;D中忽略了O2的能量,错误;比较ΔH时必须带符号,C错误。21教育名师原创作品
7.已知热化_???????¨????2H_2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ/mol,则下列关于热化学方程式2H2O(l)===2H2(g)+O2(g) ΔH2的说法正确的是( B )
A.热化学方程式中的化学计量数表示分子数
B.该反应中的ΔH2>0
C.该反应中的ΔH2=-571.6 kJ/mol
D.该反应与题述反应互为可逆反应
解析:热化学方程式中的化学计_é????°è?¨?¤????è?¨_的量,不表示分子数。该反应是2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ/mol逆向进行的反应,ΔH2=+571.6 kJ/mol,但该反应与题述反应不互为可逆反应,因二者的反应条件不相同。
8.已知H2的燃烧热_???285.8_ kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况),充分燃烧后,放出热量710.0 kJ,并生成液态水。下列说法正确的是( C )
A.CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g)
ΔH=+282.8 kJ/mol
B.H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g)
ΔH=-571.6 kJ/mol
C.燃烧前的混合气体中,H2的体积分数为40%
D.混合气体燃烧后与足量的过氧化钠反应,转移电子2 mol
解析:A项,1 mo_l_CO?????§_生成1 mol CO2放热282.8 kJ,ΔH<0,错误。B项,由于题目中已知H2的燃烧热,因此生成的H2O应为液态,错误。设56.0 L混合气体中含H2的物质的量为x,CO的物质的量为y,列式x+y==2.5 mol ①,285.8 kJ·mol-1x+282.8 kJ·mol-1y=710.0 kJ ②,联立①②解得x=1 mol,则H2的体积分数为×100%=40%,C项正确。混合气体燃烧后生成H2O、CO2共2.5 mol,与足量的过氧化钠反应能产生O2 1.25 mol,转移电子总数为2.5 mol,D项错误。www.21-cn-jy.com
9.充分燃烧_??????é??????????·_气体放出的热量为Q。完全吸收它生成的CO2气体生成正盐,需5 mol/L的KOH溶液100 mL,则丁烷的燃烧热为( A )
A.16Q B.8Q
C.4Q D.2Q
解析:由题意可得关系式:
C4H10~4CO2~8KOH~4K2CO3
1 8
x 5 mol/L×0.1 L=0.5 mol
得x=6.25×1_0???2_mo_l,即得6.25×10-2 mol丁烷充分燃烧放出热量Q,则1 mol丁烷充分燃烧会放出16Q的热量,故选A项。
10.已知:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
CO(g)+O2(g)===CO2(g)
ΔH=-282.9 kJ·mol-1
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( C )
A.2?1 B.1?2
C.1?1 D.2?3
解析:根据热化学方_?¨?????????????H_2的燃烧热为571.6 kJ·mol-1÷2=285.8 kJ·mol-1,生成的n(H2O)==0.2 mol,参加反应的H2为0.2 mol,故H2燃烧放出的热量为0.2 mol×285.8 kJ·mol-1=57.16 kJ。CO燃烧放出的热量为113.74 kJ-57.16 kJ=56.58 kJ,CO的燃烧热为282.9 kJ·mol-1,故n(CO)===0.2 mol。则n(H2)?n(CO)=1?1。
11.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1
下列说法正确的是( D )
A.CH3OH的燃烧热为192.9 kJ·mol-1
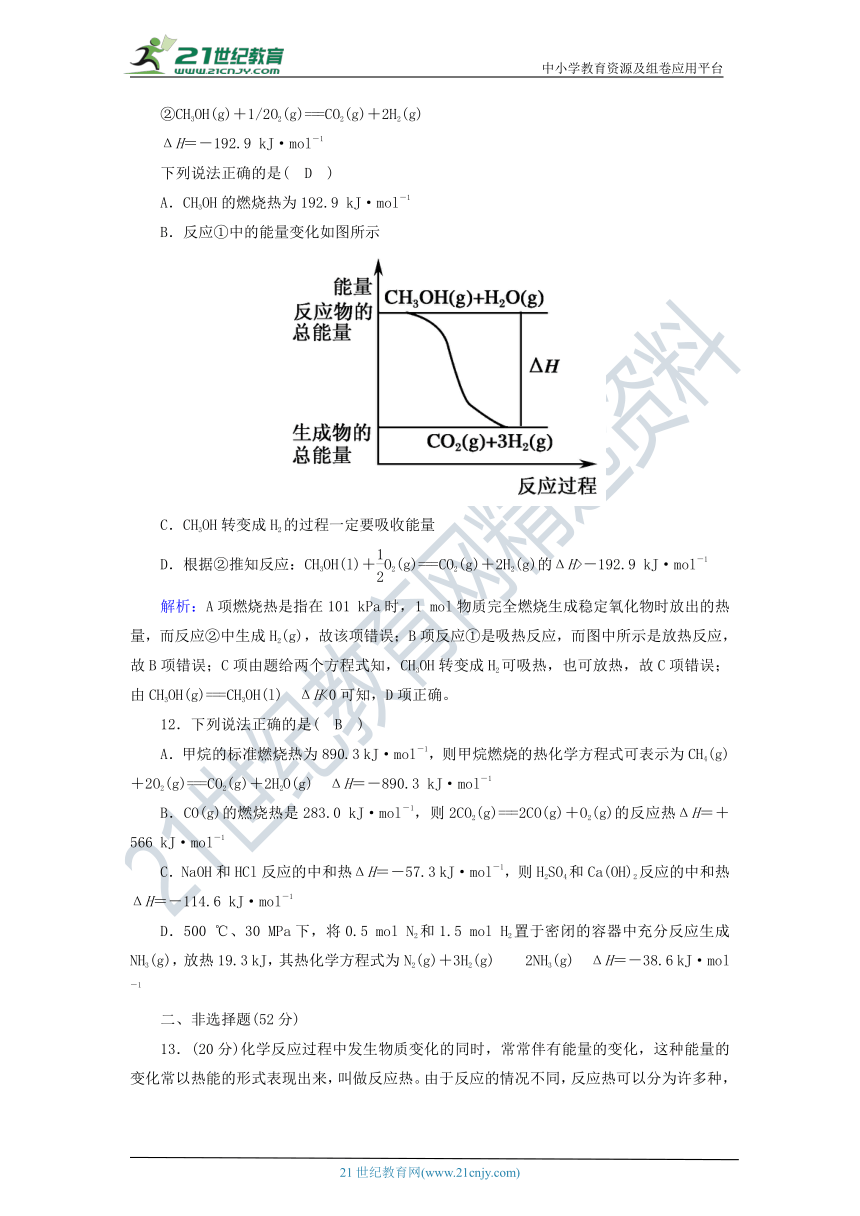
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
解析:A项燃烧热是指在_101_kP_a时,1 mol物质完全燃烧生成稳定氧化物时放出的热量,而反应②中生成H2(g),故该项错误;B项反应①是吸热反应,而图中所示是放热反应,故B项错误;C项由题给两个方程式知,CH3OH转变成H2可吸热,也可放热,故C项错误;由CH3OH(g)===CH3OH(l) ΔH<0可知,D项正确。21·cn·jy·com
12.下列说法正确的是( B )
A.甲烷的标准燃烧热为890_.3_kJ?·_mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-12-1-c-n-j-y
B.CO(g)的燃烧_??????283._0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)的反应热ΔH=+566 kJ·mol-1
C.NaOH和HCl反应的_???????????H???_-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-114.6 kJ·mol-1【出处:21教育名师】
D.500 ℃、30 MPa_???????°?0.5_ mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)??2NH3(g) ΔH=-38.6 kJ·mol-1【来源:21cnj*y.co*m】
二、非选择题(52分)
13.(20分)_????????????è???¨?_中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做量热计。
(2)下列ΔH表示物质燃烧热的是ΔH4、ΔH5;表示物质中和热的是ΔH6。(填ΔH1、ΔH2或ΔH3等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+O2(g)===CO(g) ΔH2
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)===CO2(g) ΔH4
E.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l)
ΔH7
H.CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH8
(3)已知在_101_kP_a、273 K时,15 g乙烷完全燃烧生成CO2和液态水,放出a kJ的热量,下列热化学方程式正确的是C(填字母)。21世纪教育网版权所有
A.C2H6(g)+O2(g)===2CO2(g)+3H2O(l)
ΔH=+2a kJ/mol
B.C2H6(g)+O2(g)===2CO2(g)+3H2O(g)
ΔH=-2a kJ/mol
C.2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l)
ΔH=-4a kJ/mol
D.2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g)
ΔH=-2a kJ/mol
(4)充分燃烧一定量的丁烷放_?????????é?????1_61.9 kJ,生成的CO2恰好与5 mol/L 100 mL KOH溶液完全反应生成正盐,则燃烧1 mol 丁烷放出的热量为2_590.4_kJ。
解析:(2)燃烧热强调1 _mol_??????_质完全燃烧生成稳定氧化物所放出的热量,故ΔH4、ΔH5符合;中和热强调稀的强酸和强碱溶液反应生成1 mol H2O(l)时所放出的热量,故ΔH6符合。(3)15 g乙烷为0.5 mol,故1 mol 乙烷燃烧放出2a kJ热量,2 mol 乙烷燃烧放出4a kJ热量,且ΔH<0,水为液态,可知C正确。(4)根据原子守恒得:n(CO2)=n(KOH)=0.25 mol,1 mol C4H10完全燃烧生成4 mol CO2,故ΔH=-161.9 kJ/mol×=-2 590.4 kJ/mol。21cnjy.com
14.(12分)城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气,它由煤炭与水(蒸气)反应制得,故又称水煤气。21*cnjy*com
(1)试写出制取水煤气的主要化学方程式:C+H2O(g)CO+H2。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ·mol-1
已知CO气体燃烧的热化学方程式为
CO(g)+O2(g)===CO2(g)
ΔH=-282.57 kJ·mol-1
试比较相同物质的量的C3H8和CO燃烧,产生的热量比值约为55?7。
(3)已知氢气燃烧的热化学方程式为
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
试比较相同质量的氢气和丙烷燃烧,产生的热量比值约为14?5。
(4)氢气是未来的重要能源之一,除产生的热量大之外,还具有的优点是资源丰富,无污染。
15.(6分)家用液化气中_??????è???????????_一是丁烷,当1.0 kg丁烷完全燃烧并生成CO2和液态水时,放出的热量为5×104 kJ,试写出丁烷燃烧的热化学方程式C4H10(g)+O2(g)===4CO2(g)+5H2O(l) ΔH=-2 900 kJ/mol,丁烷的燃烧热为2_900 kJ/mol。已知1 mol 液态水汽化时需要吸收44 kJ的热量。C4H10(g)+O2(g)===4CO2(g)+5H2O(g)中的ΔH=-2_680 kJ/mol。【来源:21·世纪·教育·网】
解析:1 kg丁烷完_??¨?????§??????C_O2和液态水时,放出的热量为5×104 kJ,则1 mol丁烷完全燃烧生成CO2和液态水时放出的热量为:=2 900 kJ,故丁烷燃烧的热化学方程式为C4H10(g)+O2(g)===4CO2(g)+5H2O(l)【版权所有:21教育】
ΔH=-2 9_00_kJ/_mol,丁烷的燃烧热为2 900 kJ/mol。当丁烷燃烧生成的5 mol液态水变为气态水时,需吸收5×44=220 kJ的热量,故反应C4H10(g)+O2(g)===4CO2(g)+5H2O(g)中的ΔH=-2 900 kJ/mol+220 kJ/mol=-2 680 kJ/mol。
16.(14分)已知下列热化学方程式:
①H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ·mol-1
②H2(g)+O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热ΔH为-285.8_kJ·mol-1;C的燃烧热为393.5_kJ·mol-1。
(2)燃烧1 g H2生成液态水,放出的热量为142.9_kJ。
(3)已知CO的燃烧热_???283.0_ kJ·mol-1,现有CO、H2和CO2组成的混合气体116.8 L(标准状况),完全燃烧后放出总能量为867.9 kJ,且生成18 g液态水,则混合气体中H2为22.4 L,CO在混合气体中的体积分数约为0.39(精确至小数点后2位)。21教育网
解析:(2)热量Q=n·|ΔH|=×285.8 kJ·mol-1=142.9 kJ。
(3)由m(H2O)=18 g得n(H2O)=1 mol,
则n(H2)=1 mol,V(H2)=22.4 L。
已知Q(H2)=285.8 kJ,则Q(CO)=582.1 kJ,
n(CO)= mol,V(CO)= mol×22.4 L/mol,
所以CO的体积分数=≈0.39。
_21?????????è?????(www.21cnjy.com)_
课时作业3 燃烧热 能源
时间:45分钟 满分:100分
一、选择题(每小题4分,共48分)
1.下列热化学方程式正确的是(ΔH的绝对值均正确)( B )
A.Hg+O2===HgO ΔH=-90.7 kJ·mol-1(反应热)
B.P(s)+Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1(反应热)
C.CH3OH(l)+O2(g)===CO2(g)+2H2O(g)
ΔH=-725.76 kJ·mol-1(燃烧热)
D.NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
解析:热化学_????¨???????é??è??_注明各物质的状态,A项错误;燃烧热是指在101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时释放出的能量,CH3OH完全燃烧应生成二氧化碳气体和液态水,C项错误;中和反应是放热反应,ΔH应小于0,D项错误。
2.已知:
①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1
②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1
下列判断正确的是( B )
A.氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B.相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ2·1·c·n·j·y
C.由①②知,水的热稳定性小于硫化氢
D.②中若生成固态硫,ΔH将增大
解析:由①可知_???H2(g)_+O2(g)===H2O(g) ΔH=-483.6 kJ·mol-1×=-241.8 kJ·mol-1,燃烧热中生成的水应是液态水,A错误;②表示的是1 mol H2S(g)所含有的能量比1 mol H2(g)与1 mol S(g)的混合物所含有的能量少20.1 kJ,故相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ,B项正确;由①②知,水分解比硫化氢分解要多吸收能量,即水不易分解,说明水的稳定性大于硫化氢,C项错误;由于S(g)→S(s),要放热,故②中若生成固态硫,ΔH将减小,D项错误。
3.下列说法不正确的是( D )
A.固体煤变为气体燃料后,燃烧效率将提高
B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.化石燃料在任何条件下都能充分燃烧
解析:固体煤变为气体_????????????????¤§_燃料接触面积,燃烧充分,燃烧效率将提高,A正确;化石燃料中含C、S等元素,在燃烧过程中能产生污染环境的CO、SO2等有害气体,B正确;直接燃烧煤的能源利用率低且产生的污染物多,将煤进行深加工后再燃烧,产生的污染物少,燃烧效率更高,因此效果更好,C正确;化石燃料只有在适当的温度和有足量氧气的条件下才能充分燃烧,D错误。21·世纪*教育网
4.已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g)
ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ·mol-1
③H2(g)+O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
④H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
下列结论正确的是( A )
A.碳的燃烧热大于110.5 kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1 mol 水,放出57.3 kJ热量
C.氢气的燃烧热为241.8 kJ·mol-1
D.碳的燃烧热为110.5 kJ·mol-1
解析:燃烧热是指1 m_ol_??????è?¨_完全燃烧生成稳定的氧化物所放出的热量,C完全燃烧的产物是CO2,CO继续燃烧生成CO2放出热量,则C的燃烧热大于110.5 kJ·mol-1;浓硫酸中的H+与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量,但是浓硫酸的稀释又有热量释放,所以该反应过程放出的热量大于57.3 kJ。www-2-1-cnjy-com
5.下列说法正确的是( B )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol21*cnjy*com
B.已知NaOH(aq)_???HCl(a_q)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含0.5 mol NaOH的稀溶液与稀醋酸完全中和,放出的热量小于28.7 kJ
C.可燃物的系数为1的燃烧反应的焓变即为该可燃物的燃烧热
D.已知2C(s)+2_O2(g)=_==2CO2(g) ΔH=a kJ/mol,2C(s)+O2(g)===2CO(g) ΔH=b kJ/mol,则a>b
解析:A选项错误,燃烧热指_?????????????°????_出的热量,不是生成气态水;B选项正确,因为醋酸电离吸收热量,所以放出的热量会略小;C选项错误,表示燃烧热的反应除可燃物系数为1,还必须注意产物及各物质的状态;D选项错误,生成CO放出的热量数值偏小,则ΔH的值偏大,故选B。
6.已知化学反应:CO2(g)===CO(g) ΔH1<0;CO(g)+O2(g)===CO2(g) ΔH2<0;C(s)+O2(g)===CO2(g) ΔH3<0;下列说法正确的是(相同条件下)( B )
A.56 g CO和32 g O2 的总能量小于88 g CO2的能量
B.碳的燃烧热是ΔH3
C.ΔH1<ΔH3
D.28 g CO的能量比44 g CO2的能量高
解析:CO燃烧是放热反应,反应物的总能量大于生成物的总能量,A错误;D中忽略了O2的能量,错误;比较ΔH时必须带符号,C错误。21教育名师原创作品
7.已知热化_???????¨????2H_2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ/mol,则下列关于热化学方程式2H2O(l)===2H2(g)+O2(g) ΔH2的说法正确的是( B )
A.热化学方程式中的化学计量数表示分子数
B.该反应中的ΔH2>0
C.该反应中的ΔH2=-571.6 kJ/mol
D.该反应与题述反应互为可逆反应
解析:热化学方程式中的化学计_é????°è?¨?¤????è?¨_的量,不表示分子数。该反应是2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ/mol逆向进行的反应,ΔH2=+571.6 kJ/mol,但该反应与题述反应不互为可逆反应,因二者的反应条件不相同。
8.已知H2的燃烧热_???285.8_ kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况),充分燃烧后,放出热量710.0 kJ,并生成液态水。下列说法正确的是( C )
A.CO燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g)
ΔH=+282.8 kJ/mol
B.H2燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(g)
ΔH=-571.6 kJ/mol
C.燃烧前的混合气体中,H2的体积分数为40%
D.混合气体燃烧后与足量的过氧化钠反应,转移电子2 mol
解析:A项,1 mo_l_CO?????§_生成1 mol CO2放热282.8 kJ,ΔH<0,错误。B项,由于题目中已知H2的燃烧热,因此生成的H2O应为液态,错误。设56.0 L混合气体中含H2的物质的量为x,CO的物质的量为y,列式x+y==2.5 mol ①,285.8 kJ·mol-1x+282.8 kJ·mol-1y=710.0 kJ ②,联立①②解得x=1 mol,则H2的体积分数为×100%=40%,C项正确。混合气体燃烧后生成H2O、CO2共2.5 mol,与足量的过氧化钠反应能产生O2 1.25 mol,转移电子总数为2.5 mol,D项错误。www.21-cn-jy.com
9.充分燃烧_??????é??????????·_气体放出的热量为Q。完全吸收它生成的CO2气体生成正盐,需5 mol/L的KOH溶液100 mL,则丁烷的燃烧热为( A )
A.16Q B.8Q
C.4Q D.2Q
解析:由题意可得关系式:
C4H10~4CO2~8KOH~4K2CO3
1 8
x 5 mol/L×0.1 L=0.5 mol
得x=6.25×1_0???2_mo_l,即得6.25×10-2 mol丁烷充分燃烧放出热量Q,则1 mol丁烷充分燃烧会放出16Q的热量,故选A项。
10.已知:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
CO(g)+O2(g)===CO2(g)
ΔH=-282.9 kJ·mol-1
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,则原混合气体中H2和CO的物质的量之比为( C )
A.2?1 B.1?2
C.1?1 D.2?3
解析:根据热化学方_?¨?????????????H_2的燃烧热为571.6 kJ·mol-1÷2=285.8 kJ·mol-1,生成的n(H2O)==0.2 mol,参加反应的H2为0.2 mol,故H2燃烧放出的热量为0.2 mol×285.8 kJ·mol-1=57.16 kJ。CO燃烧放出的热量为113.74 kJ-57.16 kJ=56.58 kJ,CO的燃烧热为282.9 kJ·mol-1,故n(CO)===0.2 mol。则n(H2)?n(CO)=1?1。
11.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g)
ΔH=-192.9 kJ·mol-1
下列说法正确的是( D )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
解析:A项燃烧热是指在_101_kP_a时,1 mol物质完全燃烧生成稳定氧化物时放出的热量,而反应②中生成H2(g),故该项错误;B项反应①是吸热反应,而图中所示是放热反应,故B项错误;C项由题给两个方程式知,CH3OH转变成H2可吸热,也可放热,故C项错误;由CH3OH(g)===CH3OH(l) ΔH<0可知,D项正确。21·cn·jy·com
12.下列说法正确的是( B )
A.甲烷的标准燃烧热为890_.3_kJ?·_mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-12-1-c-n-j-y
B.CO(g)的燃烧_??????283._0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)的反应热ΔH=+566 kJ·mol-1
C.NaOH和HCl反应的_???????????H???_-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-114.6 kJ·mol-1【出处:21教育名师】
D.500 ℃、30 MPa_???????°?0.5_ mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)??2NH3(g) ΔH=-38.6 kJ·mol-1【来源:21cnj*y.co*m】
二、非选择题(52分)
13.(20分)_????????????è???¨?_中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做量热计。
(2)下列ΔH表示物质燃烧热的是ΔH4、ΔH5;表示物质中和热的是ΔH6。(填ΔH1、ΔH2或ΔH3等)
A.2H2(g)+O2(g)===2H2O(l) ΔH1
B.C(s)+O2(g)===CO(g) ΔH2
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH3
D.C(s)+O2(g)===CO2(g) ΔH4
E.C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l)
ΔH7
H.CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH8
(3)已知在_101_kP_a、273 K时,15 g乙烷完全燃烧生成CO2和液态水,放出a kJ的热量,下列热化学方程式正确的是C(填字母)。21世纪教育网版权所有
A.C2H6(g)+O2(g)===2CO2(g)+3H2O(l)
ΔH=+2a kJ/mol
B.C2H6(g)+O2(g)===2CO2(g)+3H2O(g)
ΔH=-2a kJ/mol
C.2C2H6(g)+7O2(g)===4CO2(g)+6H2O(l)
ΔH=-4a kJ/mol
D.2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g)
ΔH=-2a kJ/mol
(4)充分燃烧一定量的丁烷放_?????????é?????1_61.9 kJ,生成的CO2恰好与5 mol/L 100 mL KOH溶液完全反应生成正盐,则燃烧1 mol 丁烷放出的热量为2_590.4_kJ。
解析:(2)燃烧热强调1 _mol_??????_质完全燃烧生成稳定氧化物所放出的热量,故ΔH4、ΔH5符合;中和热强调稀的强酸和强碱溶液反应生成1 mol H2O(l)时所放出的热量,故ΔH6符合。(3)15 g乙烷为0.5 mol,故1 mol 乙烷燃烧放出2a kJ热量,2 mol 乙烷燃烧放出4a kJ热量,且ΔH<0,水为液态,可知C正确。(4)根据原子守恒得:n(CO2)=n(KOH)=0.25 mol,1 mol C4H10完全燃烧生成4 mol CO2,故ΔH=-161.9 kJ/mol×=-2 590.4 kJ/mol。21cnjy.com
14.(12分)城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气,它由煤炭与水(蒸气)反应制得,故又称水煤气。21*cnjy*com
(1)试写出制取水煤气的主要化学方程式:C+H2O(g)CO+H2。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ·mol-1
已知CO气体燃烧的热化学方程式为
CO(g)+O2(g)===CO2(g)
ΔH=-282.57 kJ·mol-1
试比较相同物质的量的C3H8和CO燃烧,产生的热量比值约为55?7。
(3)已知氢气燃烧的热化学方程式为
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
试比较相同质量的氢气和丙烷燃烧,产生的热量比值约为14?5。
(4)氢气是未来的重要能源之一,除产生的热量大之外,还具有的优点是资源丰富,无污染。
15.(6分)家用液化气中_??????è???????????_一是丁烷,当1.0 kg丁烷完全燃烧并生成CO2和液态水时,放出的热量为5×104 kJ,试写出丁烷燃烧的热化学方程式C4H10(g)+O2(g)===4CO2(g)+5H2O(l) ΔH=-2 900 kJ/mol,丁烷的燃烧热为2_900 kJ/mol。已知1 mol 液态水汽化时需要吸收44 kJ的热量。C4H10(g)+O2(g)===4CO2(g)+5H2O(g)中的ΔH=-2_680 kJ/mol。【来源:21·世纪·教育·网】
解析:1 kg丁烷完_??¨?????§??????C_O2和液态水时,放出的热量为5×104 kJ,则1 mol丁烷完全燃烧生成CO2和液态水时放出的热量为:=2 900 kJ,故丁烷燃烧的热化学方程式为C4H10(g)+O2(g)===4CO2(g)+5H2O(l)【版权所有:21教育】
ΔH=-2 9_00_kJ/_mol,丁烷的燃烧热为2 900 kJ/mol。当丁烷燃烧生成的5 mol液态水变为气态水时,需吸收5×44=220 kJ的热量,故反应C4H10(g)+O2(g)===4CO2(g)+5H2O(g)中的ΔH=-2 900 kJ/mol+220 kJ/mol=-2 680 kJ/mol。
16.(14分)已知下列热化学方程式:
①H2(g)+O2(g)===H2O(l)
ΔH=-285.8 kJ·mol-1
②H2(g)+O2(g)===H2O(g)
ΔH=-241.8 kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热ΔH为-285.8_kJ·mol-1;C的燃烧热为393.5_kJ·mol-1。
(2)燃烧1 g H2生成液态水,放出的热量为142.9_kJ。
(3)已知CO的燃烧热_???283.0_ kJ·mol-1,现有CO、H2和CO2组成的混合气体116.8 L(标准状况),完全燃烧后放出总能量为867.9 kJ,且生成18 g液态水,则混合气体中H2为22.4 L,CO在混合气体中的体积分数约为0.39(精确至小数点后2位)。21教育网
解析:(2)热量Q=n·|ΔH|=×285.8 kJ·mol-1=142.9 kJ。
(3)由m(H2O)=18 g得n(H2O)=1 mol,
则n(H2)=1 mol,V(H2)=22.4 L。
已知Q(H2)=285.8 kJ,则Q(CO)=582.1 kJ,
n(CO)= mol,V(CO)= mol×22.4 L/mol,
所以CO的体积分数=≈0.39。
_21?????????è?????(www.21cnjy.com)_
