湖北省武汉市部分学校11-12学年高三新起点调研测试(化学)
文档属性
| 名称 | 湖北省武汉市部分学校11-12学年高三新起点调研测试(化学) |  | |
| 格式 | zip | ||
| 文件大小 | 992.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-09-14 23:33:51 | ||
图片预览


文档简介
武汉市部分学校2011—2012学年度高三新起点调研测试
化 学 试 题
注意事项:
1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。满分 100 分。考试用时 90 分钟。
2.答卷前,考生务必将自己的姓名、准考证号填写在试卷的答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
3.选择题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。非选择题用黑色墨水的签字笔或钢笔直接答在答题卡上。答在试题卷上无效。
4.考试结束,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量: H 一1 C 一 12 N 一 14 O一 16 Na 一23 Al 一27
Fe 一 56 Cu 一64
可能用到的数据:=2.61 =8.25 =1.89 =4.08
第I卷(选择题,共45分)
一、选择题(本题共15小题,每小题 3 分,共 45 分,每小题只有一个正确答案)
1.在盛装浓硫酸试剂瓶的标签上印有的警示标记是: ( )
2.下列化学用语正确的是: ( )
A .Na2S 的电子式: B.Clˉ的结构示意图:
C.I—131 : 78 53I D.乙烯的结构式:CH2=CH2
3.用 NA 表示阿伏加德罗常数的值,下列说法正确的是: ( )
A.在 lmol/ L 的 AlCl3溶液中,A13+的个数小于 NA
B.1 mol 碳烯(:CH2)中含有电子数为8NA
C.标准状况下, lL 己烷的分子数为
D.1 mol C4Hl0分子中含有的共价键数无法确定
4.用量最大、用途最广的合金是 ( )
A.铁合金 B.铝合金 C.铜合金 D.钦合金
5.下列关系不正确的是: ( )
A.离子半径:Clˉ> F ˉ> Na+ > Al3+
B.熔点:石英>食盐>冰>干冰
C.结合氢离子的能力:SO42ˉ> SO32ˉ> CO32ˉ
D.热稳定性: HF > HCI > H2S > PH3
6.常温下,下列各组离子在指定溶液中可能大量共存的是: ( )
A.滴人甲基橙显红色的溶液中: Na+、NO3ˉ、 Iˉ、SO32ˉ
B.水电离出的 c ( H+) = 10ˉ12 mol/L 的溶液中:K+、 AlO2ˉ、 CH3COOˉ、SiO32ˉ
C.=10ˉ12 的溶液中: K+、ClOˉ、S2ˉ、 Clˉ
D.c ( Fe 3+ ) = 0 .1 mol/L 的溶液中: K+、ClOˉ 、SO42ˉ、 SCNˉ
7.能区别 NaCl 、 AgCl 、CuSO4、 MgCl2 四种固体的试剂是 ( )
A.蒸馏水 B.蒸馏水、硝酸
C.蒸馏水、氨水 D.蒸馏水、 BaC12 溶液
8.关于甲醛(CH2O)分子,下列说法不正确的是: ( )
①分子中碳原子采用。 SP2杂化; ②分子中所有原子处于同一平面上;
③分子中每个原子都达到 8 电子稳定结构;④分子的立体构型为四面体
A.① ② B.② ③ C.③ ④ D.① ④
9.下列解释原理的表达式中,不正确的是: ( )
A.镁的冶炼:
B.用热的纯碱溶液清洗油污:
C.用Na2CO3溶液处理水垢中的CaCO4:
D.用氢氟酸刻蚀玻璃:4HF+SiO2=SiF4↑+2H2O
10.在常温下,将一定体积的某 NaOH 溶液分成两等分,与pH 均为2的一元酸 HA、HB恰好中和,消耗两种酸溶液的体积分别为V1、V2(V1≠V2)。则下列叙述中正确的是: ( )
A.若 Vl>V2,则说明 HA 的酸性比 HB的酸性强
B.中和后得到的两种溶液的 pH 均为 7
C.分别将两种酸溶液稀释10 倍后溶液的 pH 均为3
D.分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的 H2的体积相等
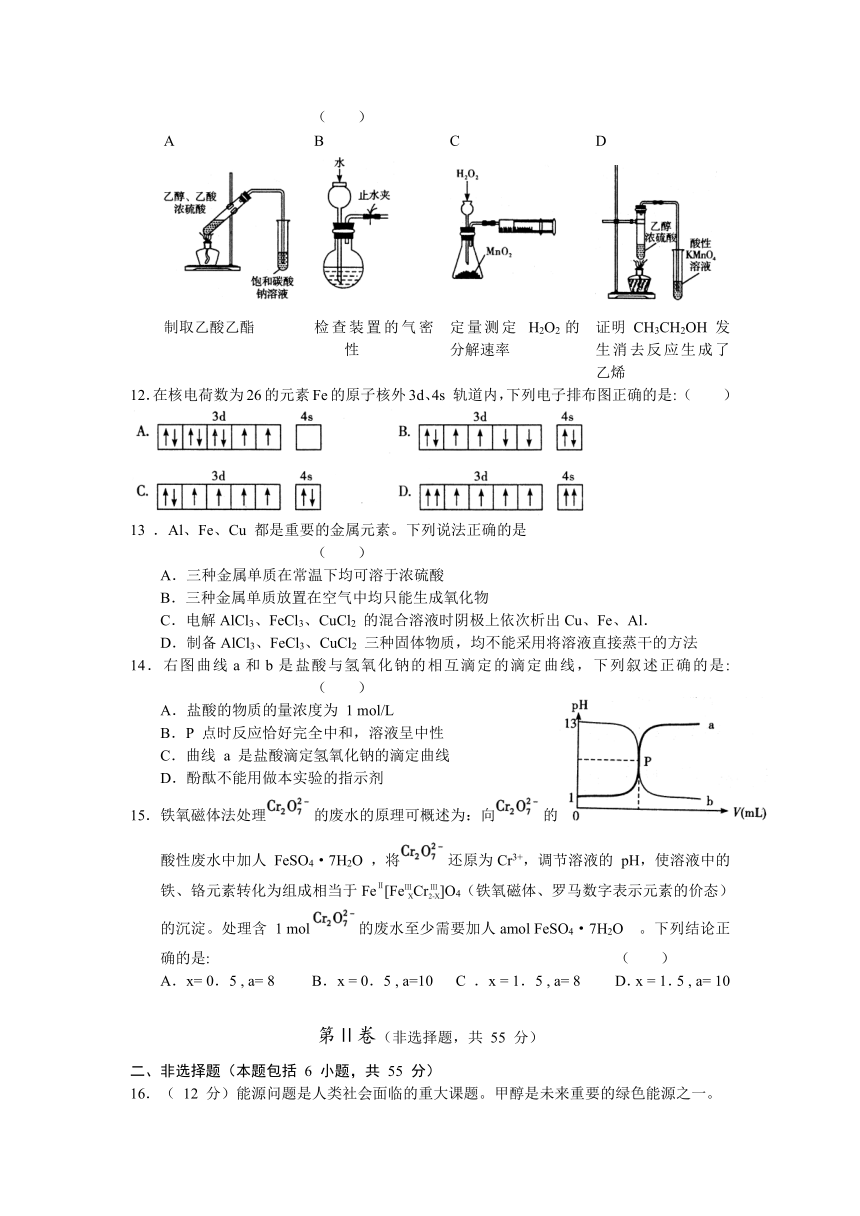
11.用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是: ( )
A B C D
制取乙酸乙酯 检查装置的气密性 定量测定 H2O2的分解速率 证明 CH3CH2OH 发生消去反应生成了乙烯
12.在核电荷数为26的元素Fe的原子核外3d、4s 轨道内,下列电子排布图正确的是: ( )
13 .Al、Fe、Cu 都是重要的金属元素。下列说法正确的是 ( )
A.三种金属单质在常温下均可溶于浓硫酸
B.三种金属单质放置在空气中均只能生成氧化物
C.电解AlCl3、FeCl3、CuCl2 的混合溶液时阴极上依次析出Cu、Fe、Al.
D.制备AlCl3、FeCl3、CuCl2 三种固体物质,均不能采用将溶液直接蒸干的方法
14.右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是: ( )
A.盐酸的物质的量浓度为 1 mol/L
B.P 点时反应恰好完全中和,溶液呈中性
C.曲线 a 是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用做本实验的指示剂
15.铁氧磁体法处理的废水的原理可概述为:向的
酸性废水中加人 FeSO4·7H2O ,将还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是: ( )
A.x= 0.5 , a= 8 B.x = 0.5 , a=10 C .x = 1.5 , a= 8 D.x = 1.5 , a= 10
第Ⅱ卷(非选择题,共 55 分)
二、非选择题(本题包括 6 小题,共 55 分)
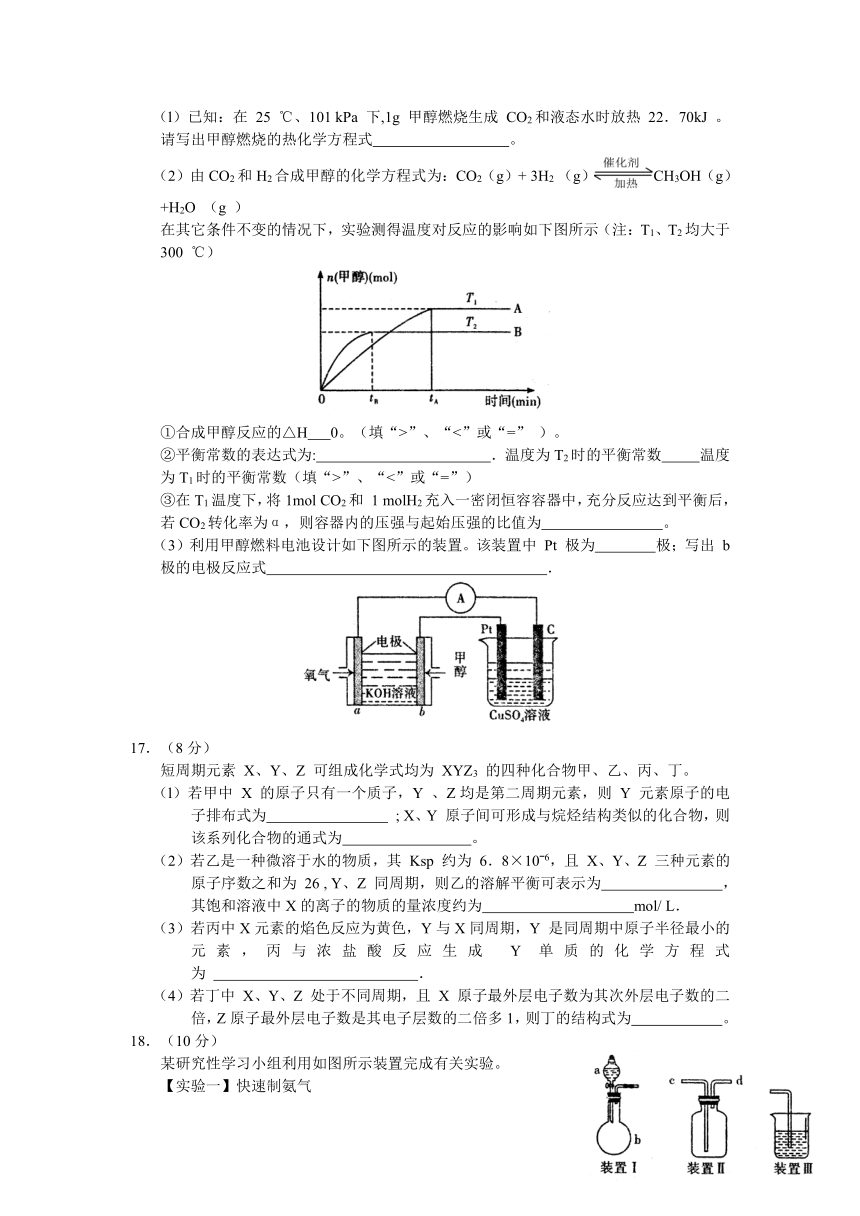
16.( 12 分)能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ 。请写出甲醇燃烧的热化学方程式 。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+ 3H2 (g)CH3OH(g)+H2O (g )
在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
①合成甲醇反应的△H 0。(填“>”、“<”或“=” )。
②平衡常数的表达式为: .温度为T2时的平衡常数 温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为 。
(3)利用甲醇燃料电池设计如下图所示的装置。该装置中 Pt 极为 极;写出 b极的电极反应式 .
17.(8分)
短周期元素 X、Y、Z 可组成化学式均为 XYZ3 的四种化合物甲、乙、丙、丁。
(l)若甲中 X 的原子只有一个质子,Y 、Z均是第二周期元素,则 Y 元素原子的电子排布式为 ; X、Y 原子间可形成与烷烃结构类似的化合物,则该系列化合物的通式为 。
(2)若乙是一种微溶于水的物质,其 Ksp 约为 6.8×10ˉ6,且 X、Y、Z 三种元素的原子序数之和为 26 , Y、Z 同周期,则乙的溶解平衡可表示为 ,其饱和溶液中X的离子的物质的量浓度约为 mol/ L.
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 .
(4)若丁中 X、Y、Z 处于不同周期,且 X 原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为 。
18.(10分)
某研究性学习小组利用如图所示装置完成有关实验。
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可
加入浓氨水,b仪器中加入 。装置Ⅱ
从 管口进气可作为氨气的收集装置。
【实验二】收集 NO
(2)利用装置Ⅱ可收集 NO,试简述操作方法:
。
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成下列表格(可以不填满,也可以再加行)
装置序号 仪器中所加物质名称 现象
19.(8分)
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
请回答下列问题:
(1) A 的化学名称是 ;
(2) B 和 A 反应生成 C 的化学方程式为 ,该反应的类型为 ;
(3) D 是环状化合物,它的结构简式为 ;
(4) F 的结构简式为 。
20.(6分)
水是生命之源,它与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
(1)水分子与H+形成水合氢离子( H3O + )的立体构型为 。
(2)冰是立方面心结构。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中与冰的晶体类型相同的是 ;(填写编号)。
(3) 在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmd 氢键所需的能量即为氢键的“键能”)是
KJ kJ / mol 。
21.(11分)
钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3 ,含FeO、Al2O3、SiO2 等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是: .
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是: 。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为: .
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12 (g)TICl4(l) +O2 (g)顺利进行的原因是: .
化 学 试 题
注意事项:
1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。满分 100 分。考试用时 90 分钟。
2.答卷前,考生务必将自己的姓名、准考证号填写在试卷的答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
3.选择题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。非选择题用黑色墨水的签字笔或钢笔直接答在答题卡上。答在试题卷上无效。
4.考试结束,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量: H 一1 C 一 12 N 一 14 O一 16 Na 一23 Al 一27
Fe 一 56 Cu 一64
可能用到的数据:=2.61 =8.25 =1.89 =4.08
第I卷(选择题,共45分)
一、选择题(本题共15小题,每小题 3 分,共 45 分,每小题只有一个正确答案)
1.在盛装浓硫酸试剂瓶的标签上印有的警示标记是: ( )
2.下列化学用语正确的是: ( )
A .Na2S 的电子式: B.Clˉ的结构示意图:
C.I—131 : 78 53I D.乙烯的结构式:CH2=CH2
3.用 NA 表示阿伏加德罗常数的值,下列说法正确的是: ( )
A.在 lmol/ L 的 AlCl3溶液中,A13+的个数小于 NA
B.1 mol 碳烯(:CH2)中含有电子数为8NA
C.标准状况下, lL 己烷的分子数为
D.1 mol C4Hl0分子中含有的共价键数无法确定
4.用量最大、用途最广的合金是 ( )
A.铁合金 B.铝合金 C.铜合金 D.钦合金
5.下列关系不正确的是: ( )
A.离子半径:Clˉ> F ˉ> Na+ > Al3+
B.熔点:石英>食盐>冰>干冰
C.结合氢离子的能力:SO42ˉ> SO32ˉ> CO32ˉ
D.热稳定性: HF > HCI > H2S > PH3
6.常温下,下列各组离子在指定溶液中可能大量共存的是: ( )
A.滴人甲基橙显红色的溶液中: Na+、NO3ˉ、 Iˉ、SO32ˉ
B.水电离出的 c ( H+) = 10ˉ12 mol/L 的溶液中:K+、 AlO2ˉ、 CH3COOˉ、SiO32ˉ
C.=10ˉ12 的溶液中: K+、ClOˉ、S2ˉ、 Clˉ
D.c ( Fe 3+ ) = 0 .1 mol/L 的溶液中: K+、ClOˉ 、SO42ˉ、 SCNˉ
7.能区别 NaCl 、 AgCl 、CuSO4、 MgCl2 四种固体的试剂是 ( )
A.蒸馏水 B.蒸馏水、硝酸
C.蒸馏水、氨水 D.蒸馏水、 BaC12 溶液
8.关于甲醛(CH2O)分子,下列说法不正确的是: ( )
①分子中碳原子采用。 SP2杂化; ②分子中所有原子处于同一平面上;
③分子中每个原子都达到 8 电子稳定结构;④分子的立体构型为四面体
A.① ② B.② ③ C.③ ④ D.① ④
9.下列解释原理的表达式中,不正确的是: ( )
A.镁的冶炼:
B.用热的纯碱溶液清洗油污:
C.用Na2CO3溶液处理水垢中的CaCO4:
D.用氢氟酸刻蚀玻璃:4HF+SiO2=SiF4↑+2H2O
10.在常温下,将一定体积的某 NaOH 溶液分成两等分,与pH 均为2的一元酸 HA、HB恰好中和,消耗两种酸溶液的体积分别为V1、V2(V1≠V2)。则下列叙述中正确的是: ( )
A.若 Vl>V2,则说明 HA 的酸性比 HB的酸性强
B.中和后得到的两种溶液的 pH 均为 7
C.分别将两种酸溶液稀释10 倍后溶液的 pH 均为3
D.分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的 H2的体积相等
11.用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是: ( )
A B C D
制取乙酸乙酯 检查装置的气密性 定量测定 H2O2的分解速率 证明 CH3CH2OH 发生消去反应生成了乙烯
12.在核电荷数为26的元素Fe的原子核外3d、4s 轨道内,下列电子排布图正确的是: ( )
13 .Al、Fe、Cu 都是重要的金属元素。下列说法正确的是 ( )
A.三种金属单质在常温下均可溶于浓硫酸
B.三种金属单质放置在空气中均只能生成氧化物
C.电解AlCl3、FeCl3、CuCl2 的混合溶液时阴极上依次析出Cu、Fe、Al.
D.制备AlCl3、FeCl3、CuCl2 三种固体物质,均不能采用将溶液直接蒸干的方法
14.右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是: ( )
A.盐酸的物质的量浓度为 1 mol/L
B.P 点时反应恰好完全中和,溶液呈中性
C.曲线 a 是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用做本实验的指示剂
15.铁氧磁体法处理的废水的原理可概述为:向的
酸性废水中加人 FeSO4·7H2O ,将还原为Cr3+,调节溶液的 pH,使溶液中的铁、铬元素转化为组成相当于FeⅡ[FeⅢ XCrⅢ 2-X]O4(铁氧磁体、罗马数字表示元素的价态)的沉淀。处理含 1 mol的废水至少需要加人amol FeSO4·7H2O 。下列结论正确的是: ( )
A.x= 0.5 , a= 8 B.x = 0.5 , a=10 C .x = 1.5 , a= 8 D.x = 1.5 , a= 10
第Ⅱ卷(非选择题,共 55 分)
二、非选择题(本题包括 6 小题,共 55 分)
16.( 12 分)能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ 。请写出甲醇燃烧的热化学方程式 。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+ 3H2 (g)CH3OH(g)+H2O (g )
在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)
①合成甲醇反应的△H 0。(填“>”、“<”或“=” )。
②平衡常数的表达式为: .温度为T2时的平衡常数 温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为 。
(3)利用甲醇燃料电池设计如下图所示的装置。该装置中 Pt 极为 极;写出 b极的电极反应式 .
17.(8分)
短周期元素 X、Y、Z 可组成化学式均为 XYZ3 的四种化合物甲、乙、丙、丁。
(l)若甲中 X 的原子只有一个质子,Y 、Z均是第二周期元素,则 Y 元素原子的电子排布式为 ; X、Y 原子间可形成与烷烃结构类似的化合物,则该系列化合物的通式为 。
(2)若乙是一种微溶于水的物质,其 Ksp 约为 6.8×10ˉ6,且 X、Y、Z 三种元素的原子序数之和为 26 , Y、Z 同周期,则乙的溶解平衡可表示为 ,其饱和溶液中X的离子的物质的量浓度约为 mol/ L.
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 .
(4)若丁中 X、Y、Z 处于不同周期,且 X 原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为 。
18.(10分)
某研究性学习小组利用如图所示装置完成有关实验。
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可
加入浓氨水,b仪器中加入 。装置Ⅱ
从 管口进气可作为氨气的收集装置。
【实验二】收集 NO
(2)利用装置Ⅱ可收集 NO,试简述操作方法:
。
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成下列表格(可以不填满,也可以再加行)
装置序号 仪器中所加物质名称 现象
19.(8分)
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
请回答下列问题:
(1) A 的化学名称是 ;
(2) B 和 A 反应生成 C 的化学方程式为 ,该反应的类型为 ;
(3) D 是环状化合物,它的结构简式为 ;
(4) F 的结构简式为 。
20.(6分)
水是生命之源,它与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
(1)水分子与H+形成水合氢离子( H3O + )的立体构型为 。
(2)冰是立方面心结构。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中与冰的晶体类型相同的是 ;(填写编号)。
(3) 在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmd 氢键所需的能量即为氢键的“键能”)是
KJ kJ / mol 。
21.(11分)
钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3 ,含FeO、Al2O3、SiO2 等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是: .
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是: 。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为: .
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12 (g)TICl4(l) +O2 (g)顺利进行的原因是: .
同课章节目录
