人教版高中化学选修三第三章第四节离子晶体(共36张ppt)
文档属性
| 名称 | 人教版高中化学选修三第三章第四节离子晶体(共36张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-28 10:56:43 | ||
图片预览





文档简介
(共36张PPT)
第四节
离子晶体
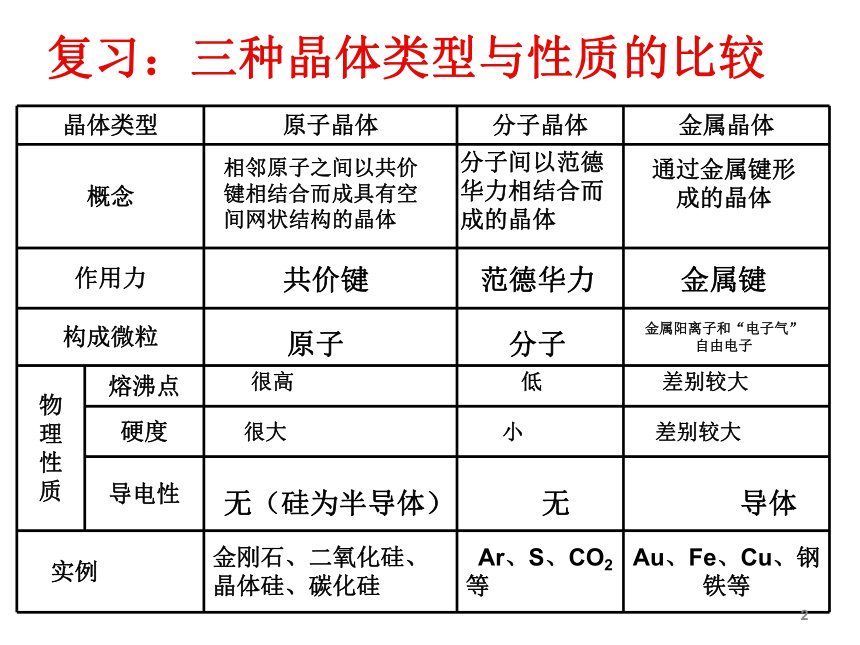
复习:三种晶体类型与性质的比较
晶体类型
原子晶体
分子晶体
金属晶体
概念
作用力
构成微粒
物
理
性
质
熔沸点
硬度
导电性
实例
金刚石、二氧化硅、晶体硅、碳化硅
Ar、S、CO2等
Au、Fe、Cu、钢铁等
相邻原子之间以共价键相结合而成具有空间网状结构的晶体
分子间以范德华力相结合而成的晶体
通过金属键形成的晶体
共价键
范德华力
金属键
原子
分子
金属阳离子和“电子气”自由电子
很高
低
差别较大
很大
小
差别较大
无(硅为半导体)
无
导体
一、离子晶体
1、定义:由阳离子和阴离子通过离
子键结合而成的晶体。
2、成键粒子:阴、阳离子
3、相互作用力:离子键
4、常见离子晶体(含离子键的化合物)
强碱、活泼金属氧化物、大部分的盐类
活泼金属元素(IA、IIA等)与
活泼非金属元素(VIA、VIIA等)
形成化合物的元素的电负性的差>1.7
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
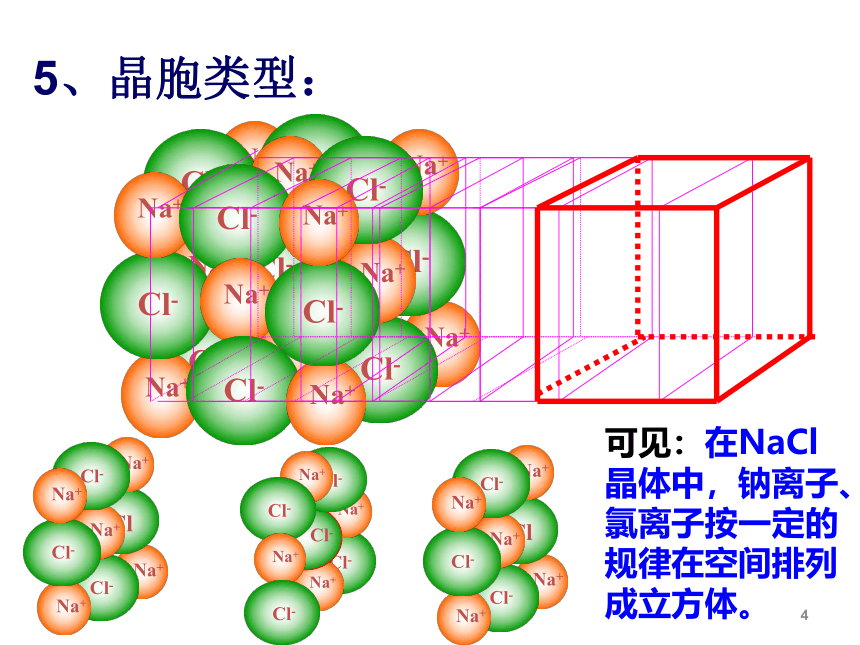
可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。
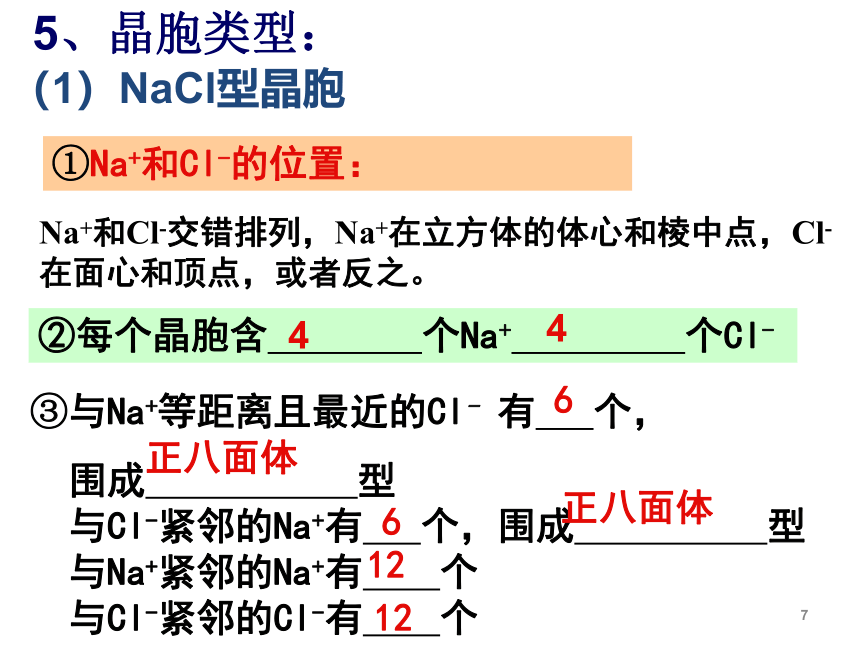
5、晶胞类型:
---Cl-
---
Na+
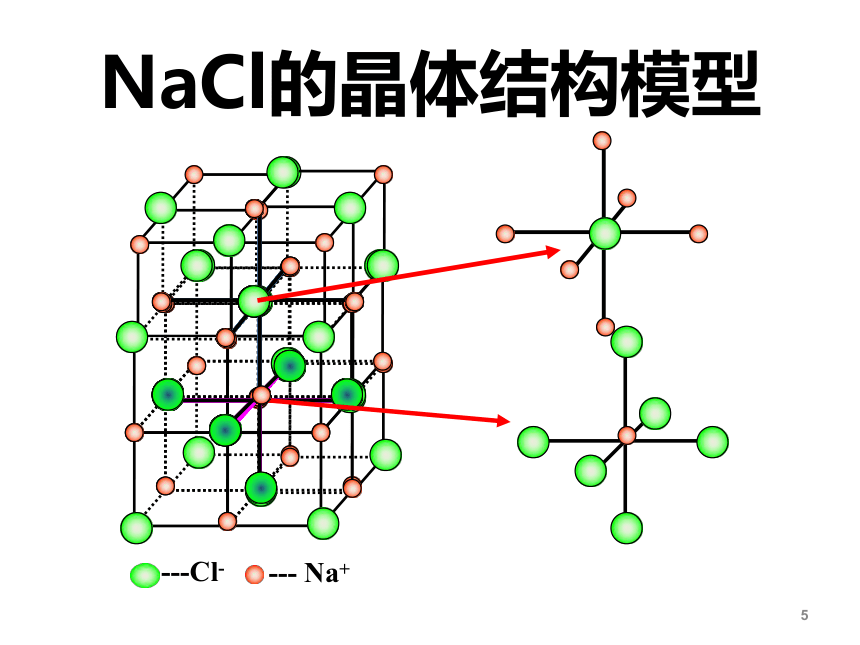
NaCl的晶体结构模型
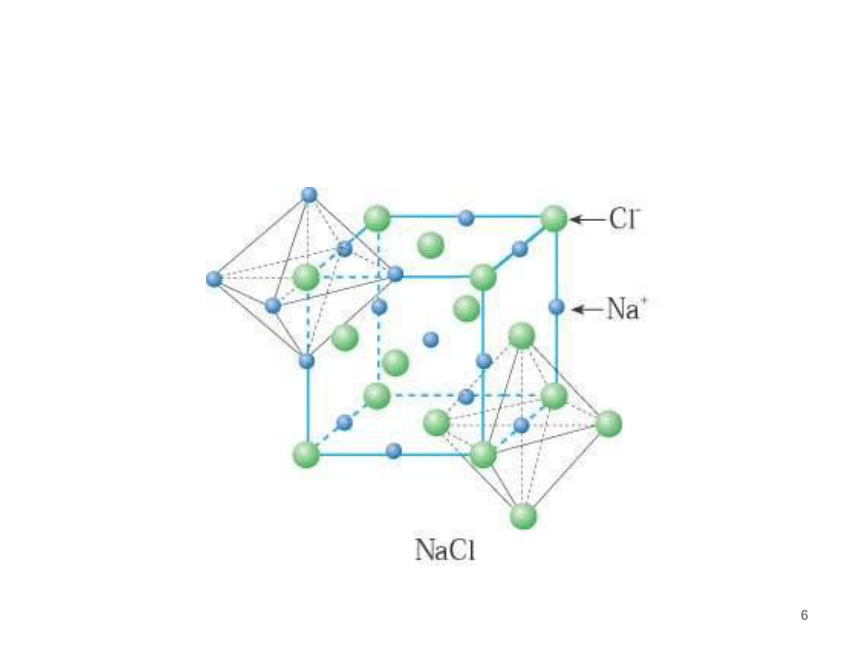
①Na+和Cl-的位置:
Na+和Cl-交错排列,Na+在立方体的体心和棱中点,Cl-在面心和顶点,或者反之。
5、晶胞类型:
(1)NaCl型晶胞
②每个晶胞含
个Na+
个Cl-
4
4
③与Na+等距离且最近的Cl-
有
个,
围成
型
与Cl-紧邻的Na+有
个,围成
型
与Na+紧邻的Na+有
个
与Cl-紧邻的Cl-有
个
6
6
12
12
正八面体
正八面体
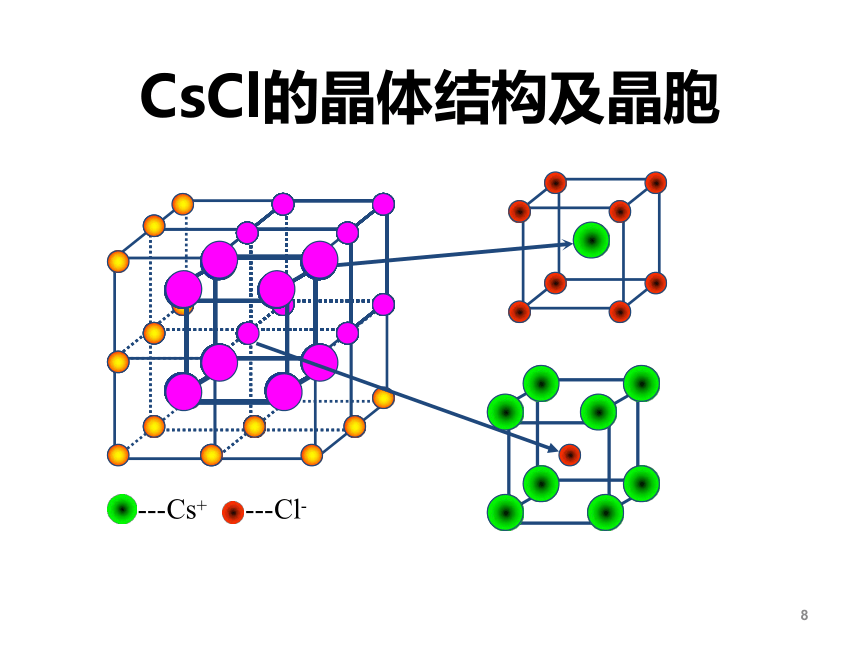
---Cs+
---Cl-
CsCl的晶体结构及晶胞
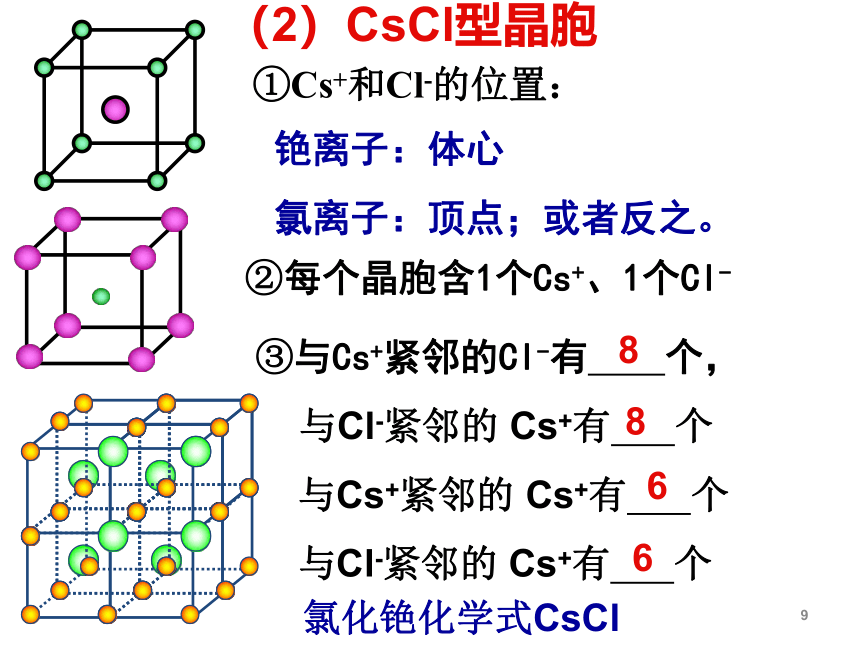
①Cs+和Cl-的位置:
铯离子:体心
氯离子:顶点;或者反之。
②每个晶胞含1个Cs+、1个Cl-
③与Cs+紧邻的Cl-有
个,
与Cl-紧邻的
Cs+有
个
与Cs+紧邻的
Cs+有
个
与Cl-紧邻的
Cs+有
个
(2)CsCl型晶胞
8
8
6
6
氯化铯化学式CsCl
配位数:离子晶体中离子的配位数是指一个离子周围最邻近的异电性离子的数目(缩写C.N.)
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
6
6
8
8
(3)CaF2型晶胞
③Ca2+的配位数:
8
②F-的配位数:
4
①一个CaF2晶胞中含:
4个Ca2+和8个F-
(4)ZnS型晶胞
①阳离子的配位数:4
②阴离子的配位数:4
③一个ZnS晶胞中含:
4个阳离子和4个阴离子
和金刚石相同
科学探究:
离子
Na+
Cs+
Cl-
离子半径/pm
95
169
181
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
NaCl
CsCl
r+/r-
=
r+/r-
=
C.N.=6
C.N.=8
0.525
0.934
6、决定离子晶体结构的因素
(1)几何因素:
晶体中正负离子的半径比决定正负离子的配位数
(2)电荷因素:
晶体中正负离子的电荷比(绝对值)决定正负离子配位数是否相等
(3)键性因素:
离子晶体的结构类型还与离子键的纯粹程度(简称键性因素),即与晶体中正负离子的相互极化程度有关。
配位数
4
6
8
半径比
0.2~0.4
0.4~0.7
0.7~1.0
空间构型
ZnS
NaCl
CsCl
科学视野
[阅读]
碳酸盐热分解的实质是什么?
金属阳离子半径越小,碳酸盐的热稳定性越差
结构:碳酸盐的分解温度与金属阳离子所带的电荷及阳离子半径有关
思考:碳酸盐的稳定性与什么因素有关。
离子晶体的物理性质:
(1)熔沸点较高,难挥发
【阴阳离子电荷数越多,离子半径越小则离子键越强,熔沸点越高】
(2)硬而脆、难压缩
(3)离子晶体不导电,水溶液或熔融状态下均导电
(4)大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂
二、晶格能
1、定义:
气态离子形成1摩离子晶体时释放的能量。
(晶格能是最能反映离子晶体稳定性的数据)
2、影响晶格能的大小的因素
:
(1)阴、阳离子所带电荷越多晶格能越大。
(2)阴、阳离子的半径越小,晶格能越大。
3、晶格能的作用
晶格能越大:
形成的离子晶体越稳定;(离子键越强)
熔点越高;
硬度越大。
晶格能也影响了岩浆晶出的次序,晶格能越大,岩浆中的矿物越易结晶析出
某些离子晶体的晶格能
F-
Cl-
Br-
I-
Li+
Na+
K+
Rb+
Cs+
1036
923
821
785
740
853
786
715
689
659
807
747
682
660
631
757
704
649
630
604
卤化钠及碱土金属离子晶体
各类型离子晶体晶胞的比较
晶体类型
晶胞类型
晶胞结构示意图
配位数
距离最近且相等的相反离子
每个晶胞含有离子数
实例
NaCl型
AB
CsCl型
ZnS型
AB2
CaF2型
Na+:
6
Cl-:
6
Cs+:
Cl-:
8
8
Zn2+:
S2-:
4
4
Ca2+:
F-:
4
8
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
6
6
8
8
4
4
4
8
4
4
1
1
4
4
8
4
KBr
AgCl、MgO、CaS、BaSe
ZnS、AgI、
BeO
CsCl、CsBr、CsI、
碱土金属卤化物、碱金属氧化物。
教学重点难点:
1、离子晶体的物理性质的特点
2、离子晶体配位数及其影响因素
3、晶格能的定义和应用
【总结归纳】物质的熔点与晶体类型的关系
1、若晶体类型不同,一般情况下:原子晶体>离子晶体>分子晶体。
2、若晶体类型相同,则有:
⑴离子晶体中,结构相似时,离子半径越小,离子电荷越高,晶格能越大,离子键就越强,熔点就越高。
⑵原子晶体中,结构相似时,原子半径越小,共价键键长越短,键能越大,熔点越高。
⑶分子晶体中(不含氢键时),分子组成和结构相似时,相对分子质量越大,范德华力就越强,熔点就越高。
⑷金属晶体中,离子半径越小,离子电荷越高,金属键就越强,熔点就越高。合金的熔点比它的各成分金属的熔点低。
1.
比较下列离子化合物的熔点
NaF
NaCl
NaBr
NaF
MgF2
AlF3
2.
比较下列离子化合物的晶格能
(1)
Na2O
K2O
(2)
MgCl2
MgO
(3)
NaF
CsBr
>
>
>
>
<
<
<
练
习
练习
1、下表列出了有关晶体的知识,其中错误的是( )
2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2
C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
(1)MgO>KCl (2)MgO>SrS
(3)NaF>NaCl>NaBr
A
B
C
D
晶体
硫化钾
干冰
金刚石
碘
组成晶体的微粒
阴阳离子
分子
原子
分子
晶体微粒间存在的作用力
离子键
共价键
共价键
范德华力
B
C
1
2
3
4
5
6
8
7
8
中学教材上图示的NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO晶体结构与NaCl相同,Ni2+与邻近的O2-核间距为a×10-8
㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)
解:在该晶体中最小正方体中所含的
Ni2+、O2-个数均为:
即晶体中每个小正方体中平均含有1/2个
NiO.其质量为:
而此小正方体体积为(a×10-8㎝)3
故NiO晶体密度为:
总结
课
堂
练
习
题
74.7g
6.02×1023
×
1
2
(个)
1
2
4×
1
8
=
74.7g
6.02×1023
×
1
2
(a×10-8㎝)3
g.
㎝-3
62.0
a3
=
综合应用
变式
(1)NiO晶体结构与NaCl相同,设NiO的摩尔质量M
g/mol,密度为ρg/mL,阿伏加德罗常数为NA,求晶胞中两个距离最近的氧离子中心间的距离为多少cm?
解题思路:
(1)每个晶胞中含NiO的个数(2)一个晶胞的质量(3)一个晶胞的体积(4)晶胞的边长(5)晶胞中任一个面对角线长度的一半
主页
综合应用
(2)天然的和大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在以下缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
返回主菜单
参考答案:
Ni3+
:Ni2+=6
:91
本题命题角度较新颖,实际上难度不大,第(2)题所提供的Ni0.97O信息,实际上是一种“平均化学式”。尽管题给示意图及题目叙述中提到了有“Ni2+”空缺,但“Ni0.97O”的平均化学式与所述的“空缺”无关,它只是遵循着电中性原则,即由于掺杂多带一个电荷的Ni3+代替了部分Ni2+
,才使“NiO”变成了“Ni0.97O”。
一题多解:
(
1)由题意可得氧化镍中有许多由4个Ni2+和4个O2-相邻且占据顶点的小立方体构成,如图所示:此小立方体的每个Ni2+与O2-均为8个小立方体共用,因此小立方体拥有Ni2+与O2-均为:4×4/8=1/2,取1
mol晶体,则含有6.02×1023/(1/2)个小立方体。晶体密度
=
m/V=74.7g÷[(a×10-8cm)3×6.02×1023/(1/2)]=62.0/a3
g·cm-3。
(2)0.97
mol的镍离子的平均带电量为2,那么1
mol镍离子的平均带电量为2/0.97,这是+2和+3价的镍离子的共同电量,由此可列方程式。不同于上解的是,这种做法将0.97
mol镍离子化为1
mol镍离子来计算。
设1molNi中含Ni2+
x
mol,则含Ni3+(1-x)mol,根据电荷守恒:
2x+3(1-x)=2/0.97
x=91/97
n(Ni3+)∶n(Ni2+)=(1-91/97)∶91/97=6∶91
法三:因为中Nio.97O中既有+2价的离子又有+3价的镍离子,所以可写成xNiO·yNi2O3的复合形式,该形式中很容易看出镍离子的总和为x+2y,氧离子的总和为x+3y,因此可列方程如下:
x+2y=0.97
镍离子个数守恒
x+3y=1
氧离子个数守恒
或者列成分式形式:(x+2y
)/(x+3y)=0.97/1
同样可以求出三价镍与二价镍离子数目之比。
主页
可以整体移动的晶胞
可以整体移动的晶格
CaF2的晶胞
返回原处
NaCl晶体中阴、阳离子配位数
返回原处
某些离子晶体的晶格能
F-
Cl-
Br-
I-
Li+
Na+
K+
Rb+
Cs+
1036
923
821
785
740
853
786
715
689
659
807
747
682
660
631
757
704
649
630
604
教学目标
知识与能力:
1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2.学会离子晶体的性质与晶胞结构的关系。
3.通过探究知道离子晶体的配位数与离子半径比的关系。
4、通过碳酸盐的热分解温度与阳离子半径的自学,拓展学生视野。
5、通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。
第四节
离子晶体
复习:三种晶体类型与性质的比较
晶体类型
原子晶体
分子晶体
金属晶体
概念
作用力
构成微粒
物
理
性
质
熔沸点
硬度
导电性
实例
金刚石、二氧化硅、晶体硅、碳化硅
Ar、S、CO2等
Au、Fe、Cu、钢铁等
相邻原子之间以共价键相结合而成具有空间网状结构的晶体
分子间以范德华力相结合而成的晶体
通过金属键形成的晶体
共价键
范德华力
金属键
原子
分子
金属阳离子和“电子气”自由电子
很高
低
差别较大
很大
小
差别较大
无(硅为半导体)
无
导体
一、离子晶体
1、定义:由阳离子和阴离子通过离
子键结合而成的晶体。
2、成键粒子:阴、阳离子
3、相互作用力:离子键
4、常见离子晶体(含离子键的化合物)
强碱、活泼金属氧化物、大部分的盐类
活泼金属元素(IA、IIA等)与
活泼非金属元素(VIA、VIIA等)
形成化合物的元素的电负性的差>1.7
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Na+
Cl-
Cl-
Na+
Cl-
Na+
Cl-
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
Na+
Cl-
Cl-
Na+
Na+
Na+
Cl-
Cl-
Na+
可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。
5、晶胞类型:
---Cl-
---
Na+
NaCl的晶体结构模型
①Na+和Cl-的位置:
Na+和Cl-交错排列,Na+在立方体的体心和棱中点,Cl-在面心和顶点,或者反之。
5、晶胞类型:
(1)NaCl型晶胞
②每个晶胞含
个Na+
个Cl-
4
4
③与Na+等距离且最近的Cl-
有
个,
围成
型
与Cl-紧邻的Na+有
个,围成
型
与Na+紧邻的Na+有
个
与Cl-紧邻的Cl-有
个
6
6
12
12
正八面体
正八面体
---Cs+
---Cl-
CsCl的晶体结构及晶胞
①Cs+和Cl-的位置:
铯离子:体心
氯离子:顶点;或者反之。
②每个晶胞含1个Cs+、1个Cl-
③与Cs+紧邻的Cl-有
个,
与Cl-紧邻的
Cs+有
个
与Cs+紧邻的
Cs+有
个
与Cl-紧邻的
Cs+有
个
(2)CsCl型晶胞
8
8
6
6
氯化铯化学式CsCl
配位数:离子晶体中离子的配位数是指一个离子周围最邻近的异电性离子的数目(缩写C.N.)
离子晶体
阴离子的配位数
阳离子的配位数
NaCl
CsCl
6
6
8
8
(3)CaF2型晶胞
③Ca2+的配位数:
8
②F-的配位数:
4
①一个CaF2晶胞中含:
4个Ca2+和8个F-
(4)ZnS型晶胞
①阳离子的配位数:4
②阴离子的配位数:4
③一个ZnS晶胞中含:
4个阳离子和4个阴离子
和金刚石相同
科学探究:
离子
Na+
Cs+
Cl-
离子半径/pm
95
169
181
你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。
NaCl
CsCl
r+/r-
=
r+/r-
=
C.N.=6
C.N.=8
0.525
0.934
6、决定离子晶体结构的因素
(1)几何因素:
晶体中正负离子的半径比决定正负离子的配位数
(2)电荷因素:
晶体中正负离子的电荷比(绝对值)决定正负离子配位数是否相等
(3)键性因素:
离子晶体的结构类型还与离子键的纯粹程度(简称键性因素),即与晶体中正负离子的相互极化程度有关。
配位数
4
6
8
半径比
0.2~0.4
0.4~0.7
0.7~1.0
空间构型
ZnS
NaCl
CsCl
科学视野
[阅读]
碳酸盐热分解的实质是什么?
金属阳离子半径越小,碳酸盐的热稳定性越差
结构:碳酸盐的分解温度与金属阳离子所带的电荷及阳离子半径有关
思考:碳酸盐的稳定性与什么因素有关。
离子晶体的物理性质:
(1)熔沸点较高,难挥发
【阴阳离子电荷数越多,离子半径越小则离子键越强,熔沸点越高】
(2)硬而脆、难压缩
(3)离子晶体不导电,水溶液或熔融状态下均导电
(4)大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂
二、晶格能
1、定义:
气态离子形成1摩离子晶体时释放的能量。
(晶格能是最能反映离子晶体稳定性的数据)
2、影响晶格能的大小的因素
:
(1)阴、阳离子所带电荷越多晶格能越大。
(2)阴、阳离子的半径越小,晶格能越大。
3、晶格能的作用
晶格能越大:
形成的离子晶体越稳定;(离子键越强)
熔点越高;
硬度越大。
晶格能也影响了岩浆晶出的次序,晶格能越大,岩浆中的矿物越易结晶析出
某些离子晶体的晶格能
F-
Cl-
Br-
I-
Li+
Na+
K+
Rb+
Cs+
1036
923
821
785
740
853
786
715
689
659
807
747
682
660
631
757
704
649
630
604
卤化钠及碱土金属离子晶体
各类型离子晶体晶胞的比较
晶体类型
晶胞类型
晶胞结构示意图
配位数
距离最近且相等的相反离子
每个晶胞含有离子数
实例
NaCl型
AB
CsCl型
ZnS型
AB2
CaF2型
Na+:
6
Cl-:
6
Cs+:
Cl-:
8
8
Zn2+:
S2-:
4
4
Ca2+:
F-:
4
8
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
Na+:
Cl-:
Cs+:
Cl-:
Zn2+:
S2-:
Ca2+:
F-:
6
6
8
8
4
4
4
8
4
4
1
1
4
4
8
4
KBr
AgCl、MgO、CaS、BaSe
ZnS、AgI、
BeO
CsCl、CsBr、CsI、
碱土金属卤化物、碱金属氧化物。
教学重点难点:
1、离子晶体的物理性质的特点
2、离子晶体配位数及其影响因素
3、晶格能的定义和应用
【总结归纳】物质的熔点与晶体类型的关系
1、若晶体类型不同,一般情况下:原子晶体>离子晶体>分子晶体。
2、若晶体类型相同,则有:
⑴离子晶体中,结构相似时,离子半径越小,离子电荷越高,晶格能越大,离子键就越强,熔点就越高。
⑵原子晶体中,结构相似时,原子半径越小,共价键键长越短,键能越大,熔点越高。
⑶分子晶体中(不含氢键时),分子组成和结构相似时,相对分子质量越大,范德华力就越强,熔点就越高。
⑷金属晶体中,离子半径越小,离子电荷越高,金属键就越强,熔点就越高。合金的熔点比它的各成分金属的熔点低。
1.
比较下列离子化合物的熔点
NaF
NaCl
NaBr
NaF
MgF2
AlF3
2.
比较下列离子化合物的晶格能
(1)
Na2O
K2O
(2)
MgCl2
MgO
(3)
NaF
CsBr
>
>
>
>
<
<
<
练
习
练习
1、下表列出了有关晶体的知识,其中错误的是( )
2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2
C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
(1)MgO>KCl (2)MgO>SrS
(3)NaF>NaCl>NaBr
A
B
C
D
晶体
硫化钾
干冰
金刚石
碘
组成晶体的微粒
阴阳离子
分子
原子
分子
晶体微粒间存在的作用力
离子键
共价键
共价键
范德华力
B
C
1
2
3
4
5
6
8
7
8
中学教材上图示的NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO晶体结构与NaCl相同,Ni2+与邻近的O2-核间距为a×10-8
㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)
解:在该晶体中最小正方体中所含的
Ni2+、O2-个数均为:
即晶体中每个小正方体中平均含有1/2个
NiO.其质量为:
而此小正方体体积为(a×10-8㎝)3
故NiO晶体密度为:
总结
课
堂
练
习
题
74.7g
6.02×1023
×
1
2
(个)
1
2
4×
1
8
=
74.7g
6.02×1023
×
1
2
(a×10-8㎝)3
g.
㎝-3
62.0
a3
=
综合应用
变式
(1)NiO晶体结构与NaCl相同,设NiO的摩尔质量M
g/mol,密度为ρg/mL,阿伏加德罗常数为NA,求晶胞中两个距离最近的氧离子中心间的距离为多少cm?
解题思路:
(1)每个晶胞中含NiO的个数(2)一个晶胞的质量(3)一个晶胞的体积(4)晶胞的边长(5)晶胞中任一个面对角线长度的一半
主页
综合应用
(2)天然的和大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在以下缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
返回主菜单
参考答案:
Ni3+
:Ni2+=6
:91
本题命题角度较新颖,实际上难度不大,第(2)题所提供的Ni0.97O信息,实际上是一种“平均化学式”。尽管题给示意图及题目叙述中提到了有“Ni2+”空缺,但“Ni0.97O”的平均化学式与所述的“空缺”无关,它只是遵循着电中性原则,即由于掺杂多带一个电荷的Ni3+代替了部分Ni2+
,才使“NiO”变成了“Ni0.97O”。
一题多解:
(
1)由题意可得氧化镍中有许多由4个Ni2+和4个O2-相邻且占据顶点的小立方体构成,如图所示:此小立方体的每个Ni2+与O2-均为8个小立方体共用,因此小立方体拥有Ni2+与O2-均为:4×4/8=1/2,取1
mol晶体,则含有6.02×1023/(1/2)个小立方体。晶体密度
=
m/V=74.7g÷[(a×10-8cm)3×6.02×1023/(1/2)]=62.0/a3
g·cm-3。
(2)0.97
mol的镍离子的平均带电量为2,那么1
mol镍离子的平均带电量为2/0.97,这是+2和+3价的镍离子的共同电量,由此可列方程式。不同于上解的是,这种做法将0.97
mol镍离子化为1
mol镍离子来计算。
设1molNi中含Ni2+
x
mol,则含Ni3+(1-x)mol,根据电荷守恒:
2x+3(1-x)=2/0.97
x=91/97
n(Ni3+)∶n(Ni2+)=(1-91/97)∶91/97=6∶91
法三:因为中Nio.97O中既有+2价的离子又有+3价的镍离子,所以可写成xNiO·yNi2O3的复合形式,该形式中很容易看出镍离子的总和为x+2y,氧离子的总和为x+3y,因此可列方程如下:
x+2y=0.97
镍离子个数守恒
x+3y=1
氧离子个数守恒
或者列成分式形式:(x+2y
)/(x+3y)=0.97/1
同样可以求出三价镍与二价镍离子数目之比。
主页
可以整体移动的晶胞
可以整体移动的晶格
CaF2的晶胞
返回原处
NaCl晶体中阴、阳离子配位数
返回原处
某些离子晶体的晶格能
F-
Cl-
Br-
I-
Li+
Na+
K+
Rb+
Cs+
1036
923
821
785
740
853
786
715
689
659
807
747
682
660
631
757
704
649
630
604
教学目标
知识与能力:
1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2.学会离子晶体的性质与晶胞结构的关系。
3.通过探究知道离子晶体的配位数与离子半径比的关系。
4、通过碳酸盐的热分解温度与阳离子半径的自学,拓展学生视野。
5、通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。
