鲁教版初中化学九上 4.3 氧气——制取氧气 课件
文档属性
| 名称 | 鲁教版初中化学九上 4.3 氧气——制取氧气 课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 898.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-27 11:25:03 | ||
图片预览





文档简介
制 取 氧 气
分解过氧化氢(H2O2)
加热氯酸钾 (KClO3)
加热高锰酸钾(KMnO4)
实验室制取氧气的方法:
【实验3-4】
请将你观察到的实验现象填入下表,并作出推断。
实验序号
观察到的现象
推断
⑴
⑵
⑶
⑷
带火星的木条没有复燃
带火星的木条没有复燃
带火星的木条复燃
带火星的木条复燃
没有产生氧气
产生了氧气
产生了氧气
没有产生氧气
2.上述【实验3-4】⑷ 可以重复多次,而且若在实验前准确称出二氧化锰的质量,实验后将二氧化锰回收、干燥、再称量,会发现它的质量没有改变。根据这个事实,你对二氧化锰所起的作用有什么看法?
1.比较上述几步实验,说明过氧化氢分解放出氧气需要什么条件?
一.催化剂:
“一变”:改变其他物质的化学反应速率(可能加快、也可能减慢)
“二不变”:本身的质量和化学性质在反应前后都没有改变
催化剂在化学反应中所起的作用叫催化作用。
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫催化剂(又叫触媒)。
记忆要点
二氧化锰
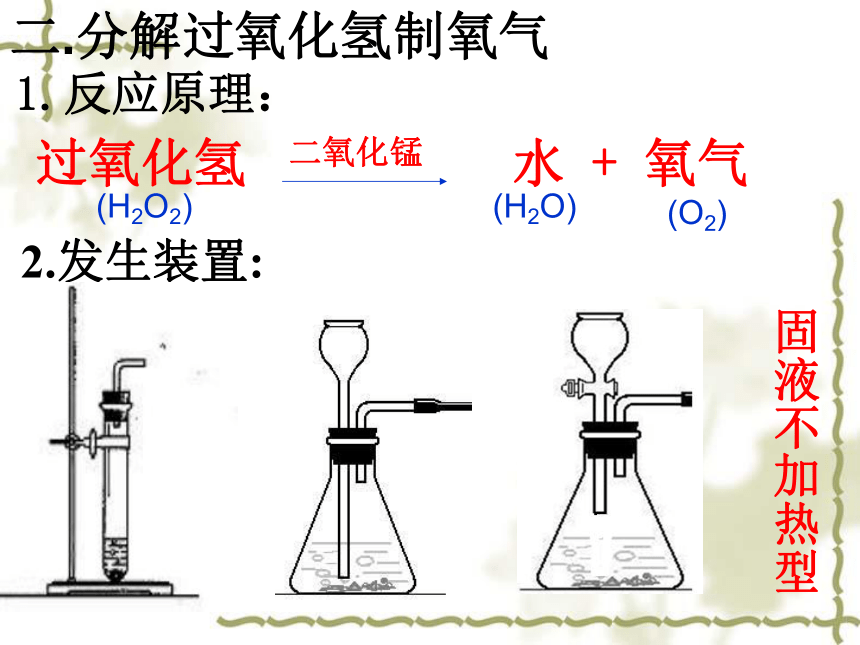
1.反应原理:
二.分解过氧化氢制氧气
2.发生装置:
固液不加热型
过氧化氢 水 + 氧气
(H2O2)
(H2O)
(O2)
3.气体收集装置
不易溶于水或难溶于水的气体,且不能和水发生反应
密度比空气大且不与空气中任何成分反应的气体
密度比空气小且不与空气中任何成分反应的气体
排水法
向上排空气法
向下排空气法
1、在化学反应中,催化剂的作用是( )
A.质量减少
B.在化学反应后化学性质发生了变化
C.质量增加
D.能改变化学反应的速率
D
2.用过氧化氢溶液制取氧气时,忘记了加二氧化锰会造成( )
A.放出氧气总量减少
B.无氧气放出
C.放出氧气的速率慢
D.放出氧气的速率慢且量少
C
3.过氧化氢(化学式为H2O2)溶液在二氧化锰(化学式为MnO2)作催化剂的条件下能迅速分解生成O2和H2O。可以调节分液漏斗活塞,控制液体的滴加速度。如下图所示:
A
B
C
D
回答下列问题:
⑴分液漏斗中应放入的物质是 , 锥形瓶中应放的物质是 。
过氧化氢溶液
二氧化锰
⑵写出该方法制取氧气的文字表达式: ;要收集一瓶
纯净的氧气,应选择装置 (填字母)。
过氧化氢 水 + 氧气
二氧化锰
D
⑶装置A中反应很剧烈,据此提出实验安全注意事项是 (填编号)
① 控制液体的滴加速度
② 用体积较小的锥形瓶
③ 加热反应物
①
本节课你的收获?
分解过氧化氢(H2O2)
加热氯酸钾 (KClO3)
加热高锰酸钾(KMnO4)
实验室制取氧气的方法:
【实验3-4】
请将你观察到的实验现象填入下表,并作出推断。
实验序号
观察到的现象
推断
⑴
⑵
⑶
⑷
带火星的木条没有复燃
带火星的木条没有复燃
带火星的木条复燃
带火星的木条复燃
没有产生氧气
产生了氧气
产生了氧气
没有产生氧气
2.上述【实验3-4】⑷ 可以重复多次,而且若在实验前准确称出二氧化锰的质量,实验后将二氧化锰回收、干燥、再称量,会发现它的质量没有改变。根据这个事实,你对二氧化锰所起的作用有什么看法?
1.比较上述几步实验,说明过氧化氢分解放出氧气需要什么条件?
一.催化剂:
“一变”:改变其他物质的化学反应速率(可能加快、也可能减慢)
“二不变”:本身的质量和化学性质在反应前后都没有改变
催化剂在化学反应中所起的作用叫催化作用。
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫催化剂(又叫触媒)。
记忆要点
二氧化锰
1.反应原理:
二.分解过氧化氢制氧气
2.发生装置:
固液不加热型
过氧化氢 水 + 氧气
(H2O2)
(H2O)
(O2)
3.气体收集装置
不易溶于水或难溶于水的气体,且不能和水发生反应
密度比空气大且不与空气中任何成分反应的气体
密度比空气小且不与空气中任何成分反应的气体
排水法
向上排空气法
向下排空气法
1、在化学反应中,催化剂的作用是( )
A.质量减少
B.在化学反应后化学性质发生了变化
C.质量增加
D.能改变化学反应的速率
D
2.用过氧化氢溶液制取氧气时,忘记了加二氧化锰会造成( )
A.放出氧气总量减少
B.无氧气放出
C.放出氧气的速率慢
D.放出氧气的速率慢且量少
C
3.过氧化氢(化学式为H2O2)溶液在二氧化锰(化学式为MnO2)作催化剂的条件下能迅速分解生成O2和H2O。可以调节分液漏斗活塞,控制液体的滴加速度。如下图所示:
A
B
C
D
回答下列问题:
⑴分液漏斗中应放入的物质是 , 锥形瓶中应放的物质是 。
过氧化氢溶液
二氧化锰
⑵写出该方法制取氧气的文字表达式: ;要收集一瓶
纯净的氧气,应选择装置 (填字母)。
过氧化氢 水 + 氧气
二氧化锰
D
⑶装置A中反应很剧烈,据此提出实验安全注意事项是 (填编号)
① 控制液体的滴加速度
② 用体积较小的锥形瓶
③ 加热反应物
①
本节课你的收获?
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
