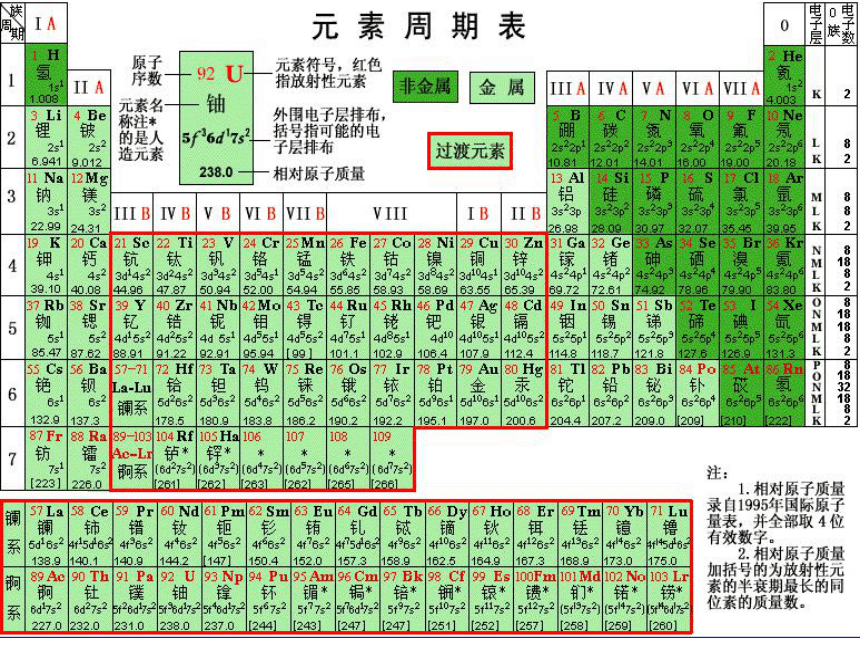
元素周期表
图片预览








文档简介
(共53张PPT)
第一章 物质结构
元素周期律
第一节 元素周期表
第一课时·原子核外电子排布
分子:
原子:
离子:
1、构成物质的基本微粒:
保持物质化学性质的最小微粒。
化学变化中的最小微粒。
带电荷的微粒。分为阳离子,阴离子。
原子与离子的关系:
一、知识回顾
阳离子 原子 阴离子
得电子
失电子
得电子
失电子
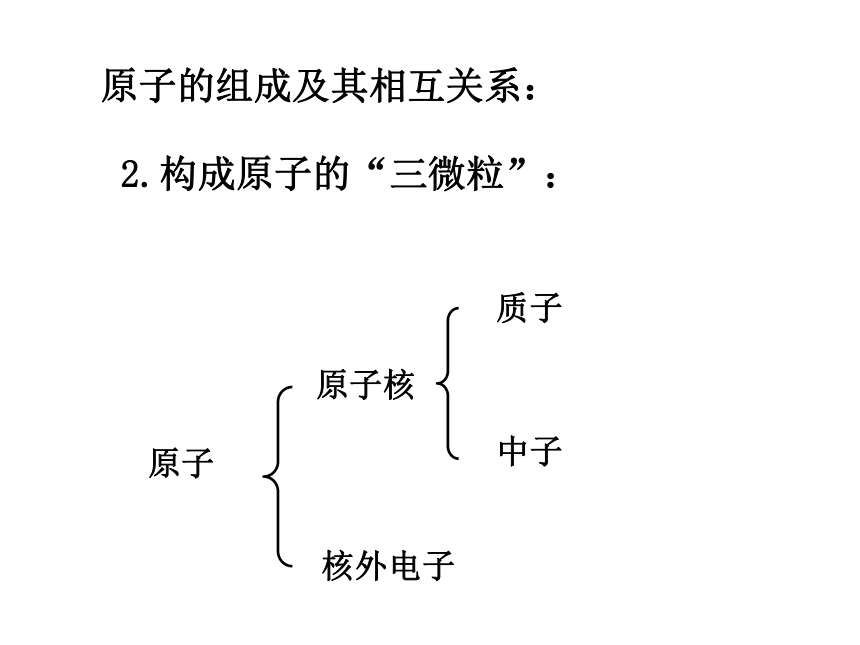
原子的组成及其相互关系:
原子核
核外电子
质子
中子
原子
2.构成原子的“三微粒”:
3、相互关系:
位置关系:
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的;
体积关系:
原子很小,原子核更小(直径不及原子直径的万分之一),电子在核外作高速运动,所占的空间相对较大;
电荷关系:原子呈电中性,原子核带的电量跟核外电子的电量相等而电性相反,即:
核电荷数=核内质子数=核外电子数
质量关系:原子的质量主要集中在原子核上(原子核的密度极高),即原子的质量主要由质子和中子的质量决定;
原子的质量 所有质子的质量+所有中子的质量
4、质量数(A):
如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值加起来,所得的数值。用符号A表示。即:
质量数(A)=质子数(Z)+中子数(N)
注:相对质量是指对12C原子(原子核内有6个质子和6个
中子的碳原子)质量的1/12(1.661 10-27kg相比较所得
的数值。
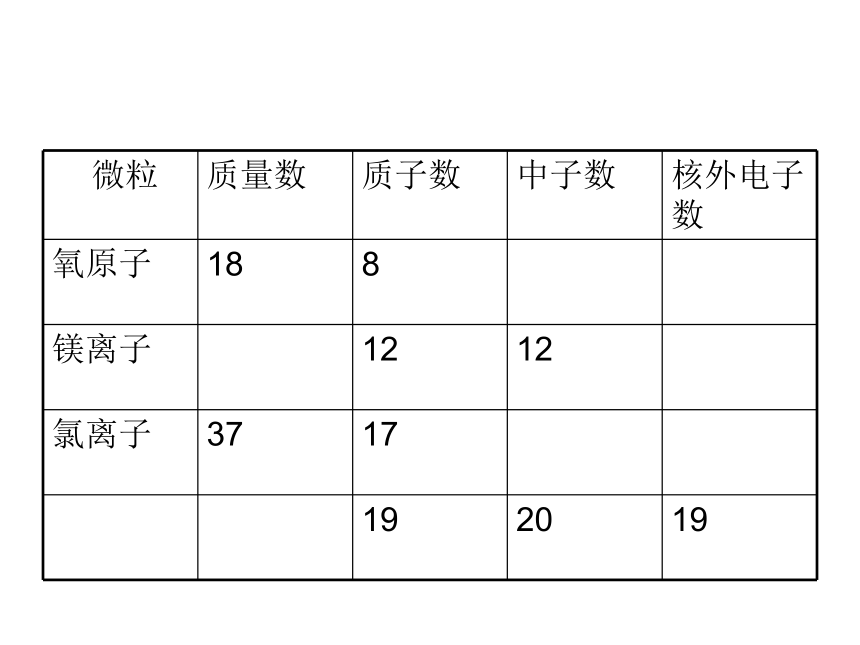
微粒 质量数 质子数 中子数 核外电子数
氧原子 18 8
镁离子 12 12
氯离子 37 17
19 20 19
5、粒子中的质子数与核外电子数的关系:
①中性原子: 质子数=核外电子数
②带正电的阳离子:
质子数>核外电子数
质子数-电荷数=核外电子数
③带负电的阴离子:
质子数<核外电子数
质子数-电荷数=核外电子数
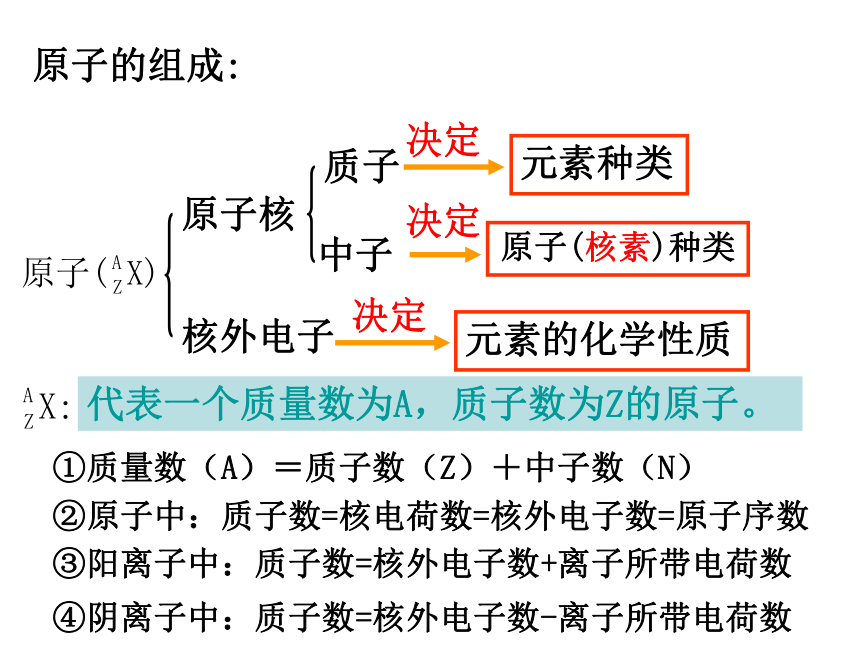
原子的组成:
原子核
核外电子
质子
中子
元素种类
原子(核素)种类
元素的化学性质
决定
决定
决定
代表一个质量数为A,质子数为Z的原子。
①质量数(A)=质子数(Z)+中子数(N)
②原子中:质子数=核电荷数=核外电子数=原子序数
③阳离子中:质子数=核外电子数+离子所带电荷数
④阴离子中:质子数=核外电子数-离子所带电荷数
第二课时
二、原子核外电子
1、核外电子运动的特点:
⑴电子的质量极微小(9.109 10-31kg);
⑵电子绕核运动是在原子这样极其微小的空间(原子的直径约10-10m)中进行;
⑶电子绕核作高速运动(运动的速度接近光速,约为108m/s)
因此,电子绕核运动没有确定的轨道,不能精确测定或计算电子在任一时刻所在的位置,也不能描绘出其运动轨迹,
我们只能指出它在核外空间某处出现机会的多少。
这是核外电子运动的根本特征。
完全不同于宏观世界物体如行星、炮弹、尘粒等的运动状况。
电子云
(1) 电子的能量:
任何一个电子都具有一定的能量。在含有多个电子的原子里,各电子的能量有所不同。
(2)电子的运动区域:
在含有多个电子的原子里,能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域内运动。
Why?
原子核带正电荷,电子带负电荷,电子围绕着原子核做高速的圆周运动,电子和原子核之间存在着强烈的电性作用。
2、原子核外电子分层排布
(3)电子层:
把不同的区域简化为不连续的壳层,叫做电子层。
2、原子核外电子排布
第1层 第2层 第3层 第4层 第5层 第6层 第7层
电子层名称及其符号
电子层与原子核之间的距离
各电子层之间的能量关系
最多容纳的电子个数
K层
L层
M层
N层
O层
P层
Q层
从左到右由近及远
从左到右由低到高
A、核外电子是分层排布的。
B、电子一般总是尽先排布在能量最低的电子层里,即最先排布K层;当K层排满后,再排布L层;当L层排满后,再排布M层;……
那么,每个电子层最多可以排布多少个电子?
首先研究一下稀有气体元素原子电子层排布的情况:
☆(4)核外电子排布的规律:
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
从表中可看出,K层、L层、M层最多能排布的电子数目?
K-2,L-8,M-18
8个(氦原子是2个)
最外层电子数最多有几个?
试推断各电子层最多能容纳的电子数和电子层数之间有什么关系?
次外层不超过多少个?倒数第三层呢?
原子核外电子的排布规律:
各电子层最多容纳的电子数是2n2(n表示电子层);
最外层电子数不超过8个(K层是最外层时,最多不超过2个),次外层电子数目不超过18个,倒数第三层不超过32个;
核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
注:以上规律是相互联系的,不能孤立地机械地套用
据课本p12表1-2写出1-18号元素的原子结构示意图,并归纳出核外电子排布有哪些规律?
氢(H) 氦(He)
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne )
钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar)
元素分类 最外层电子数 得失电子趋势
稀有气体
金属元素
非金属元素
8(He为2 )
少于4个
4个以上
稳定结构
易失电子
易得电子
最外层电子数为8(He为2)的电子层结构,通常不容易得失电子。化学性质稳定、不活泼。
稳定结构:
课堂练习
1、判断下列示意图是否正确?为什么?
A、 B、
C、 D、
+19 2 8 9
+12 2 10
+3 1 2
+54 2 8 18 20 6
3、某元素的原子核外有3个电子层,最外层有5个电子,该原子核内的质子数为( )
A、14 B、15 C、16 D、17
4、某元素的原子核外有三个电子层,M层的电子数是L层电子数的1/2,则该元素的原子是( )
A、Li B、Si C、Al D、K
B
B
2、根据核外电子排布规律,画出下列元素原子的结构示意图。
(1)3Li、11Na、19K、37Rb、55Cs
(2)9F、17Cl、35Br、53I
5、与OH-具有相同质子数和电子数的微粒( )
A、F- B、NH3 C、H2O D、Na+
6、 C-NMR(核磁共振)可以用于含碳化合物的结构分析, C表示的碳原子( )
A、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,原子序数为6,核内有7个质子
D、质量数为13,原子序数为6,核内有7个中子
A
D
第三课时
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。将化学性质相似的元素放在一个纵行制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成一个完整的体系成为化学发展史上重要的里程碑之一。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
Reihen GruppⅠ
—
R2O GruppⅡ
—
RO GruppⅢ
—
R2O3 GruppⅣ
RH4
RO2 GruppⅤ
RH3
R2O5 GruppⅥ
RH2
RO3 GruppⅦ
RH
R2O7 GruppⅧ
—
RO4
1 H=1
2 Li=7 Be=9.4 B=11 C=12 N=14 O=16 F=19
3 Na=23 Mg=24 Al=27.3 Si=28 P=31 S=32 Cl=35.5
4 K=39 Ca=40 Ti=48 V=51 Cr=52 Mn=55 Fe=56,Co=59
Ni=59,Cu=63
5 (Cu=63) Zn=65 As=75 Se=78 Br=80
6 Rb=85 Sr=87 Yt=88 Zr=90 Ru=104,Rh=104
Pd=106,Ag=108
7 Ag=108 Cd=112 In=113 Sn=118 Sb=122 Te=125 J=127
8 Cs=133 Ba=137 Di=138 Ce=140
9
10 Er=178 La=180 Ta=182 W=184 Os=195,Ir=197
Pt=195,Ag=199
11 (Au=199) Hg=200 Tl=204 Pb=207 Bi=208
12 Th=231 U=240
=44
=68 =72
类硼
类铝
类硅
课外活动:
1、历史上是谁制出了第一张元素周期表?
他的排列依据是什么?
2.画出元素周期表的前18号元素的原子结构示意图,找出现代元素周期表的具体编排原则?
按照原子序数递增的顺序从左到右排列
将电子层数相同的元素,按原子序数递增的顺序从左到右排成一个横行——周期
把最外层电子数相同的元素按电子层数递增的顺序由上而下排成纵列——族
三. 元素周期表的编排原则:
原子序数=核电荷数=质子数=核外电子数
形式一
1H 2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
形式二
1H 2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
1. 周期
周期的概念:
元素周期表中具有相同的电子层数的元素,按照原子序数递增的顺序排列的一个横行称为一个周期。
周期的分类:
7个周期——三个短周期、四个长周期
“三短四长”
四、元素周期表的结构
短周期和长周期的区别:过渡元素(过渡金属)
周期的分类:7个周期——三短四长
类别 周期序数 包含元素种类 起止元素 核外电子层数
短周期
长周期
2
3
1
1
2
3
4
5
6
4
5
6
7
7
2
8
8
18
18
32
现26
应 ?
1H~2He
3Li~ 9F、10Ne
11Na~17Cl 、18Ar
19K~35Br、36Kr
37Rb~53I、54Xe
55Cs~85At、86Rn
87Fr~112号( ?)
现26
应32
87Fr~112号(118)
周期的特点
周期序数 = 电子层数
记住每一周期包含的元素种类和每一周期起止元素的原子序数,可以很方便的判断元素在周期表中的位置
思考:
它们分别位于第几周期?为什么?
A、B是同一族的两种元素,若A的原子序数为X,则B的原子序数不可能是( )。
A. X+2 B. X+4 C. X+8 D. X+18
B
若元素A为第17号元素,则下列元素不可能处在它下一个周期的是( )
A、20号元素 B、26号元素
C、31号元素 D、37号元素
D
第四课时
2.族
族的概念:
周期表中具有相同的外层电子排布的元素,按电子层数递增的顺序排列的一个或几个纵列称为族.
18个纵行,16个族。
族的分类:主族、副族、零族、第Ⅷ族
画出第11号元素以及第15号元素的原子结构示意图,看一看元素的核外电子排布和它的族序数有什么关系?
主族序数
=最外层电子数
Na
+11 2 8 1
P
+15 2 8 5
“一主二主三七副,Ⅷ族三列紧排布,
一副二副三七主,最后一列是零族.”
周期表中族的排列次序:
思考:
已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
第三周期第ⅡA族的元素是第几号元素?第四周期第ⅦA族的元素是第几号元素?
12号元素Mg,35号元素Br
D
原子序数为 x 的元素位于第IA族,那么原子序数为 x+2 的元素肯定不会在( )
A、第 IA 族 B、第IIIB族
C、第IIIA族 D、0族
元素周期表
周期
(7个)
短周期(3个):第1.2.3 周期
长周期(4个):第4.5.6.7 周期
族
(16个)
主族(7个)ⅠA ~ ⅦA
副族(7个)ⅠB ~ ⅦB
Ⅷ族 第8 9 10 三个纵列
零族 稀有气体元素
3、元素周期表的整体结构
过渡元素
112
111
110
109
108
107
106
105
104
89-103
80
79
78
77
76
75
74
73
72
57-71
48
47
46
45
44
43
42
41
40
39
30
29
28
27
26
25
24
23
22
21
86
85
84
83
82
81
54
53
52
51
50
49
36
35
34
33
32
31
18
17
16
15
14
13
10
9
8
7
6
5
2
88
87
56
55
38
37
20
19
12
11
4
3
1
7
6
5
4
18
8
2
M
L
k
3
8
2
L
K
2
2
K
1
103
102
101
100
99
98
97
96
95
94
93
92
91
90
89
71
70
69
68
67
66
65
64
63
62
61
60
59
58
57
元素周期表
IA
IIA
IIIA
IVA
V
A
VIA
VIIA
0
IIIB IVB VB VIB VIIB VIII IB II B
锕系
镧系
主族
周期
副族
过渡元素
7、下列四组物质中,不具有相同核外电子总数的两种分子是( )
A、H2O2和CH3OH B、HNO2和HClO
C、H2O和CH4 D、H2S和F2
8、两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中,满足上述关系的元素共有( )
A、1对 B、2对 C、3对 D、4对
B
B
9、短周期的三种元素分别为X、Y、Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个,则这三种元素所组成的化合物的分子式不可能的是( )
A、X2YZ4 B、XYZ3
C、X3YZ4 D、X4Y2Z7
A
练习10
按核外电子排布规律,预测核电荷数为118的元素的原子核外电子层排布是( )
A 2、8、18、32、58
B 2、8、18、32、32、8
C 2、8、18、32、50、18、8
D 2、8、18、32、32、18、8
D
练习11
有A、B、C三种元素的原子,它们的核电荷数之和为28。A元素的原子核外只有1个电子;B元素的原子核外有三个电子层,其最外层电子数恰好为稳定结构。则A、B、C三种元素的元素符号:A是 ,B是 ,C是 ,
C元素的原子结构示意图为 。
H
Ar
F
棱台型元素周期表
扇形元素周期表
立式周期表
螺旋型周期表
第一章 物质结构
元素周期律
第一节 元素周期表
第一课时·原子核外电子排布
分子:
原子:
离子:
1、构成物质的基本微粒:
保持物质化学性质的最小微粒。
化学变化中的最小微粒。
带电荷的微粒。分为阳离子,阴离子。
原子与离子的关系:
一、知识回顾
阳离子 原子 阴离子
得电子
失电子
得电子
失电子
原子的组成及其相互关系:
原子核
核外电子
质子
中子
原子
2.构成原子的“三微粒”:
3、相互关系:
位置关系:
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的;
体积关系:
原子很小,原子核更小(直径不及原子直径的万分之一),电子在核外作高速运动,所占的空间相对较大;
电荷关系:原子呈电中性,原子核带的电量跟核外电子的电量相等而电性相反,即:
核电荷数=核内质子数=核外电子数
质量关系:原子的质量主要集中在原子核上(原子核的密度极高),即原子的质量主要由质子和中子的质量决定;
原子的质量 所有质子的质量+所有中子的质量
4、质量数(A):
如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值加起来,所得的数值。用符号A表示。即:
质量数(A)=质子数(Z)+中子数(N)
注:相对质量是指对12C原子(原子核内有6个质子和6个
中子的碳原子)质量的1/12(1.661 10-27kg相比较所得
的数值。
微粒 质量数 质子数 中子数 核外电子数
氧原子 18 8
镁离子 12 12
氯离子 37 17
19 20 19
5、粒子中的质子数与核外电子数的关系:
①中性原子: 质子数=核外电子数
②带正电的阳离子:
质子数>核外电子数
质子数-电荷数=核外电子数
③带负电的阴离子:
质子数<核外电子数
质子数-电荷数=核外电子数
原子的组成:
原子核
核外电子
质子
中子
元素种类
原子(核素)种类
元素的化学性质
决定
决定
决定
代表一个质量数为A,质子数为Z的原子。
①质量数(A)=质子数(Z)+中子数(N)
②原子中:质子数=核电荷数=核外电子数=原子序数
③阳离子中:质子数=核外电子数+离子所带电荷数
④阴离子中:质子数=核外电子数-离子所带电荷数
第二课时
二、原子核外电子
1、核外电子运动的特点:
⑴电子的质量极微小(9.109 10-31kg);
⑵电子绕核运动是在原子这样极其微小的空间(原子的直径约10-10m)中进行;
⑶电子绕核作高速运动(运动的速度接近光速,约为108m/s)
因此,电子绕核运动没有确定的轨道,不能精确测定或计算电子在任一时刻所在的位置,也不能描绘出其运动轨迹,
我们只能指出它在核外空间某处出现机会的多少。
这是核外电子运动的根本特征。
完全不同于宏观世界物体如行星、炮弹、尘粒等的运动状况。
电子云
(1) 电子的能量:
任何一个电子都具有一定的能量。在含有多个电子的原子里,各电子的能量有所不同。
(2)电子的运动区域:
在含有多个电子的原子里,能量低的电子通常在离核较近的区域内运动,能量高的电子通常在离核较远的区域内运动。
Why?
原子核带正电荷,电子带负电荷,电子围绕着原子核做高速的圆周运动,电子和原子核之间存在着强烈的电性作用。
2、原子核外电子分层排布
(3)电子层:
把不同的区域简化为不连续的壳层,叫做电子层。
2、原子核外电子排布
第1层 第2层 第3层 第4层 第5层 第6层 第7层
电子层名称及其符号
电子层与原子核之间的距离
各电子层之间的能量关系
最多容纳的电子个数
K层
L层
M层
N层
O层
P层
Q层
从左到右由近及远
从左到右由低到高
A、核外电子是分层排布的。
B、电子一般总是尽先排布在能量最低的电子层里,即最先排布K层;当K层排满后,再排布L层;当L层排满后,再排布M层;……
那么,每个电子层最多可以排布多少个电子?
首先研究一下稀有气体元素原子电子层排布的情况:
☆(4)核外电子排布的规律:
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
从表中可看出,K层、L层、M层最多能排布的电子数目?
K-2,L-8,M-18
8个(氦原子是2个)
最外层电子数最多有几个?
试推断各电子层最多能容纳的电子数和电子层数之间有什么关系?
次外层不超过多少个?倒数第三层呢?
原子核外电子的排布规律:
各电子层最多容纳的电子数是2n2(n表示电子层);
最外层电子数不超过8个(K层是最外层时,最多不超过2个),次外层电子数目不超过18个,倒数第三层不超过32个;
核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
注:以上规律是相互联系的,不能孤立地机械地套用
据课本p12表1-2写出1-18号元素的原子结构示意图,并归纳出核外电子排布有哪些规律?
氢(H) 氦(He)
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne )
钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar)
元素分类 最外层电子数 得失电子趋势
稀有气体
金属元素
非金属元素
8(He为2 )
少于4个
4个以上
稳定结构
易失电子
易得电子
最外层电子数为8(He为2)的电子层结构,通常不容易得失电子。化学性质稳定、不活泼。
稳定结构:
课堂练习
1、判断下列示意图是否正确?为什么?
A、 B、
C、 D、
+19 2 8 9
+12 2 10
+3 1 2
+54 2 8 18 20 6
3、某元素的原子核外有3个电子层,最外层有5个电子,该原子核内的质子数为( )
A、14 B、15 C、16 D、17
4、某元素的原子核外有三个电子层,M层的电子数是L层电子数的1/2,则该元素的原子是( )
A、Li B、Si C、Al D、K
B
B
2、根据核外电子排布规律,画出下列元素原子的结构示意图。
(1)3Li、11Na、19K、37Rb、55Cs
(2)9F、17Cl、35Br、53I
5、与OH-具有相同质子数和电子数的微粒( )
A、F- B、NH3 C、H2O D、Na+
6、 C-NMR(核磁共振)可以用于含碳化合物的结构分析, C表示的碳原子( )
A、核外有13个电子
B、核内有6个质子,核外有7个电子
C、质量数为13,原子序数为6,核内有7个质子
D、质量数为13,原子序数为6,核内有7个中子
A
D
第三课时
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。将化学性质相似的元素放在一个纵行制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成一个完整的体系成为化学发展史上重要的里程碑之一。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
Reihen GruppⅠ
—
R2O GruppⅡ
—
RO GruppⅢ
—
R2O3 GruppⅣ
RH4
RO2 GruppⅤ
RH3
R2O5 GruppⅥ
RH2
RO3 GruppⅦ
RH
R2O7 GruppⅧ
—
RO4
1 H=1
2 Li=7 Be=9.4 B=11 C=12 N=14 O=16 F=19
3 Na=23 Mg=24 Al=27.3 Si=28 P=31 S=32 Cl=35.5
4 K=39 Ca=40 Ti=48 V=51 Cr=52 Mn=55 Fe=56,Co=59
Ni=59,Cu=63
5 (Cu=63) Zn=65 As=75 Se=78 Br=80
6 Rb=85 Sr=87 Yt=88 Zr=90 Ru=104,Rh=104
Pd=106,Ag=108
7 Ag=108 Cd=112 In=113 Sn=118 Sb=122 Te=125 J=127
8 Cs=133 Ba=137 Di=138 Ce=140
9
10 Er=178 La=180 Ta=182 W=184 Os=195,Ir=197
Pt=195,Ag=199
11 (Au=199) Hg=200 Tl=204 Pb=207 Bi=208
12 Th=231 U=240
=44
=68 =72
类硼
类铝
类硅
课外活动:
1、历史上是谁制出了第一张元素周期表?
他的排列依据是什么?
2.画出元素周期表的前18号元素的原子结构示意图,找出现代元素周期表的具体编排原则?
按照原子序数递增的顺序从左到右排列
将电子层数相同的元素,按原子序数递增的顺序从左到右排成一个横行——周期
把最外层电子数相同的元素按电子层数递增的顺序由上而下排成纵列——族
三. 元素周期表的编排原则:
原子序数=核电荷数=质子数=核外电子数
形式一
1H 2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
形式二
1H 2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
1. 周期
周期的概念:
元素周期表中具有相同的电子层数的元素,按照原子序数递增的顺序排列的一个横行称为一个周期。
周期的分类:
7个周期——三个短周期、四个长周期
“三短四长”
四、元素周期表的结构
短周期和长周期的区别:过渡元素(过渡金属)
周期的分类:7个周期——三短四长
类别 周期序数 包含元素种类 起止元素 核外电子层数
短周期
长周期
2
3
1
1
2
3
4
5
6
4
5
6
7
7
2
8
8
18
18
32
现26
应 ?
1H~2He
3Li~ 9F、10Ne
11Na~17Cl 、18Ar
19K~35Br、36Kr
37Rb~53I、54Xe
55Cs~85At、86Rn
87Fr~112号( ?)
现26
应32
87Fr~112号(118)
周期的特点
周期序数 = 电子层数
记住每一周期包含的元素种类和每一周期起止元素的原子序数,可以很方便的判断元素在周期表中的位置
思考:
它们分别位于第几周期?为什么?
A、B是同一族的两种元素,若A的原子序数为X,则B的原子序数不可能是( )。
A. X+2 B. X+4 C. X+8 D. X+18
B
若元素A为第17号元素,则下列元素不可能处在它下一个周期的是( )
A、20号元素 B、26号元素
C、31号元素 D、37号元素
D
第四课时
2.族
族的概念:
周期表中具有相同的外层电子排布的元素,按电子层数递增的顺序排列的一个或几个纵列称为族.
18个纵行,16个族。
族的分类:主族、副族、零族、第Ⅷ族
画出第11号元素以及第15号元素的原子结构示意图,看一看元素的核外电子排布和它的族序数有什么关系?
主族序数
=最外层电子数
Na
+11 2 8 1
P
+15 2 8 5
“一主二主三七副,Ⅷ族三列紧排布,
一副二副三七主,最后一列是零族.”
周期表中族的排列次序:
思考:
已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族?
第三周期第ⅡA族的元素是第几号元素?第四周期第ⅦA族的元素是第几号元素?
12号元素Mg,35号元素Br
D
原子序数为 x 的元素位于第IA族,那么原子序数为 x+2 的元素肯定不会在( )
A、第 IA 族 B、第IIIB族
C、第IIIA族 D、0族
元素周期表
周期
(7个)
短周期(3个):第1.2.3 周期
长周期(4个):第4.5.6.7 周期
族
(16个)
主族(7个)ⅠA ~ ⅦA
副族(7个)ⅠB ~ ⅦB
Ⅷ族 第8 9 10 三个纵列
零族 稀有气体元素
3、元素周期表的整体结构
过渡元素
112
111
110
109
108
107
106
105
104
89-103
80
79
78
77
76
75
74
73
72
57-71
48
47
46
45
44
43
42
41
40
39
30
29
28
27
26
25
24
23
22
21
86
85
84
83
82
81
54
53
52
51
50
49
36
35
34
33
32
31
18
17
16
15
14
13
10
9
8
7
6
5
2
88
87
56
55
38
37
20
19
12
11
4
3
1
7
6
5
4
18
8
2
M
L
k
3
8
2
L
K
2
2
K
1
103
102
101
100
99
98
97
96
95
94
93
92
91
90
89
71
70
69
68
67
66
65
64
63
62
61
60
59
58
57
元素周期表
IA
IIA
IIIA
IVA
V
A
VIA
VIIA
0
IIIB IVB VB VIB VIIB VIII IB II B
锕系
镧系
主族
周期
副族
过渡元素
7、下列四组物质中,不具有相同核外电子总数的两种分子是( )
A、H2O2和CH3OH B、HNO2和HClO
C、H2O和CH4 D、H2S和F2
8、两种元素原子的核外电子层数之比与它们的最外层电子数之比相等,在周期表的前10号元素中,满足上述关系的元素共有( )
A、1对 B、2对 C、3对 D、4对
B
B
9、短周期的三种元素分别为X、Y、Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个,则这三种元素所组成的化合物的分子式不可能的是( )
A、X2YZ4 B、XYZ3
C、X3YZ4 D、X4Y2Z7
A
练习10
按核外电子排布规律,预测核电荷数为118的元素的原子核外电子层排布是( )
A 2、8、18、32、58
B 2、8、18、32、32、8
C 2、8、18、32、50、18、8
D 2、8、18、32、32、18、8
D
练习11
有A、B、C三种元素的原子,它们的核电荷数之和为28。A元素的原子核外只有1个电子;B元素的原子核外有三个电子层,其最外层电子数恰好为稳定结构。则A、B、C三种元素的元素符号:A是 ,B是 ,C是 ,
C元素的原子结构示意图为 。
H
Ar
F
棱台型元素周期表
扇形元素周期表
立式周期表
螺旋型周期表
