选修3第三章第一节晶体的常识检测 同步练习(含答案)
文档属性
| 名称 | 选修3第三章第一节晶体的常识检测 同步练习(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-28 14:00:05 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
选修3第三章第一节晶体的常识同步练习
第I卷(选择题)
一、单选题
1.下列关于晶体与非晶体的说法正确的是
A.晶体一定比非晶体的熔点高
B.晶体有自范性但排列无序
C.固体SiO2一定是晶体
D.非晶体无自范性而且排列无序
2.在研究晶体结构的时候,通常可以用“切割法”来计算一个晶胞中实际拥有的微粒数,从而确定其化学式。现有四种晶体的结构模型如图所示,其中化学式不属于AB型的是
A.
B.
C.
D.
3.晶体与非晶体的本质区别是(
)
A.晶体有规则的几何外形,而非晶体没有规则的几何外形
B.晶体内部粒子有序排列,而非晶体内部粒子无序排列
C.晶体有固定的熔点,而非晶体没有固定的熔点
D.晶体的硬度大,而非晶体的硬度小
4.下列有关化学用语的说法不正确的是( )
A.-OH和都表示羟基
B.如图是食盐晶体的晶胞
C.CH4分子的球棍模型:
D.次氯酸分子的电子式:
5.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为
(
)
A.1:3:1
B.2:3:1
C.2:2:1
D.1:3:3
6.区分晶体和非晶体的最科学的方法是(
)
A.测固体的熔点
B.对固体进行X射线衍射实验
C.看固体是否易被压缩
D.比较固体的导热性
7.下列物质中属于晶体的是( )
①橡胶 ②玻璃 ③食盐 ④水晶 ⑤塑料 ⑥胆矾
A.①④⑤
B.②③⑥
C.①③④
D.③④⑥
8.钙、钛、氧可形成如图所示的晶胞,则所形成的物质的化学式可表示为(
)
A.Ca8TiO12
B.Ca4TiO6
C.Ca4TiO3
D.CaTiO3
9.石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他3个碳原子相结合。据图分析,石墨晶体中碳原子数与共价键数之比为( )
A.2∶3
B.2∶1
C.1∶3
D.3∶2
10.下列说法不正确的是(
)
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.石墨、金刚石互为同素异形体
11.下面二维平面晶体所表示的化学式为AX2的是(
)
A.
B.
C.
D.
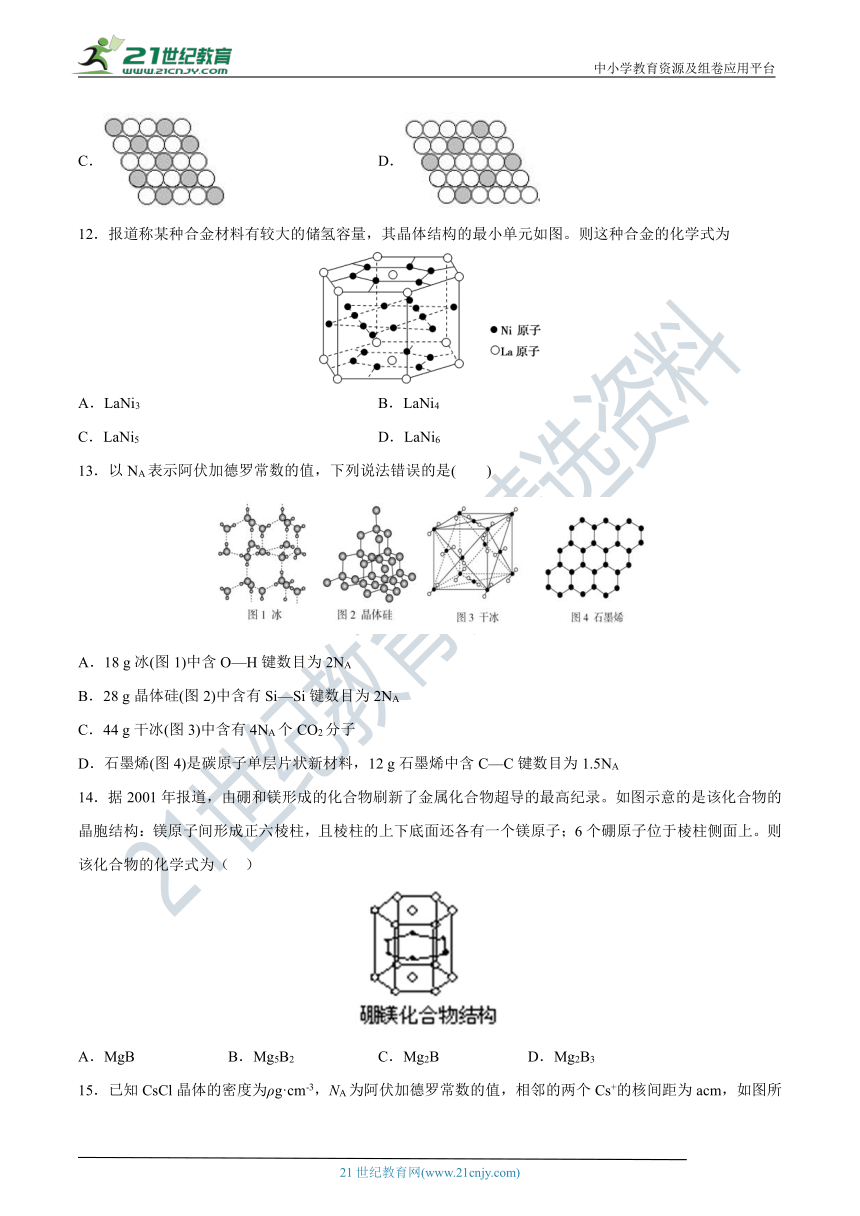
12.报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图。则这种合金的化学式为
A.LaNi3
B.LaNi4
C.LaNi5
D.LaNi6
13.以NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.18
g冰(图1)中含O—H键数目为2NA
B.28
g晶体硅(图2)中含有Si—Si键数目为2NA
C.44
g干冰(图3)中含有4NA个CO2分子
D.石墨烯(图4)是碳原子单层片状新材料,12
g石墨烯中含C—C键数目为1.5NA
14.据2001年报道,由硼和镁形成的化合物刷新了金属化合物超导的最高纪录。如图示意的是该化合物的晶胞结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为(
)
A.MgB
B.Mg5B2
C.Mg2B
D.Mg2B3
15.已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的相对分子质量可以表示为(
)
A.NA·a3·ρ
B.
C.
D.
16.纳米材料具有一些与传统材料不同的特征,下列关于纳米材料的叙述中,错误的是
A.三维空间尺寸必须都处于纳米尺度
B.具有既不同于微观粒子也不同于宏观物体的独特性质
C.是原子排列成的纳米数量级原子团
D.具有与晶态、非晶态均不同的一种新的结构状态
17.钒的某种氧化物的立方晶胞结构如图所示,晶胞参数为a
pm,下列说法错误的是
A.该钒的氧化物的化学式为VO2
B.V原子在该晶体中的堆积方式为体心立方
C.V原子的配位数与O的配位数之比为1:2
D.该晶胞的密度为
g/cm3
18.下列说法正确的是(
)
A.硼酸(H3BO3)分子中含有3个羟基,因此硼酸为三元酸
B.Ga、Ge、As、Se四种基态原子的第一电离能由小到大的顺序为Ga<Ge<Se<As
C.Cu3N形成的晶体结构如图所示,则与N3-等距离且最近的Cu+有3个
D.第二周期元素电负性由小到大顺序排列,B元素应位于第2位
19.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,平面结构如图所示。则x值为(?
?)
A.12
B.24
C.60
D.8
20.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成名称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K
等。下列分析正确的是
A.题干中所列举的
6
种钾石墨属于有机高分子化合物
B.钾石墨中碳原子的杂化方式是
sp3
杂化
C.若某钾石墨的原子分布如图所示,则它所表示的是
C12K
D.最近两个
K
原子之间的距离为石墨中
C—C
键键长的2倍
第II卷(非选择题)
二、填空题
21.按要求回答下列问题:
(1)C、Be、Cl、Fe等元素及其化合物有重要的应用。
①查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_______(填离子或共价)化合物。
(2)镍元素基态原子的价电子排布式为_______;3d能级上的未成对电子数为______。
(3)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图,则该化合物的化学式为______,C、Ni、Mg三种元素中,电负性最大的是______。
22.亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式_________;
(2)与CN-互为等电子体的分子是______,K4[Fe(CN)6]中的作用力除离子键和共价键外,还有_______。含有12mol
σ键的K4[Fe(CN)6]的物质的量为_______mol。
(3)黄血盐中C原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________;
(4)Fe、Na、K的晶体结构如图所示。
①钠的熔点比钾更高,原因是__________;
②Fe原子半径是r
cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_____g/cm3。
23.钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
24.(1)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图Ⅰ)顶点的氮原子,这种碳氮化钛化合物的化学式为___。
(2)图Ⅱ是由Q、Cu、O三种元素组成的一种高温超导体的晶胞结构,其中Cu为+2价,O为-2价,则Q的化合价为___价。
(3)一种新型阳极材料LaCrO3的晶胞如图Ⅲ所示,已知距离每个Cr原子最近的原子有6个,则图Ⅲ中___(填字母)原子代表的是Cr原子。
25.A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图_______。
(2)在1mol
DC2中,有___mol
D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有___个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是_____(填元素符号),三种10e-的化合物中沸点最低的___。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是__________。
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
参考答案
1.D
2.C
3.B
4.B
5.A
6.B
7.D
8.D
9.A
10.C
11.C
12.C
13.C
14.A
15.A
16.A
17.C
18.B
19.D
20.D
21.共价
3d84s2
2
MgCNi3
C
22.1s22s22p63s23p63d5
N2
配位键
1
sp
N>O>C
K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高
23.相反
O>Cl>Ti
平面三角形
>
3
分子晶体
6
2
3
24.Ti4CN3
+3
C
25.
4
12
C(N>O>C)
CH4
AD
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
选修3第三章第一节晶体的常识同步练习
第I卷(选择题)
一、单选题
1.下列关于晶体与非晶体的说法正确的是
A.晶体一定比非晶体的熔点高
B.晶体有自范性但排列无序
C.固体SiO2一定是晶体
D.非晶体无自范性而且排列无序
2.在研究晶体结构的时候,通常可以用“切割法”来计算一个晶胞中实际拥有的微粒数,从而确定其化学式。现有四种晶体的结构模型如图所示,其中化学式不属于AB型的是
A.
B.
C.
D.
3.晶体与非晶体的本质区别是(
)
A.晶体有规则的几何外形,而非晶体没有规则的几何外形
B.晶体内部粒子有序排列,而非晶体内部粒子无序排列
C.晶体有固定的熔点,而非晶体没有固定的熔点
D.晶体的硬度大,而非晶体的硬度小
4.下列有关化学用语的说法不正确的是( )
A.-OH和都表示羟基
B.如图是食盐晶体的晶胞
C.CH4分子的球棍模型:
D.次氯酸分子的电子式:
5.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为
(
)
A.1:3:1
B.2:3:1
C.2:2:1
D.1:3:3
6.区分晶体和非晶体的最科学的方法是(
)
A.测固体的熔点
B.对固体进行X射线衍射实验
C.看固体是否易被压缩
D.比较固体的导热性
7.下列物质中属于晶体的是( )
①橡胶 ②玻璃 ③食盐 ④水晶 ⑤塑料 ⑥胆矾
A.①④⑤
B.②③⑥
C.①③④
D.③④⑥
8.钙、钛、氧可形成如图所示的晶胞,则所形成的物质的化学式可表示为(
)
A.Ca8TiO12
B.Ca4TiO6
C.Ca4TiO3
D.CaTiO3
9.石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他3个碳原子相结合。据图分析,石墨晶体中碳原子数与共价键数之比为( )
A.2∶3
B.2∶1
C.1∶3
D.3∶2
10.下列说法不正确的是(
)
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.CO2溶于水和干冰升华都只有分子间作用力改变
D.石墨、金刚石互为同素异形体
11.下面二维平面晶体所表示的化学式为AX2的是(
)
A.
B.
C.
D.
12.报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图。则这种合金的化学式为
A.LaNi3
B.LaNi4
C.LaNi5
D.LaNi6
13.以NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.18
g冰(图1)中含O—H键数目为2NA
B.28
g晶体硅(图2)中含有Si—Si键数目为2NA
C.44
g干冰(图3)中含有4NA个CO2分子
D.石墨烯(图4)是碳原子单层片状新材料,12
g石墨烯中含C—C键数目为1.5NA
14.据2001年报道,由硼和镁形成的化合物刷新了金属化合物超导的最高纪录。如图示意的是该化合物的晶胞结构:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为(
)
A.MgB
B.Mg5B2
C.Mg2B
D.Mg2B3
15.已知CsCl晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,相邻的两个Cs+的核间距为acm,如图所示,则CsCl的相对分子质量可以表示为(
)
A.NA·a3·ρ
B.
C.
D.
16.纳米材料具有一些与传统材料不同的特征,下列关于纳米材料的叙述中,错误的是
A.三维空间尺寸必须都处于纳米尺度
B.具有既不同于微观粒子也不同于宏观物体的独特性质
C.是原子排列成的纳米数量级原子团
D.具有与晶态、非晶态均不同的一种新的结构状态
17.钒的某种氧化物的立方晶胞结构如图所示,晶胞参数为a
pm,下列说法错误的是
A.该钒的氧化物的化学式为VO2
B.V原子在该晶体中的堆积方式为体心立方
C.V原子的配位数与O的配位数之比为1:2
D.该晶胞的密度为
g/cm3
18.下列说法正确的是(
)
A.硼酸(H3BO3)分子中含有3个羟基,因此硼酸为三元酸
B.Ga、Ge、As、Se四种基态原子的第一电离能由小到大的顺序为Ga<Ge<Se<As
C.Cu3N形成的晶体结构如图所示,则与N3-等距离且最近的Cu+有3个
D.第二周期元素电负性由小到大顺序排列,B元素应位于第2位
19.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,平面结构如图所示。则x值为(?
?)
A.12
B.24
C.60
D.8
20.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成名称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K
等。下列分析正确的是
A.题干中所列举的
6
种钾石墨属于有机高分子化合物
B.钾石墨中碳原子的杂化方式是
sp3
杂化
C.若某钾石墨的原子分布如图所示,则它所表示的是
C12K
D.最近两个
K
原子之间的距离为石墨中
C—C
键键长的2倍
第II卷(非选择题)
二、填空题
21.按要求回答下列问题:
(1)C、Be、Cl、Fe等元素及其化合物有重要的应用。
①查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_______(填离子或共价)化合物。
(2)镍元素基态原子的价电子排布式为_______;3d能级上的未成对电子数为______。
(3)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图,则该化合物的化学式为______,C、Ni、Mg三种元素中,电负性最大的是______。
22.亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式_________;
(2)与CN-互为等电子体的分子是______,K4[Fe(CN)6]中的作用力除离子键和共价键外,还有_______。含有12mol
σ键的K4[Fe(CN)6]的物质的量为_______mol。
(3)黄血盐中C原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________;
(4)Fe、Na、K的晶体结构如图所示。
①钠的熔点比钾更高,原因是__________;
②Fe原子半径是r
cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_____g/cm3。
23.钛及其化合物应用广泛。
(1)(钛元素基态原子核外最外层电子的自旋状态___(填“相同”或“相反”)。
(2)已知一定条件下TiO2与TiCl4之间可以相互转化:TiO2TiCl4。
①Ti、Cl、O三种元素电负性由大到小的顺序为___。
②COCl2的分子构型为___,键角大小比较∠Cl—C—O___∠C1—C—Cl(填“>”或“<”),σ键和π键数目之比为___。
③已知室温下TiCl4为无色易溶于乙醇的液体,则TiCl4的晶体类型为___。
(3)配合物[TiCl(H2O)5]Cl2·H2O中,中心离子的配位数是___,向1mol该配合物中加入足量AgNO3溶液,可以得到___molAgCl沉淀。
(4)金红石型TiO2的晶胞(α=β=γ=90o)如图所示:TiO2晶体中O原子的配位数是___,其晶胞参数为:a=b=459pm,c=295pm,该晶体密度为___g/cm3(列出计算式)。
24.(1)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如图Ⅰ)顶点的氮原子,这种碳氮化钛化合物的化学式为___。
(2)图Ⅱ是由Q、Cu、O三种元素组成的一种高温超导体的晶胞结构,其中Cu为+2价,O为-2价,则Q的化合价为___价。
(3)一种新型阳极材料LaCrO3的晶胞如图Ⅲ所示,已知距离每个Cr原子最近的原子有6个,则图Ⅲ中___(填字母)原子代表的是Cr原子。
25.A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图_______。
(2)在1mol
DC2中,有___mol
D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有___个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是_____(填元素符号),三种10e-的化合物中沸点最低的___。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是__________。
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体
参考答案
1.D
2.C
3.B
4.B
5.A
6.B
7.D
8.D
9.A
10.C
11.C
12.C
13.C
14.A
15.A
16.A
17.C
18.B
19.D
20.D
21.共价
3d84s2
2
MgCNi3
C
22.1s22s22p63s23p63d5
N2
配位键
1
sp
N>O>C
K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高
23.相反
O>Cl>Ti
平面三角形
>
3
分子晶体
6
2
3
24.Ti4CN3
+3
C
25.
4
12
C
CH4
AD
21世纪教育网
www.21cnjy.com
精品试卷·第
2
页
(共
2
页)
HYPERLINK
"http://21世纪教育网(www.21cnjy.com)
"
21世纪教育网(www.21cnjy.com)
