2020—2021学年人教版(2019)选择性高中化学必修二章节自我强化训练3.1.5 金属晶体
文档属性
| 名称 | 2020—2021学年人教版(2019)选择性高中化学必修二章节自我强化训练3.1.5 金属晶体 |  | |
| 格式 | docx | ||
| 文件大小 | 384.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-29 11:24:13 | ||
图片预览



文档简介
2020—2021学年人教版(2019)选择性必修二章节自我强化训练3.1.5
金属晶体
1.下列说法不正确的是(
)
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越高
C.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以
精准复制
2.构成金属晶体的基本微粒(???
)
A.分子
B.阴离子和自由电子
C.阳离子和阴离子
D.阳离子和自由电子
3.已知金属钾的晶胞如图所示,下列有关叙述正确的是( )
A.该晶胞属于密置层的一种堆积方式
B.该晶胞是六棱柱
C.每个晶胞平均拥有9个K原子
D.每个K原子周围距离最近且相等的K原子有8个
4.下列有关说法正确的是(
)
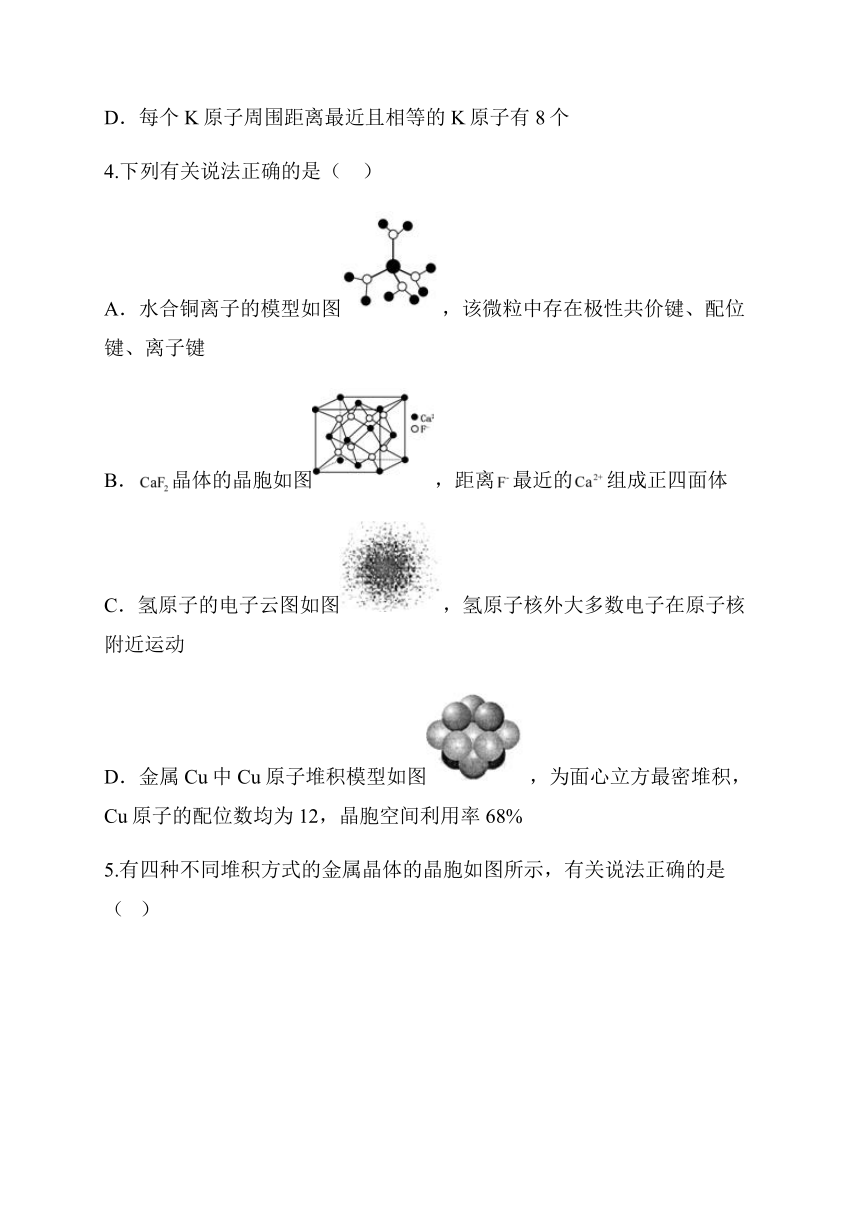
A.水合铜离子的模型如图,该微粒中存在极性共价键、配位键、离子键
B.晶体的晶胞如图,距离最近的组成正四面体
C.氢原子的电子云图如图,氢原子核外大多数电子在原子核附近运动
D.金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,Cu原子的配位数均为12,晶胞空间利用率68%
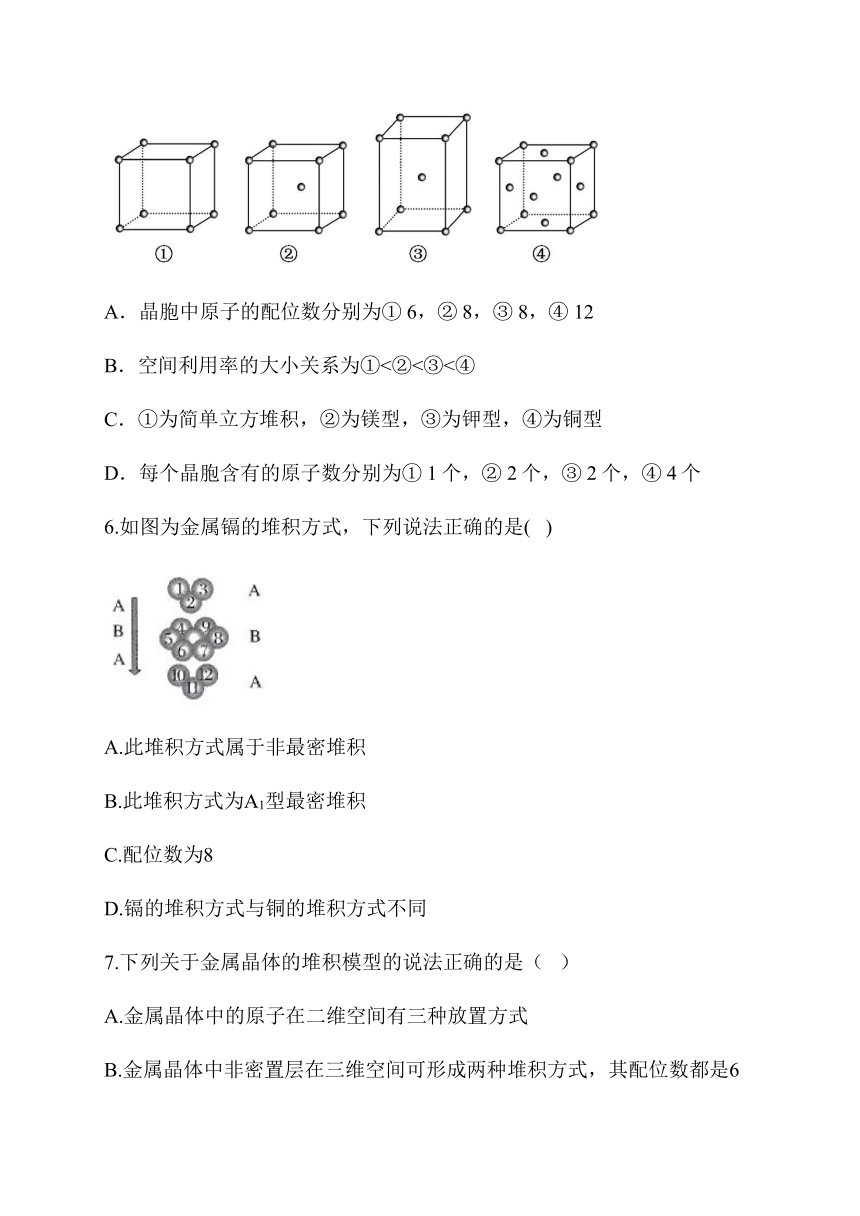
5.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(
)
A.晶胞中原子的配位数分别为①
6,②
8,③
8,④
12
B.空间利用率的大小关系为①<②<③<④
C.①为简单立方堆积,②为镁型,③为钾型,④为铜型
D.每个晶胞含有的原子数分别为①
1个,②
2个,③
2个,④
4个
6.如图为金属镉的堆积方式,下列说法正确的是(
)
A.此堆积方式属于非最密堆积
B.此堆积方式为A1型最密堆积
C.配位数为8
D.镉的堆积方式与铜的堆积方式不同
7.下列关于金属晶体的堆积模型的说法正确的是(
)
A.金属晶体中的原子在二维空间有三种放置方式
B.金属晶体中非密置层在三维空间可形成两种堆积方式,其配位数都是6
C.六方最密堆积和面心立方最密堆积是密置层在三维空间形成的两种堆积方式
D.金属晶体中的原子在三维空间的堆积有多种方式,其空间利用率相同
8.铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法不正确的是(
)
A.将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同
B.α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个
C.若δ-Fe晶胞边长为a
cm,α-Fe晶胞边长为b
cm,则两种晶体密度比为2b3:a3
D.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个
9.下列说法中正确的是(?
?)
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
10.下列关于金属及金属键的说法正确的是(
)
A.金属键具有方向性与饱和性
B.金属键是金属离子与自由电子间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属离子吸收并放出可见光
11.金属原子在二维空间里的放置如图所示的两种方式,下列说法中不正确的是(
??)
A.图(a)为密置层,在二维结构中配位数为6
B.图(b)为非密置层,在二维结构中配位数为4
C.图(a)在三维空间里密置堆积结构中配位数为12
D.图(b)在三维空间里非密置堆积结构中配位数为8
12.下列有关金属的说法正确的是(??
)
A.金属原子的核外电子在金属晶体中都是自由电子
B.体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.金属导电的实质是金属阳离子在外电场作用下的定向移动
13.下列关于晶体的叙述中错误的是(?
?)
A.金刚石中由共价键形成的最小的碳原子环上有六个碳原子
B.NaCl晶胞中共有4个Na+和4个Cl-
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cs+等距离紧邻的也有8个Cs+
D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
14.要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是(??
)
A.金属镁的硬度大于金属铝
B.碱金属单质的熔、沸点从到是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
15.金属晶体的原子堆积方式常有以下四种方式,请认真观察下列模型,回答下列问题:
(1).四种堆积模型的堆积名称依次是__________、__________、__________、__________。
(2).甲中的堆积方式,空间利用率为__________,只有金属__________采用这种堆积方式。?
(3).乙与丙中两种堆积方式中金属原子的配位数__________(填“相同”或“不相同”);乙中的空间利用率为__________。
(4).采取丁中堆积方式的金属通常有__________(任写三种金属元素的符号),每个晶胞中所含有的原子数为__________。
16.金属Cu晶体中的原子堆积方式如图所示,
其配位数为______,
铜的原子半径为
a
nm,
阿伏加德罗常数的值为NA,
Cu的密度为_________g/cm(
-3
列出计算式即可)。
17.根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为
_____基态铝原子核外电子云形状有______(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中σ键和π键的个数比为_____,分子中碳原子轨道的杂化类型是_______________。
(3)写出与互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,采纳六方最密堆积,采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由转变为晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用__________形象化描述。
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a
pm,该晶体的密度为___________g·cm-3.
18.硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2)
B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________
(标出配位键),其中心原子的
VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1
图2
图3
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg的堆积方式为______________,其晶胞结构如图4所示,把晶胞的底角是60o底边边长apm和棱边边长b
pm,
则晶胞的密度为______________
19.铜的冶炼和使用已有几千年历史,铜及其化合物的用途也越来越广泛。
回答下列问题:
(1).基态铜原子有__________种不同运动状态的电子,二价铜离子的电子排布式为__________。
(2).往硫酸铜溶液中滴加氨水可以观察到如下现象:先产生蓝色沉淀,后沉淀溶解得到深蓝色溶液。写出沉淀溶解的离子方程式__________。
(3).CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),该配离子中所含的非金属元素的电负性由大到小的顺序是__________;乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4).铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为__________。
(5).某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
①己知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于__________(填“离子”或“共价”)化合物。
②已知该晶体密度为ρ
g/cm3,阿伏加德罗常数为NA,则两个M原子的最近距离为__________pm(只写计算式)。
参考答案
1.答案:A
解析:
2.答案:D
解析:金属单质属于金属晶体,金属晶体由金属阳离子和自由电子构成,答案选D。
3.答案:D
解析:钾晶胞是非密置层的两种堆积方式中的一种,A错误;晶胞呈立方体,不是六棱柱,B错误;根据均摊法计算,每个晶胞有2个K原子,C错误。
4.答案:B
解析:
5.答案:D
解析:A.
③中的配位数是12,故A错误;
B.
①中空间利用率为51%,②中空间利用率为68%,③④中空间利用率为74%,所以空间利用率大小关系为:①<②<③=④,故B错误;
C.
②是体心立方堆积,属于钾、钠和铁型,③是六方最密堆积,属于镁、锌、钛型,故C错误;
D.
利用均摊法计算原子个数,①中原子个数=8×18=1,②中原子个数=1+8×18=2,③中原子个数=1+8×18=2,④中原子个数=8×18+6×12=4,故D正确;
故选D.
6.答案:D
解析:
7.答案:C
解析:
8.答案:A
解析:A.
将铁加热到1500℃分别急速冷却和缓慢冷却,温度不同,得到的晶体类型不相同,故错误;
B.
α?Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,铁原子个数=2×3=6,故正确;
C.
若δ?Fe晶胞边长为acm,α?Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+8×):(8×)=2:1,密度比=,故正确;
D.
δ?Fe晶体中,以体心铁原子为例,与之距离相等且最近的铁原子位晶胞的8个顶点上,故正确;
故选A.
9.答案:D
解析:离子晶体的结构不同,每个离子周围吸引的带相反电荷的离子数目不同;金属是由金属阳离子和自由电子构成的,自由电子并不是在外加电场的作用下才产生的,分子晶体在常温下也有呈固态的,如硫、白磷等。
10.答案:B
解析:
11.答案:D
解析:
12.答案:B
解析:本题可采用排除法。金属原子的核外电子在金属晶体中,最外层电子肯定是自由电子,内层电子或多或少受到核内质子的吸引,而不自由,至少不全是自由电子,故A错;金属原子在化学变化越容易失去电子,其还原性越强,而不是说失去电子越多就还原性强,故C错;金属导电是因其内的自由电子流动而成,而非金属阳离子在外电场作用下的定向移动,D错。排除后选B。
13.答案:C
解析:
A,金刚石结构中,每个碳原子能形成4个共价键,由共价键形成的最小碳环上有6个碳原子,故A正确;
B,根据均摊法,氯化钠晶胞中,氯离子个数4,钠离子个数4
,故B正确;
C,在CsCl晶体中每个Cs+周围都紧邻8个Cl-,每个Cs+等距离紧邻的有6个Cs+,
故C错误;
D,面心立方晶胞中,每个顶点、面心上各有一个金属原子,所以每个金属原子周围紧邻的有3×8×0.5=12个金属原子,故D正确;
14.答案:C
解析:镁离子比铝离子的半径大而所带的电荷少,所以金属镁比金属铝的金属键弱,熔、沸点和硬度都小;从到,离子的半径是逐渐增大的,所带电荷相同,金属键逐渐减弱,熔、沸点和硬度都逐渐减小;因离子的半径小而所带电荷多,使金属镁比金属钠的金属键强,所以金属镁比金属钠的熔、沸点和硬度都大;因离子的半径小而所带电荷相同,使金属镁比金属钙的金属键强,所以金属镁比金属钙的熔、沸点和硬度都大。
15.答案:(1).简单立方堆积;
六方最密堆积;
面心立方最密堆积;
体心立方堆积
(2).52%;
Po;
(3).相同;
74%;
(4).K、Na、Fe;
2
解析:(1).图甲的堆积方式是将非密置层的金属原子上下对齐,形成的晶胞是1个立方体,在立方体的每个顶角有1个金属原子,称为简单立方堆积。图乙和图丙都是密置层原子的堆积方式。图乙中上层和下层的3个原子组成的三角形方向相同,称为六方最密堆积。图丙中层和层的3个原子组成的三角形方向相反,称为面心立方最密堆积。图丁的堆积方式是将非密置层的上层金属原子填入下层金属原子形成的凹穴中,每层均按照此堆积,形成的晶胞是1个立方体,在立方体的每个顶角有1个原子,立方体的中心含有1个金属原子,称为体心立方堆积。
(2).简单立方堆积的空间利用率最低,为52%,采取这种堆积方式的只有。
(3).图乙和图丙两种堆积方式中,金属原子的配位数均为12,且其空间利用率均为74%。
(4).图丁是体心立方堆积,采取这种堆积方式的金属有等。用均摊法可求得每个晶胞中含有金属原子的个数为。
16.答案:12;
解析:金属Cu晶体中Cu原子的配位数=3×8÷2=12,铜的原子半径为anm,每个面对角线上的3个Cu原子紧密相邻,则晶胞棱长=,
晶胞体积=,
晶胞中Cu原子个数=8×1/8+6×1/2=4,Cu的密度=
17.答案:(1)1s22s22p63s23p63d24s2或[Ar]3d24s2;球形、哑铃形;
(2)2:1;sp2、sp;
(3)CH4、SiH4、GeH4;
、;
(4)X-射线衍射;
膨胀;
(5)电子云;
(6)4;
;
解析:
18.答案:(1);6
(2);
正四面体形;
、
(3);
sp3 、
sp2
(4)氢键、共价键;
(5)六方最密堆积;
2
解析:
19.答案:(1).29;
[Ar]3d9
(2).Cu(OH)2+4NH3·H2O
=[Cu(NH3)4]2++2OH-+4H2O(或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-)
(3).N>C>H;
乙二胺可以形成分子间氢键,而三甲胺不能
(4).12;
(5).①共价
②
解析:
金属晶体
1.下列说法不正确的是(
)
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越高
C.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以
精准复制
2.构成金属晶体的基本微粒(???
)
A.分子
B.阴离子和自由电子
C.阳离子和阴离子
D.阳离子和自由电子
3.已知金属钾的晶胞如图所示,下列有关叙述正确的是( )
A.该晶胞属于密置层的一种堆积方式
B.该晶胞是六棱柱
C.每个晶胞平均拥有9个K原子
D.每个K原子周围距离最近且相等的K原子有8个
4.下列有关说法正确的是(
)
A.水合铜离子的模型如图,该微粒中存在极性共价键、配位键、离子键
B.晶体的晶胞如图,距离最近的组成正四面体
C.氢原子的电子云图如图,氢原子核外大多数电子在原子核附近运动
D.金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,Cu原子的配位数均为12,晶胞空间利用率68%
5.有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是(
)
A.晶胞中原子的配位数分别为①
6,②
8,③
8,④
12
B.空间利用率的大小关系为①<②<③<④
C.①为简单立方堆积,②为镁型,③为钾型,④为铜型
D.每个晶胞含有的原子数分别为①
1个,②
2个,③
2个,④
4个
6.如图为金属镉的堆积方式,下列说法正确的是(
)
A.此堆积方式属于非最密堆积
B.此堆积方式为A1型最密堆积
C.配位数为8
D.镉的堆积方式与铜的堆积方式不同
7.下列关于金属晶体的堆积模型的说法正确的是(
)
A.金属晶体中的原子在二维空间有三种放置方式
B.金属晶体中非密置层在三维空间可形成两种堆积方式,其配位数都是6
C.六方最密堆积和面心立方最密堆积是密置层在三维空间形成的两种堆积方式
D.金属晶体中的原子在三维空间的堆积有多种方式,其空间利用率相同
8.铁有δ、γ、α三种同素异形体,如下图所示,三种晶体在不同温度下能发生转化。下列说法不正确的是(
)
A.将铁加热到1500°C分别急速冷却和缓慢冷却,得到的晶体类型相同
B.α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个
C.若δ-Fe晶胞边长为a
cm,α-Fe晶胞边长为b
cm,则两种晶体密度比为2b3:a3
D.δ-Fe晶体中与每个铁原子等距离且最近的铁原子有8个
9.下列说法中正确的是(?
?)
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
10.下列关于金属及金属键的说法正确的是(
)
A.金属键具有方向性与饱和性
B.金属键是金属离子与自由电子间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属具有光泽是因为金属离子吸收并放出可见光
11.金属原子在二维空间里的放置如图所示的两种方式,下列说法中不正确的是(
??)
A.图(a)为密置层,在二维结构中配位数为6
B.图(b)为非密置层,在二维结构中配位数为4
C.图(a)在三维空间里密置堆积结构中配位数为12
D.图(b)在三维空间里非密置堆积结构中配位数为8
12.下列有关金属的说法正确的是(??
)
A.金属原子的核外电子在金属晶体中都是自由电子
B.体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.金属导电的实质是金属阳离子在外电场作用下的定向移动
13.下列关于晶体的叙述中错误的是(?
?)
A.金刚石中由共价键形成的最小的碳原子环上有六个碳原子
B.NaCl晶胞中共有4个Na+和4个Cl-
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cs+等距离紧邻的也有8个Cs+
D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
14.要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小相关。由此判断下列说法正确的是(??
)
A.金属镁的硬度大于金属铝
B.碱金属单质的熔、沸点从到是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
15.金属晶体的原子堆积方式常有以下四种方式,请认真观察下列模型,回答下列问题:
(1).四种堆积模型的堆积名称依次是__________、__________、__________、__________。
(2).甲中的堆积方式,空间利用率为__________,只有金属__________采用这种堆积方式。?
(3).乙与丙中两种堆积方式中金属原子的配位数__________(填“相同”或“不相同”);乙中的空间利用率为__________。
(4).采取丁中堆积方式的金属通常有__________(任写三种金属元素的符号),每个晶胞中所含有的原子数为__________。
16.金属Cu晶体中的原子堆积方式如图所示,
其配位数为______,
铜的原子半径为
a
nm,
阿伏加德罗常数的值为NA,
Cu的密度为_________g/cm(
-3
列出计算式即可)。
17.根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为
_____基态铝原子核外电子云形状有______(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中σ键和π键的个数比为_____,分子中碳原子轨道的杂化类型是_______________。
(3)写出与互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,采纳六方最密堆积,采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由转变为晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用__________形象化描述。
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a
pm,该晶体的密度为___________g·cm-3.
18.硼的无机化学问题比周期表里任何一种元素都更复杂和变化多端。
(1)基态B原子的价电子轨道表达式为___________________,第二周期第一电离能比B高的元素有_______种。
(2)
B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为__________
(标出配位键),其中心原子的
VSEPR模型名称为________,写出[BH4]-的两种等电子体_____________________。
(3)图1表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数),图2表示的是一种五硼酸根离子,其中B原子的杂化方式为__________。
图1
图2
图3
(4)硼酸晶体是片层结构,图3表示的是其中一层的结构。同一层微粒间存在的作用力有______________
(5)1892年,化学家已用Mg还原B2O3制得硼单质。Mg的堆积方式为______________,其晶胞结构如图4所示,把晶胞的底角是60o底边边长apm和棱边边长b
pm,
则晶胞的密度为______________
19.铜的冶炼和使用已有几千年历史,铜及其化合物的用途也越来越广泛。
回答下列问题:
(1).基态铜原子有__________种不同运动状态的电子,二价铜离子的电子排布式为__________。
(2).往硫酸铜溶液中滴加氨水可以观察到如下现象:先产生蓝色沉淀,后沉淀溶解得到深蓝色溶液。写出沉淀溶解的离子方程式__________。
(3).CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),该配离子中所含的非金属元素的电负性由大到小的顺序是__________;乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4).铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为__________。
(5).某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
①己知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于__________(填“离子”或“共价”)化合物。
②已知该晶体密度为ρ
g/cm3,阿伏加德罗常数为NA,则两个M原子的最近距离为__________pm(只写计算式)。
参考答案
1.答案:A
解析:
2.答案:D
解析:金属单质属于金属晶体,金属晶体由金属阳离子和自由电子构成,答案选D。
3.答案:D
解析:钾晶胞是非密置层的两种堆积方式中的一种,A错误;晶胞呈立方体,不是六棱柱,B错误;根据均摊法计算,每个晶胞有2个K原子,C错误。
4.答案:B
解析:
5.答案:D
解析:A.
③中的配位数是12,故A错误;
B.
①中空间利用率为51%,②中空间利用率为68%,③④中空间利用率为74%,所以空间利用率大小关系为:①<②<③=④,故B错误;
C.
②是体心立方堆积,属于钾、钠和铁型,③是六方最密堆积,属于镁、锌、钛型,故C错误;
D.
利用均摊法计算原子个数,①中原子个数=8×18=1,②中原子个数=1+8×18=2,③中原子个数=1+8×18=2,④中原子个数=8×18+6×12=4,故D正确;
故选D.
6.答案:D
解析:
7.答案:C
解析:
8.答案:A
解析:A.
将铁加热到1500℃分别急速冷却和缓慢冷却,温度不同,得到的晶体类型不相同,故错误;
B.
α?Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,铁原子个数=2×3=6,故正确;
C.
若δ?Fe晶胞边长为acm,α?Fe晶胞边长为bcm,则两种晶体中铁原子个数之比=(1+8×):(8×)=2:1,密度比=,故正确;
D.
δ?Fe晶体中,以体心铁原子为例,与之距离相等且最近的铁原子位晶胞的8个顶点上,故正确;
故选A.
9.答案:D
解析:离子晶体的结构不同,每个离子周围吸引的带相反电荷的离子数目不同;金属是由金属阳离子和自由电子构成的,自由电子并不是在外加电场的作用下才产生的,分子晶体在常温下也有呈固态的,如硫、白磷等。
10.答案:B
解析:
11.答案:D
解析:
12.答案:B
解析:本题可采用排除法。金属原子的核外电子在金属晶体中,最外层电子肯定是自由电子,内层电子或多或少受到核内质子的吸引,而不自由,至少不全是自由电子,故A错;金属原子在化学变化越容易失去电子,其还原性越强,而不是说失去电子越多就还原性强,故C错;金属导电是因其内的自由电子流动而成,而非金属阳离子在外电场作用下的定向移动,D错。排除后选B。
13.答案:C
解析:
A,金刚石结构中,每个碳原子能形成4个共价键,由共价键形成的最小碳环上有6个碳原子,故A正确;
B,根据均摊法,氯化钠晶胞中,氯离子个数4,钠离子个数4
,故B正确;
C,在CsCl晶体中每个Cs+周围都紧邻8个Cl-,每个Cs+等距离紧邻的有6个Cs+,
故C错误;
D,面心立方晶胞中,每个顶点、面心上各有一个金属原子,所以每个金属原子周围紧邻的有3×8×0.5=12个金属原子,故D正确;
14.答案:C
解析:镁离子比铝离子的半径大而所带的电荷少,所以金属镁比金属铝的金属键弱,熔、沸点和硬度都小;从到,离子的半径是逐渐增大的,所带电荷相同,金属键逐渐减弱,熔、沸点和硬度都逐渐减小;因离子的半径小而所带电荷多,使金属镁比金属钠的金属键强,所以金属镁比金属钠的熔、沸点和硬度都大;因离子的半径小而所带电荷相同,使金属镁比金属钙的金属键强,所以金属镁比金属钙的熔、沸点和硬度都大。
15.答案:(1).简单立方堆积;
六方最密堆积;
面心立方最密堆积;
体心立方堆积
(2).52%;
Po;
(3).相同;
74%;
(4).K、Na、Fe;
2
解析:(1).图甲的堆积方式是将非密置层的金属原子上下对齐,形成的晶胞是1个立方体,在立方体的每个顶角有1个金属原子,称为简单立方堆积。图乙和图丙都是密置层原子的堆积方式。图乙中上层和下层的3个原子组成的三角形方向相同,称为六方最密堆积。图丙中层和层的3个原子组成的三角形方向相反,称为面心立方最密堆积。图丁的堆积方式是将非密置层的上层金属原子填入下层金属原子形成的凹穴中,每层均按照此堆积,形成的晶胞是1个立方体,在立方体的每个顶角有1个原子,立方体的中心含有1个金属原子,称为体心立方堆积。
(2).简单立方堆积的空间利用率最低,为52%,采取这种堆积方式的只有。
(3).图乙和图丙两种堆积方式中,金属原子的配位数均为12,且其空间利用率均为74%。
(4).图丁是体心立方堆积,采取这种堆积方式的金属有等。用均摊法可求得每个晶胞中含有金属原子的个数为。
16.答案:12;
解析:金属Cu晶体中Cu原子的配位数=3×8÷2=12,铜的原子半径为anm,每个面对角线上的3个Cu原子紧密相邻,则晶胞棱长=,
晶胞体积=,
晶胞中Cu原子个数=8×1/8+6×1/2=4,Cu的密度=
17.答案:(1)1s22s22p63s23p63d24s2或[Ar]3d24s2;球形、哑铃形;
(2)2:1;sp2、sp;
(3)CH4、SiH4、GeH4;
、;
(4)X-射线衍射;
膨胀;
(5)电子云;
(6)4;
;
解析:
18.答案:(1);6
(2);
正四面体形;
、
(3);
sp3 、
sp2
(4)氢键、共价键;
(5)六方最密堆积;
2
解析:
19.答案:(1).29;
[Ar]3d9
(2).Cu(OH)2+4NH3·H2O
=[Cu(NH3)4]2++2OH-+4H2O(或Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-)
(3).N>C>H;
乙二胺可以形成分子间氢键,而三甲胺不能
(4).12;
(5).①共价
②
解析:
