鲁教版高中化学必修一微项目1探秘膨松剂 练习(含解析)
文档属性
| 名称 | 鲁教版高中化学必修一微项目1探秘膨松剂 练习(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-29 09:53:31 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
微项目1探秘膨松剂
考点1碳酸氢钠的性质
1.(2019·江西南昌高一检测)胃酸的主要成分是盐酸,在医疗上,用以治疗胃酸过多的一种药剂是( )。21教育网
A.小苏打 B.纯碱 C.烧碱 D.石膏
答案: A
解析: 能与盐酸反应且生成物也无酸性的反应物,同时又不能对人体产生强烈刺激的物质是符合本题要求的答案。21cnjy.com
2.(2019·深圳期末考试_)?????????????§?_物质:①Na2O,②Na2O2,③NaCl,④Na2CO3溶液,⑤NaOH溶液,⑥NaHCO3溶液。其中不能与CO2反应的是( )。21·cn·jy·com
A.①④ B.②③ C.③⑥ D.⑤⑥
答案: C
解析: ①Na2_O???CO2???_应生成碳酸钠;②Na2O2与CO2反应生成碳酸钠和氧气;③NaCl不能与CO2反应;④Na2CO3溶液与CO2反应生成碳酸氢钠;⑤NaOH溶液与CO2反应生成碳酸钠或碳酸氢钠;⑥NaHCO3溶液不能与CO2反应。【来源:21cnj*y.co*m】
3.下列化合物与小苏打溶液反应,没有气体或沉淀生成的是( )。
A.烧碱 B.硫酸氢钠
C.氢氧化钡 D.过氧化钠
答案: A
解析: A项:NaOH与NaHCO3反应生成Na2CO3和H2O;B项:NaHSO4+NaHCO3Na2SO4+H2O+CO2↑;C项:Ba(OH)2+2NaHCO3BaCO3↓+Na2CO3+2H2O;D项:2Na2O2+2H2O4NaOH+O2↑,然后有:NaHCO3+NaOHNa2CO3+H2O。21*cnjy*com
4.(2019·天水高_?????????)??°???_热5 g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,则原混合物中碳酸钠的质量为( )。
A.3.38 g B.4.58 g C.4.16 g D.4.41 g
答案: C
解析: 碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,设混合物中含有x g NaHCO3,则
2NaHCO3Na2CO3+CO2↑+H2O Δm
2×84 g 62 g
x g 0.31 g
解得:x=0.84,
所以m(Na2CO3)=5 g-m(NaHCO3)=5 g-0.84 g=4.16 g。
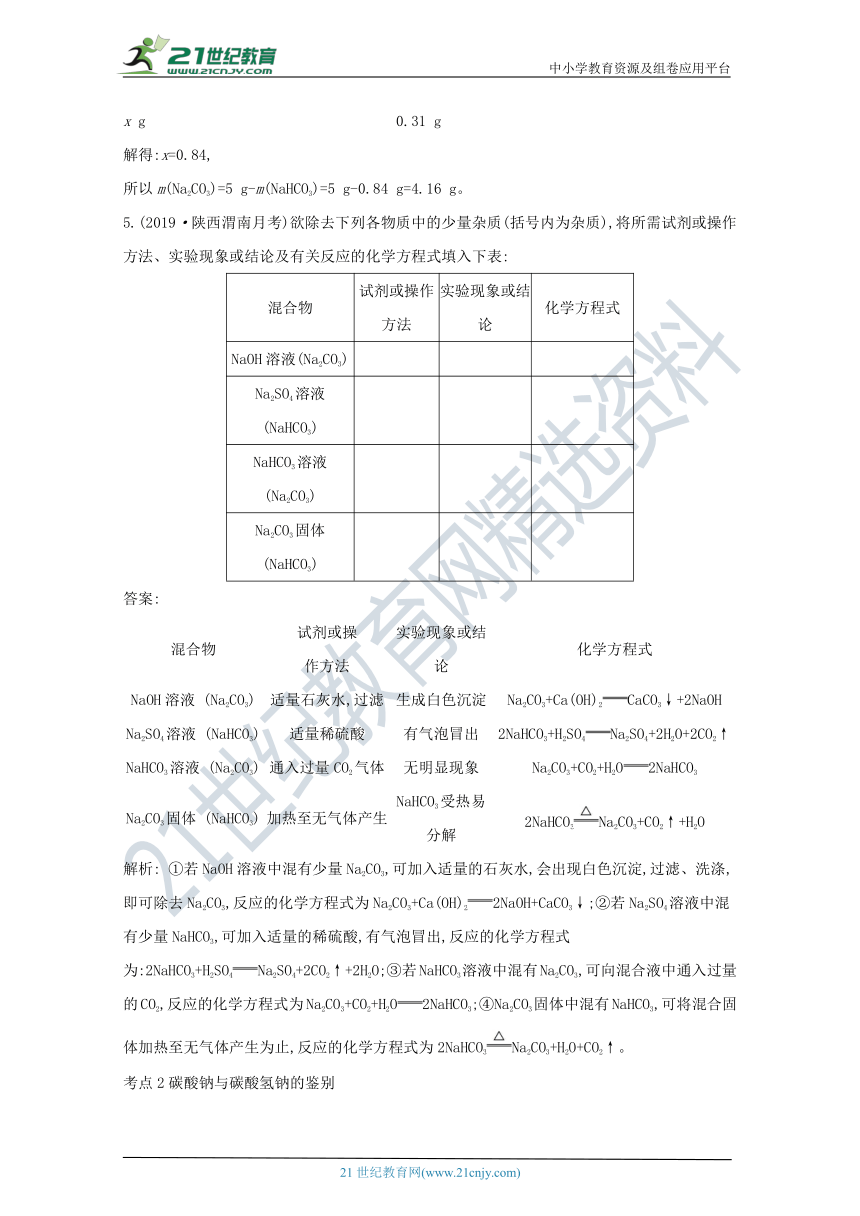
5.(2019_?·é??è???????????_考)欲除去下列各物质中的少量杂质(括号内为杂质),将所需试剂或操作方法、实验现象或结论及有关反应的化学方程式填入下表:【出处:21教育名师】
混合物 试剂或操作方法 实验现象或结论 化学方程式
NaOH溶液(Na2CO3)
Na2SO4溶液 (NaHCO3)
NaHCO3溶液 (Na2CO3)
Na2CO3固体 (NaHCO3)
答案:
混合物 试剂或操
作方法 实验现象或结论 化学方程式
NaOH溶液 (Na2CO3) 适量石灰水,过滤 生成白色沉淀 Na2CO3+Ca(OH)2CaCO3↓+2NaOH
Na2SO4溶液 (NaHCO3) 适量稀硫酸 有气泡冒出 2NaHCO3+H2SO4Na2SO4+2H2O+2CO2↑
NaHCO3溶液 (Na2CO3) 通入过量CO2气体 无明显现象 Na2CO3+CO2+H2O2NaHCO3
Na2CO3固体 (NaHCO3) 加热至无气体产生 NaHCO3受热易分解 2NaHCO3Na2CO3+CO2↑+H2O
解析: ①若NaOH溶液中混有少量Na2CO3,可加入适量的石灰水,会出现白色沉淀,过滤、洗涤,即可除去Na2CO3,反应的化学方程式为Na2CO3+Ca(OH)22NaOH+CaCO3↓;②若Na2SO4溶液中混有少量NaHCO3,可加入适量的稀硫酸,有气泡冒出,反应的化学方程式为:2NaHCO3+H2SO4Na2SO4+2CO2↑+2H2O;③若NaHCO3溶液中混有Na2CO3,可向混合液中通入过量的CO2,反应的化学方程式为Na2CO3+CO2+H2O2NaHCO3;④Na2CO3固体中混有NaHCO3,可将混合固体加热至无气体产生为止,反应的化学方程式为2NaHCO3Na2CO3+H2O+CO2↑。
考点2碳酸钠与碳酸氢钠的鉴别
6.下列有关碳酸钠和碳酸氢钠性质的说法中正确的是( )。
A.25 ℃时,碳酸氢钠在水中的溶解度比碳酸钠的小
B.用澄清石灰水能将碳酸钠溶液和碳酸氢钠溶液区别开来
C.加热时,碳酸钠、碳酸氢钠固体均能分解生成二氧化碳气体
D.常温下,浓度均为0.1 mol·L-1的溶液的碱性大小:NaHCO3>Na2CO3
答案: A
解析: 碳酸_é??????????????é??_氢钠溶液都能与澄清石灰水反应生成CaCO3沉淀,B项错误;碳酸钠固体受热不分解,C项错误;常温下,等浓度的碳酸钠溶液和碳酸氢钠溶液,碳酸钠溶液的碱性大于碳酸氢钠溶液,D项错误。【来源:21·世纪·教育·网】
7.(2019·湖北孝感高中月考)关于Na2CO3和NaHCO3性质的有关叙述正确的是( )。
A.在水中溶解度:Na2CO3B.热稳定性:Na2CO3C.与酸反应速度:Na2CO3D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3
答案: C
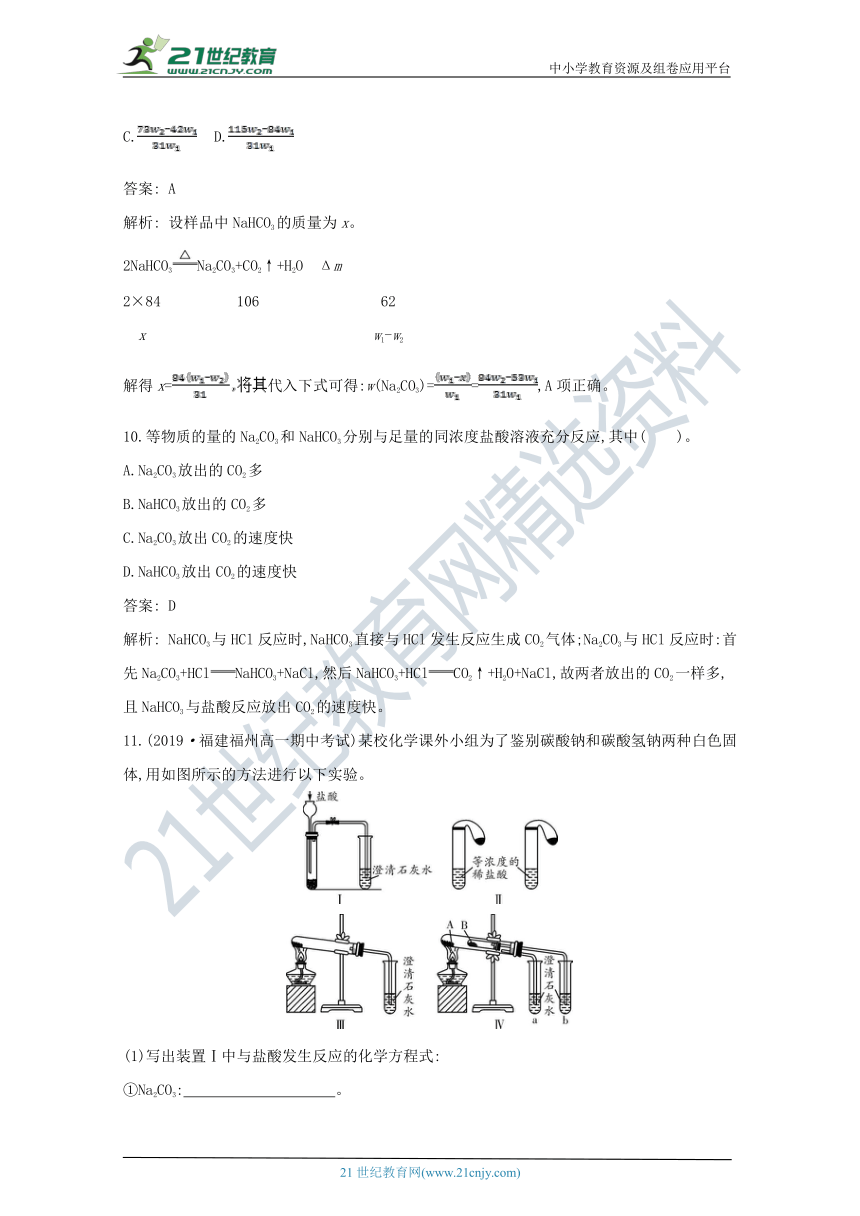
解析: 溶解度:NaHCO38.(2019·江苏宿迁高一期中测试)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )。www-2-1-cnjy-com
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
答案: C
解析: C项混合物与_?¨????é???????????_产物被碱石灰吸收的不仅是二氧化碳,还有水蒸气,所以无法准确地计算。其他几个选项的方法都可以通过计算得出结果。www.21-cn-jy.com
9.为了检验某含有NaHCO_3???è?¨???Na_2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )。2·1·c·n·j·y
A. B.
C. D.
答案: A
解析: 设样品中NaHCO3的质量为x。
2NaHCO3Na2CO3+CO2↑+H2O Δm
2×84 106 62
x w1-w2
解得x=代入下式可得:w(Na2CO3)==,A项正确。
10.等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,其中( )。
A.Na2CO3放出的CO2多
B.NaHCO3放出的CO2多
C.Na2CO3放出CO2的速度快
D.NaHCO3放出CO2的速度快
答案: D
解析: NaHCO3与HCl反应时,NaHCO3直接与HCl发生反应生成CO2气体;Na2CO3与HCl反应时:首先Na2CO3+HClNaHCO3+NaCl,然后NaHCO3+HClCO2↑+H2O+NaCl,故两者放出的CO2一样多,且NaHCO3与盐酸反应放出CO2的速度快。2-1-c-n-j-y
11.(2019·福建福州高一期中考试)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用如图所示的方法进行以下实验。
(1)写出装置Ⅰ中与盐酸发生反应的化学方程式:
①Na2CO3: 。?
②NaHCO3: 。?
③由此可知装置Ⅰ (填“能”或“不能”)鉴别Na2CO3和NaHCO3。?
答案: ①Na2CO3+2HCl2NaCl+H2O+CO2↑
②NaHCO3+HClNaCl+H2O+CO2↑ ③不能
解析: 装置Ⅰ中Na2CO3和NaHCO3均能与盐酸反应产生CO2,使澄清石灰水变浑浊,所以不能鉴别二者。21教育名师原创作品
(2)装置Ⅱ能鉴别Na2CO3和NaHCO3的现象是 。?
答案: 盛NaHCO3的装置比盛Na2CO3的装置反应更剧烈且反应后气球膨胀得快
解析: 装置Ⅱ利用NaHCO3与盐酸反应比Na2CO3快,则生成气体快进行鉴定。
(3)装置Ⅲ、Ⅳ均利用了Na2CO3和NaHCO3的 差异。有关化学方程式为 。?
答案: 热稳定性 2NaHCO3Na2CO3+H2O+CO2↑
解析: 装置Ⅲ、Ⅳ均利用了NaHCO3受热分解生成CO2而Na2CO3受热不分解。
(4)若用实验Ⅳ验证碳_é??é????????é???°?_钠的稳定性,则试管B中装入的固体最好是 (填化学式)。有的同学在盛Na2CO3的导管口观察到开始加热时也有气泡产生,据此认为Na2CO3加热也分解。你认为此观点 (填“正确”或“错误”)。分析产生此现象的原因为 。?
答案: NaHCO3 错误 大试管中的空气受热膨胀时逸出
解析: 酒精灯火焰_????????????è?????_A,然后预热试管B,因此试管B中盛放NaHCO3,更能说明稳定性:Na2CO3>NaHCO3。因为气体受热膨胀,所以a、b开始均能看到有气泡产生,只是a中产生的气泡不能使澄清石灰水变浑浊。21*cnjy*com
考点3钠的化合物混合体系组分的确定
12.(2019·黑_é???±????é???±±???_中高一期末)有由Na2CO3、NaHCO3、NaCl中的某几种物质组成的混合物,向混合物中加入足量盐酸有气体放出,若将上述混合物在空气中充分加热,也有气体放出,下列推断正确的是( )。【版权所有:21教育】
A.混合物中一定含有Na2CO3
B.混合物中一定不含有Na2CO3和NaCl
C.混合物中是否含有Na2CO3和NaCl无法确定
D.混合物中一定不含有NaCl
答案: C
解析: Na2C_O3???NaH_CO3都能与盐酸反应放出气体,混合物在空气中加热能够放出气体的,只有NaHCO3,所以一定存在NaHCO3,不能确定Na2CO3、NaCl是否存在。
13.已知某小苏打试样中含有NaCl杂质,为测定试样中小苏打的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,为b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。?
答案: 样品重,砝码轻
解析: 天平使用时需要注意左物右码,向左偏,说明物品重。
(2)装置中干燥管B的作用是 。?
答案: 防止空气中的CO2和水蒸气进入U形管中
解析: 该反应是利用向_?··????????????é??_,通过测量生成的CO2的质量来计算混合物中碳酸氢钠的含量。需要保证反应生成的气体完全被碱石灰吸收,还要防止外界气体中的CO2及水分的干扰。通入的空气需要通过氢氧化钠溶液吸收CO2,浓硫酸为除水装置,装置后的球形干燥管的作用是防止空气中CO2及水分进入U形管干扰CO2的检验。21世纪教育网版权所有
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填“偏高”“偏低”或“不变”)。?
答案: 偏高
(4)步骤⑤的目的是 。?
答案: 把反应产生的CO2全部导入U形管中
(5)步骤⑦的目的是 。?
答案: 判断反应产生的CO2是否全部排出,并被U形管中的碱石灰吸收
14.把a g固体NaHCO3加热分解一段时间后,固体质量变为b g。
(1)尚未分解的NaHCO3质量为 g。?
答案:
(2)生成Na2CO3的质量为 g。?
答案:(a-b)
(3)当b为 g时,表明NaHCO3完全分解。?
答案:
解析: 本题采用差量法。设已经分解的NaHCO3的质量为x,生成的Na2CO3的质量为y
2NaHCO3Na2CO3+CO2↑+H2O Δm
2×84 106 62
x y (a-b)g
解得x=g
y=g,即分解的NaHCO2为g,尚未分解的NaHCO3为g=g
(3)若NaHCO3完全分解,则b为:
2NaHCO3Na2CO3+H2O+CO2↑
168 106
a b
b=g=g
_21?????????è?????(www.21cnjy.com)_
微项目1探秘膨松剂
考点1碳酸氢钠的性质
1.(2019·江西南昌高一检测)胃酸的主要成分是盐酸,在医疗上,用以治疗胃酸过多的一种药剂是( )。21教育网
A.小苏打 B.纯碱 C.烧碱 D.石膏
答案: A
解析: 能与盐酸反应且生成物也无酸性的反应物,同时又不能对人体产生强烈刺激的物质是符合本题要求的答案。21cnjy.com
2.(2019·深圳期末考试_)?????????????§?_物质:①Na2O,②Na2O2,③NaCl,④Na2CO3溶液,⑤NaOH溶液,⑥NaHCO3溶液。其中不能与CO2反应的是( )。21·cn·jy·com
A.①④ B.②③ C.③⑥ D.⑤⑥
答案: C
解析: ①Na2_O???CO2???_应生成碳酸钠;②Na2O2与CO2反应生成碳酸钠和氧气;③NaCl不能与CO2反应;④Na2CO3溶液与CO2反应生成碳酸氢钠;⑤NaOH溶液与CO2反应生成碳酸钠或碳酸氢钠;⑥NaHCO3溶液不能与CO2反应。【来源:21cnj*y.co*m】
3.下列化合物与小苏打溶液反应,没有气体或沉淀生成的是( )。
A.烧碱 B.硫酸氢钠
C.氢氧化钡 D.过氧化钠
答案: A
解析: A项:NaOH与NaHCO3反应生成Na2CO3和H2O;B项:NaHSO4+NaHCO3Na2SO4+H2O+CO2↑;C项:Ba(OH)2+2NaHCO3BaCO3↓+Na2CO3+2H2O;D项:2Na2O2+2H2O4NaOH+O2↑,然后有:NaHCO3+NaOHNa2CO3+H2O。21*cnjy*com
4.(2019·天水高_?????????)??°???_热5 g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,则原混合物中碳酸钠的质量为( )。
A.3.38 g B.4.58 g C.4.16 g D.4.41 g
答案: C
解析: 碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,设混合物中含有x g NaHCO3,则
2NaHCO3Na2CO3+CO2↑+H2O Δm
2×84 g 62 g
x g 0.31 g
解得:x=0.84,
所以m(Na2CO3)=5 g-m(NaHCO3)=5 g-0.84 g=4.16 g。
5.(2019_?·é??è???????????_考)欲除去下列各物质中的少量杂质(括号内为杂质),将所需试剂或操作方法、实验现象或结论及有关反应的化学方程式填入下表:【出处:21教育名师】
混合物 试剂或操作方法 实验现象或结论 化学方程式
NaOH溶液(Na2CO3)
Na2SO4溶液 (NaHCO3)
NaHCO3溶液 (Na2CO3)
Na2CO3固体 (NaHCO3)
答案:
混合物 试剂或操
作方法 实验现象或结论 化学方程式
NaOH溶液 (Na2CO3) 适量石灰水,过滤 生成白色沉淀 Na2CO3+Ca(OH)2CaCO3↓+2NaOH
Na2SO4溶液 (NaHCO3) 适量稀硫酸 有气泡冒出 2NaHCO3+H2SO4Na2SO4+2H2O+2CO2↑
NaHCO3溶液 (Na2CO3) 通入过量CO2气体 无明显现象 Na2CO3+CO2+H2O2NaHCO3
Na2CO3固体 (NaHCO3) 加热至无气体产生 NaHCO3受热易分解 2NaHCO3Na2CO3+CO2↑+H2O
解析: ①若NaOH溶液中混有少量Na2CO3,可加入适量的石灰水,会出现白色沉淀,过滤、洗涤,即可除去Na2CO3,反应的化学方程式为Na2CO3+Ca(OH)22NaOH+CaCO3↓;②若Na2SO4溶液中混有少量NaHCO3,可加入适量的稀硫酸,有气泡冒出,反应的化学方程式为:2NaHCO3+H2SO4Na2SO4+2CO2↑+2H2O;③若NaHCO3溶液中混有Na2CO3,可向混合液中通入过量的CO2,反应的化学方程式为Na2CO3+CO2+H2O2NaHCO3;④Na2CO3固体中混有NaHCO3,可将混合固体加热至无气体产生为止,反应的化学方程式为2NaHCO3Na2CO3+H2O+CO2↑。
考点2碳酸钠与碳酸氢钠的鉴别
6.下列有关碳酸钠和碳酸氢钠性质的说法中正确的是( )。
A.25 ℃时,碳酸氢钠在水中的溶解度比碳酸钠的小
B.用澄清石灰水能将碳酸钠溶液和碳酸氢钠溶液区别开来
C.加热时,碳酸钠、碳酸氢钠固体均能分解生成二氧化碳气体
D.常温下,浓度均为0.1 mol·L-1的溶液的碱性大小:NaHCO3>Na2CO3
答案: A
解析: 碳酸_é??????????????é??_氢钠溶液都能与澄清石灰水反应生成CaCO3沉淀,B项错误;碳酸钠固体受热不分解,C项错误;常温下,等浓度的碳酸钠溶液和碳酸氢钠溶液,碳酸钠溶液的碱性大于碳酸氢钠溶液,D项错误。【来源:21·世纪·教育·网】
7.(2019·湖北孝感高中月考)关于Na2CO3和NaHCO3性质的有关叙述正确的是( )。
A.在水中溶解度:Na2CO3
答案: C
解析: 溶解度:NaHCO3
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
答案: C
解析: C项混合物与_?¨????é???????????_产物被碱石灰吸收的不仅是二氧化碳,还有水蒸气,所以无法准确地计算。其他几个选项的方法都可以通过计算得出结果。www.21-cn-jy.com
9.为了检验某含有NaHCO_3???è?¨???Na_2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )。2·1·c·n·j·y
A. B.
C. D.
答案: A
解析: 设样品中NaHCO3的质量为x。
2NaHCO3Na2CO3+CO2↑+H2O Δm
2×84 106 62
x w1-w2
解得x=代入下式可得:w(Na2CO3)==,A项正确。
10.等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,其中( )。
A.Na2CO3放出的CO2多
B.NaHCO3放出的CO2多
C.Na2CO3放出CO2的速度快
D.NaHCO3放出CO2的速度快
答案: D
解析: NaHCO3与HCl反应时,NaHCO3直接与HCl发生反应生成CO2气体;Na2CO3与HCl反应时:首先Na2CO3+HClNaHCO3+NaCl,然后NaHCO3+HClCO2↑+H2O+NaCl,故两者放出的CO2一样多,且NaHCO3与盐酸反应放出CO2的速度快。2-1-c-n-j-y
11.(2019·福建福州高一期中考试)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用如图所示的方法进行以下实验。
(1)写出装置Ⅰ中与盐酸发生反应的化学方程式:
①Na2CO3: 。?
②NaHCO3: 。?
③由此可知装置Ⅰ (填“能”或“不能”)鉴别Na2CO3和NaHCO3。?
答案: ①Na2CO3+2HCl2NaCl+H2O+CO2↑
②NaHCO3+HClNaCl+H2O+CO2↑ ③不能
解析: 装置Ⅰ中Na2CO3和NaHCO3均能与盐酸反应产生CO2,使澄清石灰水变浑浊,所以不能鉴别二者。21教育名师原创作品
(2)装置Ⅱ能鉴别Na2CO3和NaHCO3的现象是 。?
答案: 盛NaHCO3的装置比盛Na2CO3的装置反应更剧烈且反应后气球膨胀得快
解析: 装置Ⅱ利用NaHCO3与盐酸反应比Na2CO3快,则生成气体快进行鉴定。
(3)装置Ⅲ、Ⅳ均利用了Na2CO3和NaHCO3的 差异。有关化学方程式为 。?
答案: 热稳定性 2NaHCO3Na2CO3+H2O+CO2↑
解析: 装置Ⅲ、Ⅳ均利用了NaHCO3受热分解生成CO2而Na2CO3受热不分解。
(4)若用实验Ⅳ验证碳_é??é????????é???°?_钠的稳定性,则试管B中装入的固体最好是 (填化学式)。有的同学在盛Na2CO3的导管口观察到开始加热时也有气泡产生,据此认为Na2CO3加热也分解。你认为此观点 (填“正确”或“错误”)。分析产生此现象的原因为 。?
答案: NaHCO3 错误 大试管中的空气受热膨胀时逸出
解析: 酒精灯火焰_????????????è?????_A,然后预热试管B,因此试管B中盛放NaHCO3,更能说明稳定性:Na2CO3>NaHCO3。因为气体受热膨胀,所以a、b开始均能看到有气泡产生,只是a中产生的气泡不能使澄清石灰水变浑浊。21*cnjy*com
考点3钠的化合物混合体系组分的确定
12.(2019·黑_é???±????é???±±???_中高一期末)有由Na2CO3、NaHCO3、NaCl中的某几种物质组成的混合物,向混合物中加入足量盐酸有气体放出,若将上述混合物在空气中充分加热,也有气体放出,下列推断正确的是( )。【版权所有:21教育】
A.混合物中一定含有Na2CO3
B.混合物中一定不含有Na2CO3和NaCl
C.混合物中是否含有Na2CO3和NaCl无法确定
D.混合物中一定不含有NaCl
答案: C
解析: Na2C_O3???NaH_CO3都能与盐酸反应放出气体,混合物在空气中加热能够放出气体的,只有NaHCO3,所以一定存在NaHCO3,不能确定Na2CO3、NaCl是否存在。
13.已知某小苏打试样中含有NaCl杂质,为测定试样中小苏打的质量分数,可用下图中的装置进行实验。
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量,为b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量,为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明 。?
答案: 样品重,砝码轻
解析: 天平使用时需要注意左物右码,向左偏,说明物品重。
(2)装置中干燥管B的作用是 。?
答案: 防止空气中的CO2和水蒸气进入U形管中
解析: 该反应是利用向_?··????????????é??_,通过测量生成的CO2的质量来计算混合物中碳酸氢钠的含量。需要保证反应生成的气体完全被碱石灰吸收,还要防止外界气体中的CO2及水分的干扰。通入的空气需要通过氢氧化钠溶液吸收CO2,浓硫酸为除水装置,装置后的球形干燥管的作用是防止空气中CO2及水分进入U形管干扰CO2的检验。21世纪教育网版权所有
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填“偏高”“偏低”或“不变”)。?
答案: 偏高
(4)步骤⑤的目的是 。?
答案: 把反应产生的CO2全部导入U形管中
(5)步骤⑦的目的是 。?
答案: 判断反应产生的CO2是否全部排出,并被U形管中的碱石灰吸收
14.把a g固体NaHCO3加热分解一段时间后,固体质量变为b g。
(1)尚未分解的NaHCO3质量为 g。?
答案:
(2)生成Na2CO3的质量为 g。?
答案:(a-b)
(3)当b为 g时,表明NaHCO3完全分解。?
答案:
解析: 本题采用差量法。设已经分解的NaHCO3的质量为x,生成的Na2CO3的质量为y
2NaHCO3Na2CO3+CO2↑+H2O Δm
2×84 106 62
x y (a-b)g
解得x=g
y=g,即分解的NaHCO2为g,尚未分解的NaHCO3为g=g
(3)若NaHCO3完全分解,则b为:
2NaHCO3Na2CO3+H2O+CO2↑
168 106
a b
b=g=g
_21?????????è?????(www.21cnjy.com)_
