苏教版高中化学必修一4.1.1二氧化硫的性质和作用 课时作业(含解析)
文档属性
| 名称 | 苏教版高中化学必修一4.1.1二氧化硫的性质和作用 课时作业(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-29 16:43:14 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
课时作业24 二氧化硫的性质和作用
时间:45分钟 满分:100分
一、选择题(每小题5分,共50分)
1.下列关于SO2性质的说法中正确的是( C )
A.氯水中通入一定量SO2气体可增强氯水的漂白性
B.紫色石蕊试液中通入SO2,溶液先变红后褪色
C.SO2既可被氧化也可被还原
D.含有酚酞的NaOH溶液中通入SO2气体,溶液变为无色,说明SO2具有漂白性
解析:二氧化硫具有还原性,_?°??°????é????????_定量二氧化硫气体时,发生反应SO2+Cl2+2H2O===H2SO4+2HCl,减弱了氯水的漂白性,故A项错误。二氧化硫溶于水,和水反应生成亚硫酸,溶液显酸性,因此可使紫色石蕊试液变红,但不能使之褪色,故B项错误。二氧化硫中硫元素是+4价,是中间价态,所以SO2既有氧化性又有还原性,如SO2+2H2O+Cl2===H2SO4+2HCl中,S元素的化合价由+4价升高到+6,二氧化硫被氧化表现还原性;SO2+2H2S===2H2O+3S↓中,二氧化硫中S元素的化合价由+4降为0,二氧化硫被还原表现氧化性,故C项正确。含酚酞的NaOH溶液呈红色,将二氧化硫通入到含酚酞的氢氧化钠溶液中,溶液变无色,是因为SO2是酸性氧化物,与漂白性无关,故D项错误。
2.下列有关CO2和SO2的说法中,正确的是( C )
A.大量排放都能形成酸雨
B.都具有刺激性气味
C.都能使澄清石灰水变浑浊
D.都能使品红溶液褪色
解析:SO2大量排_??????é?????é??é?¨_,而CO2大量排放会引起温室效应,故A错误;CO2无气味,SO2具有刺激性气味,故B错误;CO2和SO2均能与澄清石灰水反应生成白色沉淀,故C正确;SO2具有漂白性,能使品红溶液褪色,而CO2不具有漂白性,故D错误。
3.下列实验能证明气体中存在SO2的是( D )
A.能使澄清石灰水变浑浊
B.能使湿润的蓝色石蕊试纸变红
C.通入足量的NaOH溶液中,然后滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸
D.能使新制氯水褪色,滴加BaCl2溶液后有白色沉淀生成
解析:CO2、SO2都属_???é????§?°§??????_,性质上有相似之处,如二者都具有酸性氧化物的通性,都能使澄清石灰水先变浑浊后变澄清,在碱性环境中,通入BaCl2溶液中均产生能溶于稀盐酸的沉淀等。SO2通入新制的氯水中发生反应SO2+Cl2+2H2O===H2SO4+2HCl,使新制氯水褪色,滴加BaCl2溶液后产生白色沉淀,而CO2不具备该性质。21世纪教育网版权所有
4.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( D )
①饱和Na2CO3溶液 ②饱和NaHCO3溶液
③浓H2SO4溶液 ④灼热的铜网 ⑤碱石灰
A.①③④ B.③④⑤
C.②④③ D.②③④
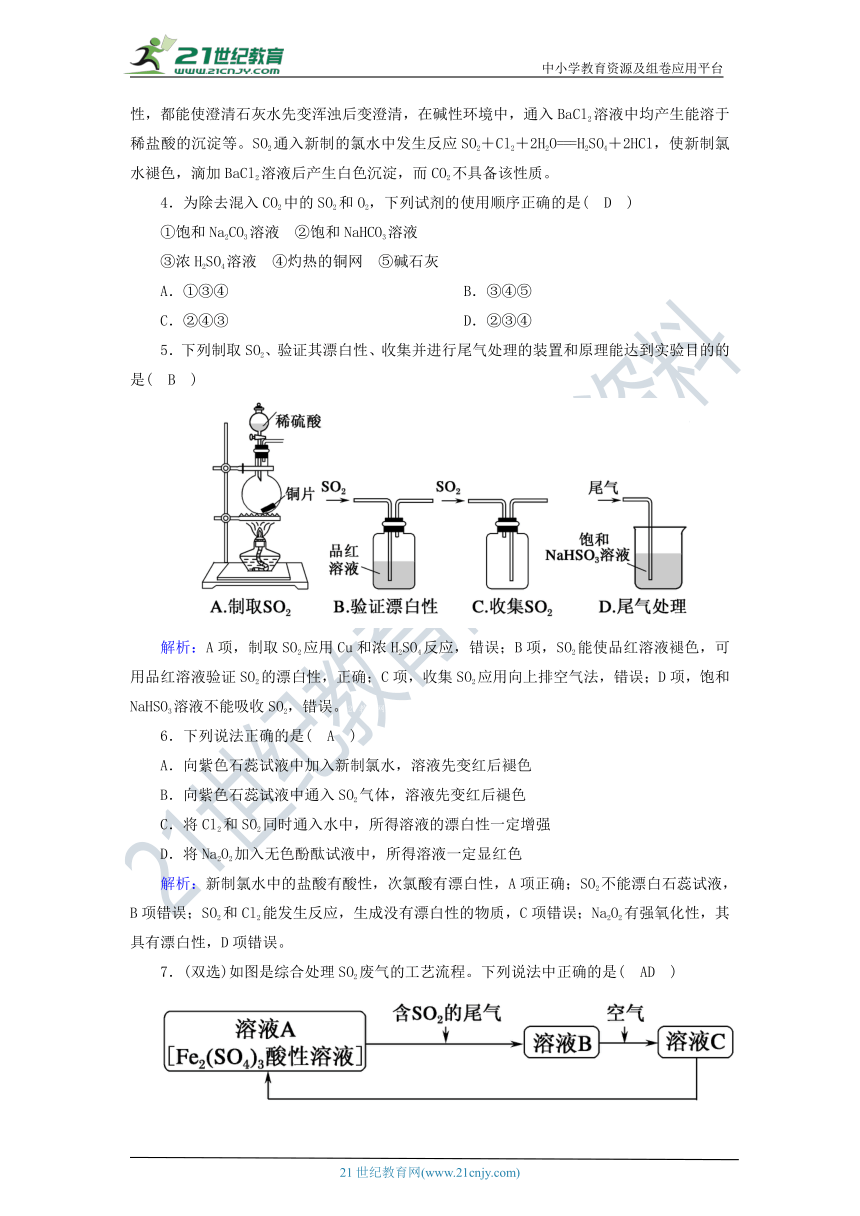
5.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( B )
解析:A项,_??????SO2???_用Cu和浓H2SO4反应,错误;B项,SO2能使品红溶液褪色,可用品红溶液验证SO2的漂白性,正确;C项,收集SO2应用向上排空气法,错误;D项,饱和NaHSO3溶液不能吸收SO2,错误。21教育网
6.下列说法正确的是( A )
A.向紫色石蕊试液中加入新制氯水,溶液先变红后褪色
B.向紫色石蕊试液中通入SO2气体,溶液先变红后褪色
C.将Cl2和SO2同时通入水中,所得溶液的漂白性一定增强
D.将Na2O2加入无色酚酞试液中,所得溶液一定显红色
解析:新制氯水中的_???é?????é????§???_次氯酸有漂白性,A项正确;SO2不能漂白石蕊试液,B项错误;SO2和Cl2能发生反应,生成没有漂白性的物质,C项错误;Na2O2有强氧化性,其具有漂白性,D项错误。21cnjy.com
7.(双选)如图是综合处理SO2废气的工艺流程。下列说法中正确的是( AD )
A.向溶液B中滴加KSCN溶液,溶液可能变为血红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2===2Fe3++2H2O
C.溶液酸性:A>B>C
D.加Fe2O3可以使溶液C转化为溶液A
解析:二氧化硫与铁离子_???????°§???è?????_反应生成Fe2+,若二氧化硫足量,则溶液中无Fe3+,加入KSCN溶液,溶液不显色;若二氧化硫不足,加入KSCN溶液,则溶液变红,选项A正确。溶液B中Fe2+被氧气氧化,离子方程式为4H++4Fe2++O2===4Fe3++2H2O,选项B错误。由溶液A到溶液B发生的反应为2H2O+2Fe3++SO2===2Fe2++4H++SO,溶液酸性增强,结合B项分析知由溶液B到溶液C的转化溶液酸性减弱,综合分析知溶液A的酸性弱于溶液C的酸性,选项C错误。加入适量Fe2O3可以与溶液C中生成的部分硫酸反应,使溶液C转化为溶液A,选项D正确。21·cn·jy·com
8.某硫酸厂废气中SO2的回收利用方案如下图所示,下列说法中不正确的是( B )
A.X可能含有2种盐
B.a是SO3
C.Y中可能含有(NH4)2SO4
D.(NH4)2S2O8中S的化合价不可能为+7
解析:X中含有亚硫酸铵与亚硫酸氢_é????????????§????_两种,故A正确;气体a为二氧化硫,故B错误;X中加过量硫酸生成硫酸铵或硫酸氢铵,故C正确;(NH4)2S2O8中S的最高化合价是+6,不可能是+7,O的化合价有-1、-2价,故D正确。www.21-cn-jy.com
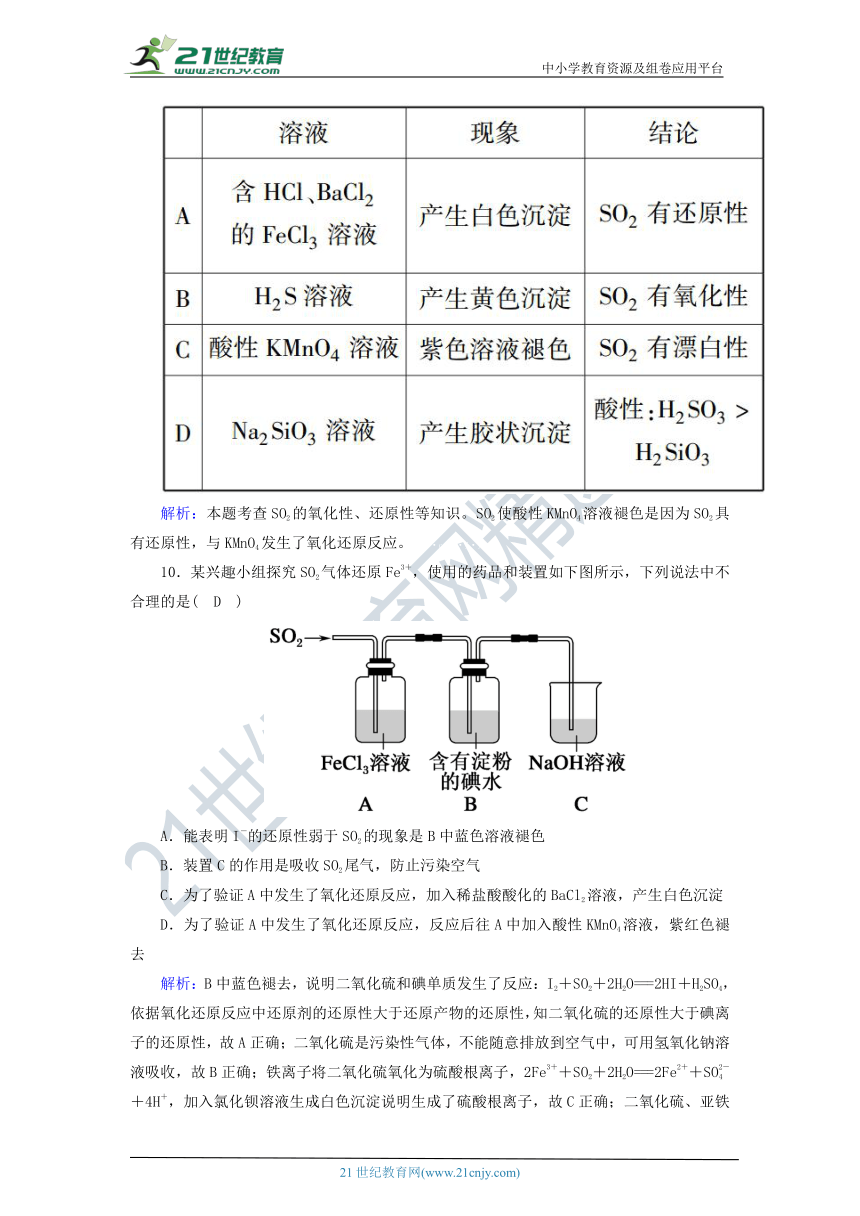
9.根据SO2通入不同溶液中的实验现象,所得结论不正确的是( C )
解析:本题考查SO2的氧化性、还原性等知识。SO2使酸性KMnO4溶液褪色是因为SO2具有还原性,与KMnO4发生了氧化还原反应。2·1·c·n·j·y
10.某兴趣小组探究SO2气体还原Fe3+,使用的药品和装置如下图所示,下列说法中不合理的是( D )【来源:21·世纪·教育·网】
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,反应后往A中加入酸性KMnO4溶液,紫红色褪去
解析:B中蓝色褪去,说明二氧化_????????????è?¨???_生了反应:I2+SO2+2H2O===2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物的还原性,知二氧化硫的还原性大于碘离子的还原性,故A正确;二氧化硫是污染性气体,不能随意排放到空气中,可用氢氧化钠溶液吸收,故B正确;铁离子将二氧化硫氧化为硫酸根离子,2Fe3++SO2+2H2O===2Fe2++SO+4H+,加入氯化钡溶液生成白色沉淀说明生成了硫酸根离子,故C正确;二氧化硫、亚铁离子都具有还原性,都可以和酸性高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故D错误。21·世纪*教育网
二、非选择题(共50分)
11.(12分)向BaCl2溶液_???é?????SO2_后,将溶液分置于两支试管中。向一份中加入NaOH溶液,出现白色沉淀A;另一份通入少量Cl2,产生白色沉淀B。试回答下列问题:
(1)若不考虑SO2_????°?????????????_BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”。此处应为不反应,原因是弱酸不能制强酸。
(2)沉淀A的化学式为BaSO3,该沉淀能否溶于稀盐酸?能。
(3)写出生成沉淀B的离子方程式:
Ba2++SO2+Cl2+2H2O===BaSO4↓+2Cl-+4H+。
(4)生成2.33 g沉淀B,需要消耗标准状况下的Cl2224 mL。
解析:加入NaOH溶液发生的反应为
Ba2++SO2+2OH-===BaSO3↓+H2O;①
通入Cl2发生的反应为
Ba2++SO2+Cl2+2H2O===BaSO4↓+2Cl-+4H+。②
由方程式②:BaSO4 ~ Cl2
233 g 22 400 mL
2.33 g V(Cl2)
故V(Cl2)=224 mL。
12.(20分)某化学兴趣小组用图1装置探究二氧化硫的性质:
(1)图1中倒扣漏斗的作用是防止倒吸。
(2)实验室用亚_???é??é???????????_浓硫酸反应制取SO2气体,写出该反应的化学方程式:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。21*cnjy*com
(3)将SO2气体分别通入下列X溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液中,现象是紫色溶液变为红色,继续通入SO2气体,现象是红色不褪去(或溶液颜色无变化)。【来源:21cnj*y.co*m】
②SO2通入酸性KMnO4溶液,现象是溶液的紫红色褪去。
③SO2慢慢通入澄清石灰水中,现象是先有白色沉淀生成,后白色沉淀消失。
(4)某同学制取的_SO2?°???????_混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体。可以选择图2洗气装置设计实验。洗气装置中的溶液是:A.浓硫酸、B.氢氧化钠溶液、C.硫酸铜溶液、D.品红溶液、E.澄清石灰水、F.酸性高锰酸钾溶液、G.碳酸氢钠溶液。为达到实验目的,上述装置所装试剂的连接顺序是DFDE(合理即可)(用字母表示,所给试剂可以重复使用,有些试剂也可以不用)。www-2-1-cnjy-com
解析:(1)图1中_??????????????????_用是防止倒吸。(2)浓硫酸和亚硫酸钠反应生成硫酸钠、SO2和水,化学方程式为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。(3)①SO2溶于水生成亚硫酸,溶液显酸性,所以溶液显红色。由于SO2不能使酸碱指示剂褪色,所以继续通入SO2,溶液的颜色不会变化。②SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应,所以溶液的紫红色会褪去。③SO2是酸性氧化物,和氢氧化钙反应生成亚硫酸钙白色沉淀和水。继续通入SO2,白色沉淀溶解。(4)检验SO2一般用品红溶液,检验CO2一般用澄清石灰水。由于SO2也能使澄清石灰水变浑浊,所以先检验SO2,且在气体通入澄清石灰水之前,还应除去SO2,除去SO2用酸性高锰酸钾溶液,再用品红溶液来检验SO2是否除尽。
13.(18分)为检验_??????é???????¨???_在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。【版权所有:21教育】
回答下列问题:
(1)实验前欲检查装置A的气密性_?????????é????????_操作是关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶,若装置C中有气泡冒出,移开手掌(或热源)后,装置C处导管内形成水柱,则证明装置A的气密性良好(或关闭止水夹a,向分液漏斗加水,打开旋塞,水不会一直流下,则证明装置A的气密性良好)。
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是③①②(填操作编号)。【出处:21教育名师】
①向装置A中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊_B???????§???????_变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
(3)实验时,装置C中的现象为品红溶液褪色。
(4)当D中产生A(填序号)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2。
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
D.脱脂棉上蓝色不变
则装置D的作用为除去SO2并检验SO2已被除尽。
解析:(2)为控制反应的速率_????????¨?°?????°?_气体收集起来,再用气囊中的气体进行实验,所以操作为打开止水夹a和c,关闭止水夹b;向装置A中加入浓硫酸,加热,使装置A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b。(3)二氧化硫能使品红溶液褪色。(4)装置D用碘与二氧化硫反应除去二氧化硫,所以在进气一端碘与二氧化硫反应使得进气口一端脱脂棉蓝色变浅,在出气口一端二氧化硫被除尽,出气口一端脱脂棉蓝色不变,说明出气口出的气体是二氧化碳,A项正确;根据以上分析可知,装置D的作用为除去SO2并检验SO2已被除尽。2-1-c-n-j-y
_21?????????è?????(www.21cnjy.com)_
课时作业24 二氧化硫的性质和作用
时间:45分钟 满分:100分
一、选择题(每小题5分,共50分)
1.下列关于SO2性质的说法中正确的是( C )
A.氯水中通入一定量SO2气体可增强氯水的漂白性
B.紫色石蕊试液中通入SO2,溶液先变红后褪色
C.SO2既可被氧化也可被还原
D.含有酚酞的NaOH溶液中通入SO2气体,溶液变为无色,说明SO2具有漂白性
解析:二氧化硫具有还原性,_?°??°????é????????_定量二氧化硫气体时,发生反应SO2+Cl2+2H2O===H2SO4+2HCl,减弱了氯水的漂白性,故A项错误。二氧化硫溶于水,和水反应生成亚硫酸,溶液显酸性,因此可使紫色石蕊试液变红,但不能使之褪色,故B项错误。二氧化硫中硫元素是+4价,是中间价态,所以SO2既有氧化性又有还原性,如SO2+2H2O+Cl2===H2SO4+2HCl中,S元素的化合价由+4价升高到+6,二氧化硫被氧化表现还原性;SO2+2H2S===2H2O+3S↓中,二氧化硫中S元素的化合价由+4降为0,二氧化硫被还原表现氧化性,故C项正确。含酚酞的NaOH溶液呈红色,将二氧化硫通入到含酚酞的氢氧化钠溶液中,溶液变无色,是因为SO2是酸性氧化物,与漂白性无关,故D项错误。
2.下列有关CO2和SO2的说法中,正确的是( C )
A.大量排放都能形成酸雨
B.都具有刺激性气味
C.都能使澄清石灰水变浑浊
D.都能使品红溶液褪色
解析:SO2大量排_??????é?????é??é?¨_,而CO2大量排放会引起温室效应,故A错误;CO2无气味,SO2具有刺激性气味,故B错误;CO2和SO2均能与澄清石灰水反应生成白色沉淀,故C正确;SO2具有漂白性,能使品红溶液褪色,而CO2不具有漂白性,故D错误。
3.下列实验能证明气体中存在SO2的是( D )
A.能使澄清石灰水变浑浊
B.能使湿润的蓝色石蕊试纸变红
C.通入足量的NaOH溶液中,然后滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸
D.能使新制氯水褪色,滴加BaCl2溶液后有白色沉淀生成
解析:CO2、SO2都属_???é????§?°§??????_,性质上有相似之处,如二者都具有酸性氧化物的通性,都能使澄清石灰水先变浑浊后变澄清,在碱性环境中,通入BaCl2溶液中均产生能溶于稀盐酸的沉淀等。SO2通入新制的氯水中发生反应SO2+Cl2+2H2O===H2SO4+2HCl,使新制氯水褪色,滴加BaCl2溶液后产生白色沉淀,而CO2不具备该性质。21世纪教育网版权所有
4.为除去混入CO2中的SO2和O2,下列试剂的使用顺序正确的是( D )
①饱和Na2CO3溶液 ②饱和NaHCO3溶液
③浓H2SO4溶液 ④灼热的铜网 ⑤碱石灰
A.①③④ B.③④⑤
C.②④③ D.②③④
5.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( B )
解析:A项,_??????SO2???_用Cu和浓H2SO4反应,错误;B项,SO2能使品红溶液褪色,可用品红溶液验证SO2的漂白性,正确;C项,收集SO2应用向上排空气法,错误;D项,饱和NaHSO3溶液不能吸收SO2,错误。21教育网
6.下列说法正确的是( A )
A.向紫色石蕊试液中加入新制氯水,溶液先变红后褪色
B.向紫色石蕊试液中通入SO2气体,溶液先变红后褪色
C.将Cl2和SO2同时通入水中,所得溶液的漂白性一定增强
D.将Na2O2加入无色酚酞试液中,所得溶液一定显红色
解析:新制氯水中的_???é?????é????§???_次氯酸有漂白性,A项正确;SO2不能漂白石蕊试液,B项错误;SO2和Cl2能发生反应,生成没有漂白性的物质,C项错误;Na2O2有强氧化性,其具有漂白性,D项错误。21cnjy.com
7.(双选)如图是综合处理SO2废气的工艺流程。下列说法中正确的是( AD )
A.向溶液B中滴加KSCN溶液,溶液可能变为血红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2===2Fe3++2H2O
C.溶液酸性:A>B>C
D.加Fe2O3可以使溶液C转化为溶液A
解析:二氧化硫与铁离子_???????°§???è?????_反应生成Fe2+,若二氧化硫足量,则溶液中无Fe3+,加入KSCN溶液,溶液不显色;若二氧化硫不足,加入KSCN溶液,则溶液变红,选项A正确。溶液B中Fe2+被氧气氧化,离子方程式为4H++4Fe2++O2===4Fe3++2H2O,选项B错误。由溶液A到溶液B发生的反应为2H2O+2Fe3++SO2===2Fe2++4H++SO,溶液酸性增强,结合B项分析知由溶液B到溶液C的转化溶液酸性减弱,综合分析知溶液A的酸性弱于溶液C的酸性,选项C错误。加入适量Fe2O3可以与溶液C中生成的部分硫酸反应,使溶液C转化为溶液A,选项D正确。21·cn·jy·com
8.某硫酸厂废气中SO2的回收利用方案如下图所示,下列说法中不正确的是( B )
A.X可能含有2种盐
B.a是SO3
C.Y中可能含有(NH4)2SO4
D.(NH4)2S2O8中S的化合价不可能为+7
解析:X中含有亚硫酸铵与亚硫酸氢_é????????????§????_两种,故A正确;气体a为二氧化硫,故B错误;X中加过量硫酸生成硫酸铵或硫酸氢铵,故C正确;(NH4)2S2O8中S的最高化合价是+6,不可能是+7,O的化合价有-1、-2价,故D正确。www.21-cn-jy.com
9.根据SO2通入不同溶液中的实验现象,所得结论不正确的是( C )
解析:本题考查SO2的氧化性、还原性等知识。SO2使酸性KMnO4溶液褪色是因为SO2具有还原性,与KMnO4发生了氧化还原反应。2·1·c·n·j·y
10.某兴趣小组探究SO2气体还原Fe3+,使用的药品和装置如下图所示,下列说法中不合理的是( D )【来源:21·世纪·教育·网】
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入稀盐酸酸化的BaCl2溶液,产生白色沉淀
D.为了验证A中发生了氧化还原反应,反应后往A中加入酸性KMnO4溶液,紫红色褪去
解析:B中蓝色褪去,说明二氧化_????????????è?¨???_生了反应:I2+SO2+2H2O===2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物的还原性,知二氧化硫的还原性大于碘离子的还原性,故A正确;二氧化硫是污染性气体,不能随意排放到空气中,可用氢氧化钠溶液吸收,故B正确;铁离子将二氧化硫氧化为硫酸根离子,2Fe3++SO2+2H2O===2Fe2++SO+4H+,加入氯化钡溶液生成白色沉淀说明生成了硫酸根离子,故C正确;二氧化硫、亚铁离子都具有还原性,都可以和酸性高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故D错误。21·世纪*教育网
二、非选择题(共50分)
11.(12分)向BaCl2溶液_???é?????SO2_后,将溶液分置于两支试管中。向一份中加入NaOH溶液,出现白色沉淀A;另一份通入少量Cl2,产生白色沉淀B。试回答下列问题:
(1)若不考虑SO2_????°?????????????_BaCl2溶液中通入SO2无明显现象,“无明显现象”可能是“不反应”,也可能是“反应但无现象”。此处应为不反应,原因是弱酸不能制强酸。
(2)沉淀A的化学式为BaSO3,该沉淀能否溶于稀盐酸?能。
(3)写出生成沉淀B的离子方程式:
Ba2++SO2+Cl2+2H2O===BaSO4↓+2Cl-+4H+。
(4)生成2.33 g沉淀B,需要消耗标准状况下的Cl2224 mL。
解析:加入NaOH溶液发生的反应为
Ba2++SO2+2OH-===BaSO3↓+H2O;①
通入Cl2发生的反应为
Ba2++SO2+Cl2+2H2O===BaSO4↓+2Cl-+4H+。②
由方程式②:BaSO4 ~ Cl2
233 g 22 400 mL
2.33 g V(Cl2)
故V(Cl2)=224 mL。
12.(20分)某化学兴趣小组用图1装置探究二氧化硫的性质:
(1)图1中倒扣漏斗的作用是防止倒吸。
(2)实验室用亚_???é??é???????????_浓硫酸反应制取SO2气体,写出该反应的化学方程式:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。21*cnjy*com
(3)将SO2气体分别通入下列X溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液中,现象是紫色溶液变为红色,继续通入SO2气体,现象是红色不褪去(或溶液颜色无变化)。【来源:21cnj*y.co*m】
②SO2通入酸性KMnO4溶液,现象是溶液的紫红色褪去。
③SO2慢慢通入澄清石灰水中,现象是先有白色沉淀生成,后白色沉淀消失。
(4)某同学制取的_SO2?°???????_混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体。可以选择图2洗气装置设计实验。洗气装置中的溶液是:A.浓硫酸、B.氢氧化钠溶液、C.硫酸铜溶液、D.品红溶液、E.澄清石灰水、F.酸性高锰酸钾溶液、G.碳酸氢钠溶液。为达到实验目的,上述装置所装试剂的连接顺序是DFDE(合理即可)(用字母表示,所给试剂可以重复使用,有些试剂也可以不用)。www-2-1-cnjy-com
解析:(1)图1中_??????????????????_用是防止倒吸。(2)浓硫酸和亚硫酸钠反应生成硫酸钠、SO2和水,化学方程式为Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。(3)①SO2溶于水生成亚硫酸,溶液显酸性,所以溶液显红色。由于SO2不能使酸碱指示剂褪色,所以继续通入SO2,溶液的颜色不会变化。②SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应,所以溶液的紫红色会褪去。③SO2是酸性氧化物,和氢氧化钙反应生成亚硫酸钙白色沉淀和水。继续通入SO2,白色沉淀溶解。(4)检验SO2一般用品红溶液,检验CO2一般用澄清石灰水。由于SO2也能使澄清石灰水变浑浊,所以先检验SO2,且在气体通入澄清石灰水之前,还应除去SO2,除去SO2用酸性高锰酸钾溶液,再用品红溶液来检验SO2是否除尽。
13.(18分)为检验_??????é???????¨???_在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。【版权所有:21教育】
回答下列问题:
(1)实验前欲检查装置A的气密性_?????????é????????_操作是关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶,若装置C中有气泡冒出,移开手掌(或热源)后,装置C处导管内形成水柱,则证明装置A的气密性良好(或关闭止水夹a,向分液漏斗加水,打开旋塞,水不会一直流下,则证明装置A的气密性良好)。
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是③①②(填操作编号)。【出处:21教育名师】
①向装置A中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热
②待装置A冷却,且气囊_B???????§???????_变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b
③打开止水夹a和c,关闭止水夹b
(3)实验时,装置C中的现象为品红溶液褪色。
(4)当D中产生A(填序号)现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2。
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
D.脱脂棉上蓝色不变
则装置D的作用为除去SO2并检验SO2已被除尽。
解析:(2)为控制反应的速率_????????¨?°?????°?_气体收集起来,再用气囊中的气体进行实验,所以操作为打开止水夹a和c,关闭止水夹b;向装置A中加入浓硫酸,加热,使装置A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b。(3)二氧化硫能使品红溶液褪色。(4)装置D用碘与二氧化硫反应除去二氧化硫,所以在进气一端碘与二氧化硫反应使得进气口一端脱脂棉蓝色变浅,在出气口一端二氧化硫被除尽,出气口一端脱脂棉蓝色不变,说明出气口出的气体是二氧化碳,A项正确;根据以上分析可知,装置D的作用为除去SO2并检验SO2已被除尽。2-1-c-n-j-y
_21?????????è?????(www.21cnjy.com)_
