人教版2019高中化学必修第二册第六章第一节化学反应与能量变化 课件 (共23张PPT)
文档属性
| 名称 | 人教版2019高中化学必修第二册第六章第一节化学反应与能量变化 课件 (共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-02 20:03:21 | ||
图片预览





文档简介
第一节 化学反应与能量变化
化学电池
(1)概念:
将化学能变成电能的装置
(2)分类
①一次电池又称不可充电电池——如:干电池
②二次电池又称充电电池——蓄电池
③燃料电池
(3)优点
①能量转换效率高,供能稳定可靠。
②可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便。
③易维护,可在各种环境下工作。
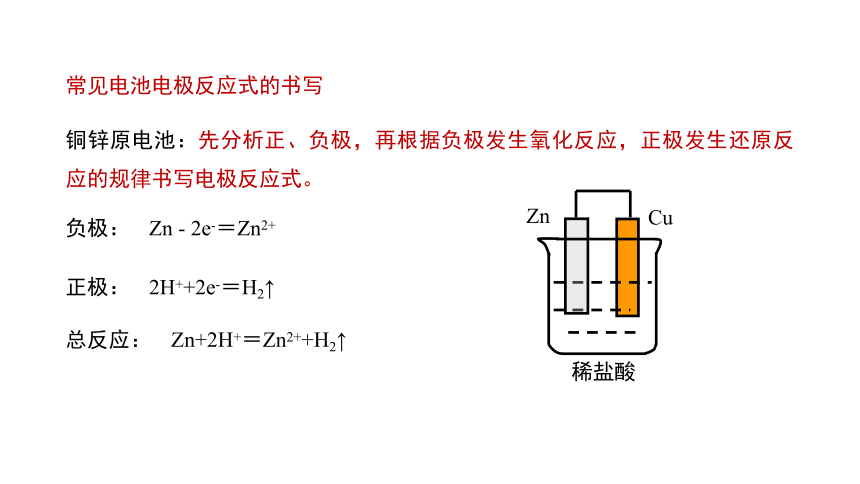
常见电池电极反应式的书写
铜锌原电池:先分析正、负极,再根据负极发生氧化反应,正极发生还原反应的规律书写电极反应式。
2H++2e-=H2↑
负极:
总反应:
正极:
Zn - 2e-=Zn2+
Zn+2H+=Zn2++H2↑
稀盐酸
Zn
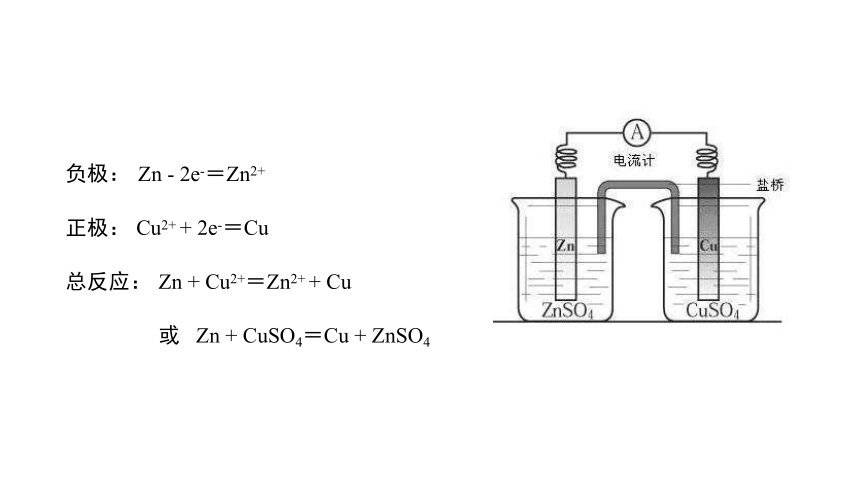
Cu
正极:
负极:
总反应:
Zn - 2e-=Zn2+
Cu2+ + 2e-=Cu
Zn + Cu2+=Zn2+ + Cu
或 Zn + CuSO4=Cu + ZnSO4
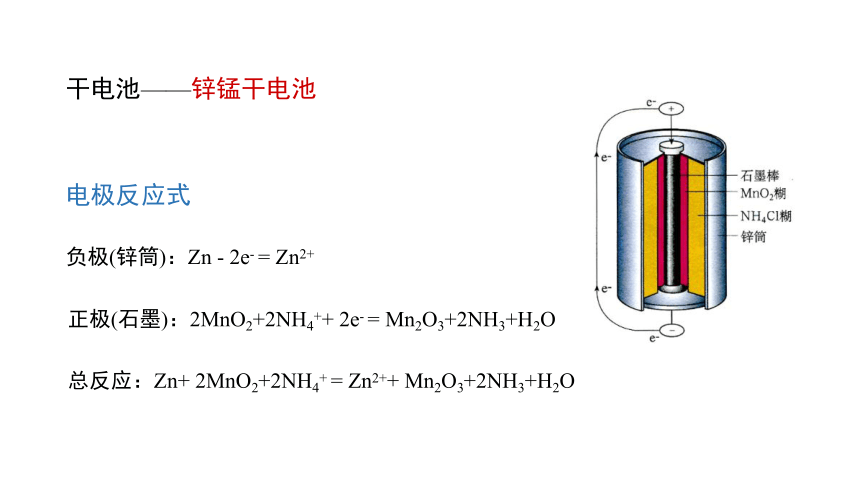
总反应:Zn+ 2MnO2+2NH4+ = Zn2++ Mn2O3+2NH3+H2O
干电池——锌锰干电池
电极反应式
负极(锌筒):Zn - 2e- = Zn2+
正极(石墨):2MnO2+2NH4++ 2e- = Mn2O3+2NH3+H2O
锌锰碱性电池是一种新型的干电池。
正极材料为MnO2 ,极材料为Zn,还原产物为MnOOH,电解质是KOH溶液,请写出电极反应式并分析其工作原理。
负极:Zn + 2OH-- 2e- = Zn(OH)2
正极:2MnO2 + 2H2O + 2 e- = 2MnO(OH) + 2OH-
总反应:Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
碱性Zn-Mn干电池
1.碱性电池具有容量大、放电电流大的特点,因而 得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- = Mn2O3(s)+2OH- (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C
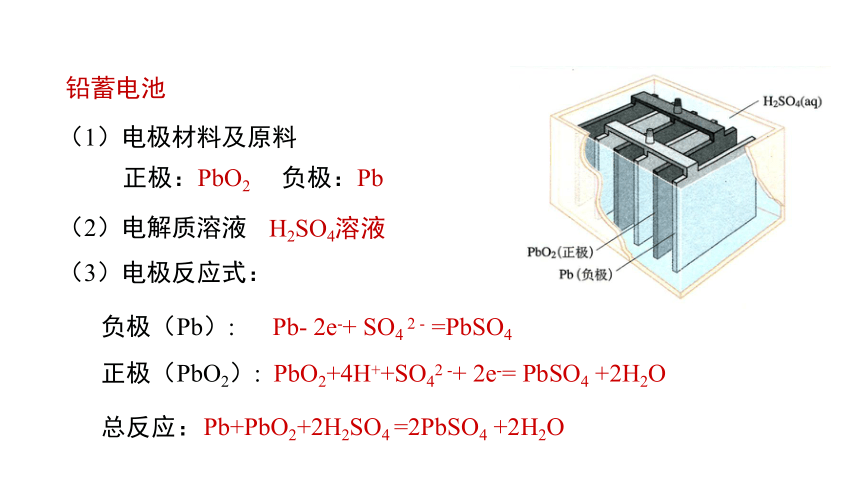
铅蓄电池
(1)电极材料及原料
(2)电解质溶液
(3)电极反应式:
正极:PbO2 负极:Pb
H2SO4溶液
负极(Pb): Pb- 2e-+ SO4 2 - =PbSO4
Pb+PbO2+2H2SO4 =2PbSO4 +2H2O
正极(PbO2): PbO2+4H++SO42 -+ 2e-= PbSO4 +2H2O
总反应:
负极:Pb + SO42- = PbSO4+2e-
正极:PbO2+ SO42-+4H++2e - =PbSO4 + 2H2O
电池总反应:Pb+ PbO2 + 2SO42- +4H+ = 2PbSO4 + 2H2O
阴极: PbSO4 +2e- = Pb+SO42-
阳极: PbSO4+ 2H2O = PbO2+SO42-+4H++2e-
电池总反应:2PbSO4+2H2O= Pb+ PbO2+2SO42- +4H+
铅蓄电池的放电过程——原电池
铅蓄电池的充电过程——电解池
放电
充电
2PbSO4 + 2H2O
PbO2 + Pb + 2H2SO4
铅蓄电池的充放电过程:
2.铅蓄电池的总反应式为:
Pb + PbO2 + 2H2SO4 PbSO4 + 2H2O
对于铅蓄电池放电时的说法错误的是( )
A. 铅为负极,PbO2 为正极
B. 负极的电极反应式为 :Pb - 2e- + SO42- = PbSO4
C. 正极的电极反应式为:PbO2+ 4H+ +SO42- + 2e- = PbSO4 + 2H2O
D.电解液的密度不变
D
放电
充电
把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”
优点:效率高、无污染,装置可持续使用
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
新型燃料电池
怎样书写燃料电池的电极反应式和总反应式?
书写步骤:
(1)写出燃烧反应,根据电解液改写燃料电池总反应;
(2)写出正极的电极反应式(一般较简单);
(3)由燃料电池总反应减去正极的电极反应式得负极的电极反应式。
正极反应一般为
①酸性介质
②碱性介质
O2+4H++4e-=2H2O
O2+2H2O+4e-=4OH-
(1) 氢氧燃料电池
负极H2:2H2 + 4OH- - 4e- = 4H2O
正极O2:O2 + 2H2O +4e- = 4OH-
总反应: O2 + 2H2 = 2H2O
氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。碱性介质
介质
电池反应: 2H2 +O2 = 2H2O
酸性
负极
正极
中性
负极
正极
碱性
负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-
2H2 +4OH-- 4e- = 4H2O
O2 + 2H2O + 4e-= 4OH-
燃料电池
电极反应书写规律:
①找出正负极反应物和产物,写出加减电子个数。
②根据介质配平电荷,并写出电极反应式。
要求:酸性不出现OH-,碱性不出现H+;
中性反应物中不出现OH-、H+,但可以生成。
③写出总方程式(电子守恒)
(2) CH4燃料电池(碱性介质)
1.燃烧总化学反应: CH4+2O2→ CO2+2H2O
2.燃料电池总反应:
3.正极:
4.负极:
CH4+2OH-+2O2 = CO32- +3H2O
2O2+4H2O+8e- = 8OH-
CH4+10OH--8e-= CO32-+7H2O
CH4燃料电池(酸性介质)
1.燃料电池总反应:
2.正极反应:
3.负极反应:①-②×2,得:
CH4+2O2=CO2+2H2O ①
O2+4H++4e-=2H2O ②
CH4-8e-+2H2O=CO2+8H+
(3)甲醇燃料电池(酸性介质)
总反应:
正极的电极反应式为:
负极的电极反应式为:
2CH4O + 3O2 = 2CO2 + 4H2O
3O2+12e-+12H+ = 6H2O
2CH4O-12e-+2H2O = 12H++ 2CO2
甲醇燃料电池(碱性介质)
总反应式:
正极的电极反应式为:
负极的电极反应式为:
2CH4O + 3O2 +4KOH = 2K2CO3 + 6H2O
3O2+12e- + 6H2O =12OH-
2CH4O -12e-+16OH- = 2CO32- +12H2O
铝-空气燃料电池:
电极反应:
(-)Al :4Al – 12e- = 4Al3+
(+) 空气(C):3O2 + 6H2O +12e- = 12OH-
用作海洋航标灯,用海水作为电解质溶液。
4Al + 3O2 + 6H2O = 4Al(OH)3
原电池电极反应式的书写注意事项:
(1)原氧负。
(2)要注意溶液的酸碱性,适当的在电极方程式两边添加H+、OH-、H2O,以遵循电荷守恒和质量守恒。
特殊情况:非水溶液
(3)注意电极反应产物是否与电解质溶液发生反应。
【小结】
3.阿波罗宇宙飞船上使用的是氢氧燃料电池,
其电池反应式为:2H2+O2 =2H2O,是解液是KOH溶液,反应保持在较高温度下使水蒸发,下列叙述正确的是( )
A.工作时,电解质溶液的pH不断增大
B.工作时,能见到浅蓝色火焰
C.工作时,H2为正极,O2为负极
D.电极反应式为:
负极:2H2 + 4OH- - 4e- = 4H2O
正极:O2 +2H2O + 4e- = 4OH-
D
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
锂电池
Li (负极)
MnO2 (正极)
锂盐作电解质 (非水溶液介质)
【组成】
电极反应:(-):Li – e- = Li+
(+): MnO2 + e- = MnO2-
特点: 高能电池、质轻、电压高 、工作效率高和储存寿命长。
用途:电脑、照相机、手表、心脏起搏器、火箭等。
银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和Zn 电解质溶液为KOH溶液,电极反应式为:
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为:
Zn + Ag2O + H2O ====2Ag + Zn(OH)2
4.银-锌电池——钮扣电池
3.银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和Zn电解质溶液为 KOH溶液,电极反应式为:
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为:Zn + Ag2O + H2O = 2Ag + Zn(OH)2
下列说法正确的是( )
A.电流由Zn 经外电路流向Ag2O
B.Zn是负极,该电极发生的电极反应是还原反应
C.Ag2O是正极,该电极发生的电极反应是还原反应
D. 工作时,负极区溶液的 pH不断减小,正极区溶液的pH不断增大
CD
化学电池
(1)概念:
将化学能变成电能的装置
(2)分类
①一次电池又称不可充电电池——如:干电池
②二次电池又称充电电池——蓄电池
③燃料电池
(3)优点
①能量转换效率高,供能稳定可靠。
②可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便。
③易维护,可在各种环境下工作。
常见电池电极反应式的书写
铜锌原电池:先分析正、负极,再根据负极发生氧化反应,正极发生还原反应的规律书写电极反应式。
2H++2e-=H2↑
负极:
总反应:
正极:
Zn - 2e-=Zn2+
Zn+2H+=Zn2++H2↑
稀盐酸
Zn
Cu
正极:
负极:
总反应:
Zn - 2e-=Zn2+
Cu2+ + 2e-=Cu
Zn + Cu2+=Zn2+ + Cu
或 Zn + CuSO4=Cu + ZnSO4
总反应:Zn+ 2MnO2+2NH4+ = Zn2++ Mn2O3+2NH3+H2O
干电池——锌锰干电池
电极反应式
负极(锌筒):Zn - 2e- = Zn2+
正极(石墨):2MnO2+2NH4++ 2e- = Mn2O3+2NH3+H2O
锌锰碱性电池是一种新型的干电池。
正极材料为MnO2 ,极材料为Zn,还原产物为MnOOH,电解质是KOH溶液,请写出电极反应式并分析其工作原理。
负极:Zn + 2OH-- 2e- = Zn(OH)2
正极:2MnO2 + 2H2O + 2 e- = 2MnO(OH) + 2OH-
总反应:Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
碱性Zn-Mn干电池
1.碱性电池具有容量大、放电电流大的特点,因而 得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- = Mn2O3(s)+2OH- (aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C
铅蓄电池
(1)电极材料及原料
(2)电解质溶液
(3)电极反应式:
正极:PbO2 负极:Pb
H2SO4溶液
负极(Pb): Pb- 2e-+ SO4 2 - =PbSO4
Pb+PbO2+2H2SO4 =2PbSO4 +2H2O
正极(PbO2): PbO2+4H++SO42 -+ 2e-= PbSO4 +2H2O
总反应:
负极:Pb + SO42- = PbSO4+2e-
正极:PbO2+ SO42-+4H++2e - =PbSO4 + 2H2O
电池总反应:Pb+ PbO2 + 2SO42- +4H+ = 2PbSO4 + 2H2O
阴极: PbSO4 +2e- = Pb+SO42-
阳极: PbSO4+ 2H2O = PbO2+SO42-+4H++2e-
电池总反应:2PbSO4+2H2O= Pb+ PbO2+2SO42- +4H+
铅蓄电池的放电过程——原电池
铅蓄电池的充电过程——电解池
放电
充电
2PbSO4 + 2H2O
PbO2 + Pb + 2H2SO4
铅蓄电池的充放电过程:
2.铅蓄电池的总反应式为:
Pb + PbO2 + 2H2SO4 PbSO4 + 2H2O
对于铅蓄电池放电时的说法错误的是( )
A. 铅为负极,PbO2 为正极
B. 负极的电极反应式为 :Pb - 2e- + SO42- = PbSO4
C. 正极的电极反应式为:PbO2+ 4H+ +SO42- + 2e- = PbSO4 + 2H2O
D.电解液的密度不变
D
放电
充电
把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”
优点:效率高、无污染,装置可持续使用
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
新型燃料电池
怎样书写燃料电池的电极反应式和总反应式?
书写步骤:
(1)写出燃烧反应,根据电解液改写燃料电池总反应;
(2)写出正极的电极反应式(一般较简单);
(3)由燃料电池总反应减去正极的电极反应式得负极的电极反应式。
正极反应一般为
①酸性介质
②碱性介质
O2+4H++4e-=2H2O
O2+2H2O+4e-=4OH-
(1) 氢氧燃料电池
负极H2:2H2 + 4OH- - 4e- = 4H2O
正极O2:O2 + 2H2O +4e- = 4OH-
总反应: O2 + 2H2 = 2H2O
氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。碱性介质
介质
电池反应: 2H2 +O2 = 2H2O
酸性
负极
正极
中性
负极
正极
碱性
负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e-= 2H2O
2H2 - 4e- = 4H+
O2 + 2H2O + 4e-= 4OH-
2H2 +4OH-- 4e- = 4H2O
O2 + 2H2O + 4e-= 4OH-
燃料电池
电极反应书写规律:
①找出正负极反应物和产物,写出加减电子个数。
②根据介质配平电荷,并写出电极反应式。
要求:酸性不出现OH-,碱性不出现H+;
中性反应物中不出现OH-、H+,但可以生成。
③写出总方程式(电子守恒)
(2) CH4燃料电池(碱性介质)
1.燃烧总化学反应: CH4+2O2→ CO2+2H2O
2.燃料电池总反应:
3.正极:
4.负极:
CH4+2OH-+2O2 = CO32- +3H2O
2O2+4H2O+8e- = 8OH-
CH4+10OH--8e-= CO32-+7H2O
CH4燃料电池(酸性介质)
1.燃料电池总反应:
2.正极反应:
3.负极反应:①-②×2,得:
CH4+2O2=CO2+2H2O ①
O2+4H++4e-=2H2O ②
CH4-8e-+2H2O=CO2+8H+
(3)甲醇燃料电池(酸性介质)
总反应:
正极的电极反应式为:
负极的电极反应式为:
2CH4O + 3O2 = 2CO2 + 4H2O
3O2+12e-+12H+ = 6H2O
2CH4O-12e-+2H2O = 12H++ 2CO2
甲醇燃料电池(碱性介质)
总反应式:
正极的电极反应式为:
负极的电极反应式为:
2CH4O + 3O2 +4KOH = 2K2CO3 + 6H2O
3O2+12e- + 6H2O =12OH-
2CH4O -12e-+16OH- = 2CO32- +12H2O
铝-空气燃料电池:
电极反应:
(-)Al :4Al – 12e- = 4Al3+
(+) 空气(C):3O2 + 6H2O +12e- = 12OH-
用作海洋航标灯,用海水作为电解质溶液。
4Al + 3O2 + 6H2O = 4Al(OH)3
原电池电极反应式的书写注意事项:
(1)原氧负。
(2)要注意溶液的酸碱性,适当的在电极方程式两边添加H+、OH-、H2O,以遵循电荷守恒和质量守恒。
特殊情况:非水溶液
(3)注意电极反应产物是否与电解质溶液发生反应。
【小结】
3.阿波罗宇宙飞船上使用的是氢氧燃料电池,
其电池反应式为:2H2+O2 =2H2O,是解液是KOH溶液,反应保持在较高温度下使水蒸发,下列叙述正确的是( )
A.工作时,电解质溶液的pH不断增大
B.工作时,能见到浅蓝色火焰
C.工作时,H2为正极,O2为负极
D.电极反应式为:
负极:2H2 + 4OH- - 4e- = 4H2O
正极:O2 +2H2O + 4e- = 4OH-
D
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
锂电池
Li (负极)
MnO2 (正极)
锂盐作电解质 (非水溶液介质)
【组成】
电极反应:(-):Li – e- = Li+
(+): MnO2 + e- = MnO2-
特点: 高能电池、质轻、电压高 、工作效率高和储存寿命长。
用途:电脑、照相机、手表、心脏起搏器、火箭等。
银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和Zn 电解质溶液为KOH溶液,电极反应式为:
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为:
Zn + Ag2O + H2O ====2Ag + Zn(OH)2
4.银-锌电池——钮扣电池
3.银锌电池是一种纽扣式大容量电池,电极分别是Ag2O和Zn电解质溶液为 KOH溶液,电极反应式为:
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O + H2O +2e- = 2Ag + 2OH-
总反应为:Zn + Ag2O + H2O = 2Ag + Zn(OH)2
下列说法正确的是( )
A.电流由Zn 经外电路流向Ag2O
B.Zn是负极,该电极发生的电极反应是还原反应
C.Ag2O是正极,该电极发生的电极反应是还原反应
D. 工作时,负极区溶液的 pH不断减小,正极区溶液的pH不断增大
CD
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
