第一节 化学实验基本方法
文档属性
| 名称 | 第一节 化学实验基本方法 |

|
|
| 格式 | rar | ||
| 文件大小 | 465.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-09-18 00:00:00 | ||
图片预览






文档简介
(共17张PPT)
第一章
从实验学化学
二、混合物的分离和提纯
2、蒸馏和萃取:
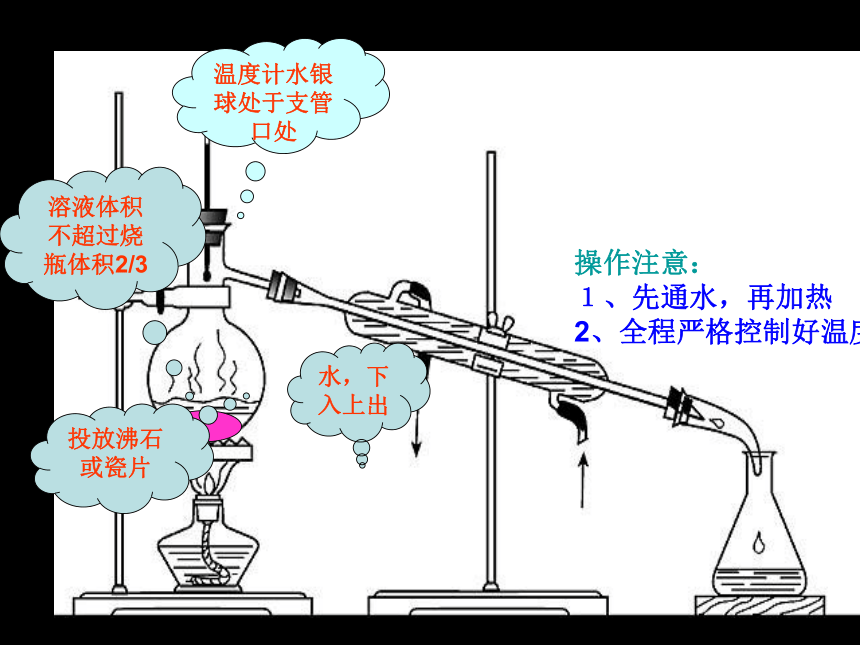
(1) 蒸馏:利用混合物中各组成成分的沸点不同,用加热的方法将其分离的过程。
对象:沸点不同液态混合物;
目的:分离(或除去)难挥发(或不挥发)的杂质。
如:利用自来水制备蒸馏水
蒸馏烧瓶
冷凝管
温度计
尾接管
冷水
热水
使用前要检查装置的气密性!
投放沸石或瓷片
温度计水银球处于支管口处
水,下入上出
操作注意:
1、先通水,再加热
2、全程严格控制好温度
溶液体积不超过烧瓶体积2/3
实验 现象
1、在试管中加入少量自来水,滴入几滴AgNO3(硝酸银)溶液和几滴稀硝酸。
2、在烧瓶中加入约1/3体积的自来水,再加入几粒沸石,按图1-4连接好装置,向冷凝管中通入冷却水。加热烧瓶,弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
3、取少量蒸馏出的液体加入试管中,然后加入几滴AgNO3溶液和几滴稀硝酸。(得到的液体中含有Cl-吗?)
加AgNO3后有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,证明样品含有Cl-
烧瓶中的水变成水蒸气,
水蒸气经过冷凝管后变成液态水,流到锥形瓶里。
加AgNO3和稀硝酸,没有白色沉淀生成,说明经蒸馏冷凝后得到的液体没有Cl-
(2) 分液
2、分离互不相溶、密度不同的混合物的方法
一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水
密度比水小
上层
(密度比水大,下层)
1、仪器
——分液漏斗
分液注意事项:
(1)分液漏斗在使用前须检验是否漏水。
(2)把盛有待分液体的分液漏斗放在铁架台的铁圈上,使漏斗颈末端紧贴在烧杯内壁,静置片刻。
( 3 )下层液体从漏斗颈流出,上层液体须从漏斗上口倾倒出。
(3) 萃取:
原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
A和C组成溶液,加一种溶剂B,A易溶于B,A难溶于C,所以B可以把A在A和C组成的溶液中萃取出来.
▲萃取剂的选择条件:
1、萃取剂与原溶剂不混溶、不反应
2、溶质在萃取剂中有较大的溶解度
3、溶质不与萃取剂发生任何反应
萃取实验步骤:装液---振荡---静置---分液
主要仪器:分液漏斗
P9
P9 实验1-4
注意事项:
(1)振荡时,须不断放气,以减少分液漏斗内的气压。
(2)萃取原则:少量多次。
(3)选择萃取剂的要求:与原溶剂不相溶;溶质在其中的溶解度要比在原溶剂中大;溶质、原溶剂、萃取剂之间均不反应。
练习:
1.选择萃取剂将碘水中的碘萃取出来,这种萃取剂具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应.
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
B
2.阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大
都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈
紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分液漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水
D
2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中,
(1)能把碘单质从碘水中萃取出来的是( )
苯,CCl4
3、CCl4能把碘酒中的碘萃取出来么?
不能,酒精与CCl4混溶
(4).升华法:分离易升华的物质。
碘、萘的提纯
要提取食盐中的单质碘,你设计的最佳方法是什么?
【问题】
小结:
混合物的分离和提纯
蒸馏
分液
萃取
升华
课堂练习:
1.在实验里进行分液操作,下列仪器中用不着的是
A.锥形瓶 B.分液漏斗 C.玻璃棒 D.温度计
D
2.已知丙酮通常是无色液体,不溶于水,密度小于1g/mL,沸点约为55℃.要从水与丙酮的混合物里将丙酮分离出来,下列方法最合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
B
3.检验某未知溶液是否含有SO42-,下列操作最合理的是( )
A. 先加稀硝酸酸化,再加Ba(NO3)2溶液.
B. 加BaCl2溶液即可.
C. 先加稀盐酸酸化,再加BaCl2溶液.
D. 加Ba(NO3)2溶液即可
C
第一章
从实验学化学
二、混合物的分离和提纯
2、蒸馏和萃取:
(1) 蒸馏:利用混合物中各组成成分的沸点不同,用加热的方法将其分离的过程。
对象:沸点不同液态混合物;
目的:分离(或除去)难挥发(或不挥发)的杂质。
如:利用自来水制备蒸馏水
蒸馏烧瓶
冷凝管
温度计
尾接管
冷水
热水
使用前要检查装置的气密性!
投放沸石或瓷片
温度计水银球处于支管口处
水,下入上出
操作注意:
1、先通水,再加热
2、全程严格控制好温度
溶液体积不超过烧瓶体积2/3
实验 现象
1、在试管中加入少量自来水,滴入几滴AgNO3(硝酸银)溶液和几滴稀硝酸。
2、在烧瓶中加入约1/3体积的自来水,再加入几粒沸石,按图1-4连接好装置,向冷凝管中通入冷却水。加热烧瓶,弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
3、取少量蒸馏出的液体加入试管中,然后加入几滴AgNO3溶液和几滴稀硝酸。(得到的液体中含有Cl-吗?)
加AgNO3后有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,证明样品含有Cl-
烧瓶中的水变成水蒸气,
水蒸气经过冷凝管后变成液态水,流到锥形瓶里。
加AgNO3和稀硝酸,没有白色沉淀生成,说明经蒸馏冷凝后得到的液体没有Cl-
(2) 分液
2、分离互不相溶、密度不同的混合物的方法
一部分有机物溶剂 Vs 无机溶剂
汽油
煤油 水
植物油
苯
四氯化碳 水
密度比水小
上层
(密度比水大,下层)
1、仪器
——分液漏斗
分液注意事项:
(1)分液漏斗在使用前须检验是否漏水。
(2)把盛有待分液体的分液漏斗放在铁架台的铁圈上,使漏斗颈末端紧贴在烧杯内壁,静置片刻。
( 3 )下层液体从漏斗颈流出,上层液体须从漏斗上口倾倒出。
(3) 萃取:
原理:利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
A和C组成溶液,加一种溶剂B,A易溶于B,A难溶于C,所以B可以把A在A和C组成的溶液中萃取出来.
▲萃取剂的选择条件:
1、萃取剂与原溶剂不混溶、不反应
2、溶质在萃取剂中有较大的溶解度
3、溶质不与萃取剂发生任何反应
萃取实验步骤:装液---振荡---静置---分液
主要仪器:分液漏斗
P9
P9 实验1-4
注意事项:
(1)振荡时,须不断放气,以减少分液漏斗内的气压。
(2)萃取原则:少量多次。
(3)选择萃取剂的要求:与原溶剂不相溶;溶质在其中的溶解度要比在原溶剂中大;溶质、原溶剂、萃取剂之间均不反应。
练习:
1.选择萃取剂将碘水中的碘萃取出来,这种萃取剂具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应.
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
B
2.阅读下列材料,按要求回答问题:
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大
都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈
紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
1、下列能用分液漏斗分离的是( )
A、液溴和CCl4 B、酒精和煤油
C、CaCl2和Na2SO4溶液 D、苯和蒸馏水
D
2、在酒精、苯、CCl4、NaCl溶液、蒸馏水五种试剂中,
(1)能把碘单质从碘水中萃取出来的是( )
苯,CCl4
3、CCl4能把碘酒中的碘萃取出来么?
不能,酒精与CCl4混溶
(4).升华法:分离易升华的物质。
碘、萘的提纯
要提取食盐中的单质碘,你设计的最佳方法是什么?
【问题】
小结:
混合物的分离和提纯
蒸馏
分液
萃取
升华
课堂练习:
1.在实验里进行分液操作,下列仪器中用不着的是
A.锥形瓶 B.分液漏斗 C.玻璃棒 D.温度计
D
2.已知丙酮通常是无色液体,不溶于水,密度小于1g/mL,沸点约为55℃.要从水与丙酮的混合物里将丙酮分离出来,下列方法最合理的是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
B
3.检验某未知溶液是否含有SO42-,下列操作最合理的是( )
A. 先加稀硝酸酸化,再加Ba(NO3)2溶液.
B. 加BaCl2溶液即可.
C. 先加稀盐酸酸化,再加BaCl2溶液.
D. 加Ba(NO3)2溶液即可
C
