物质的聚集状态
图片预览





文档简介
(共20张PPT)
物质的聚集状态
学案4
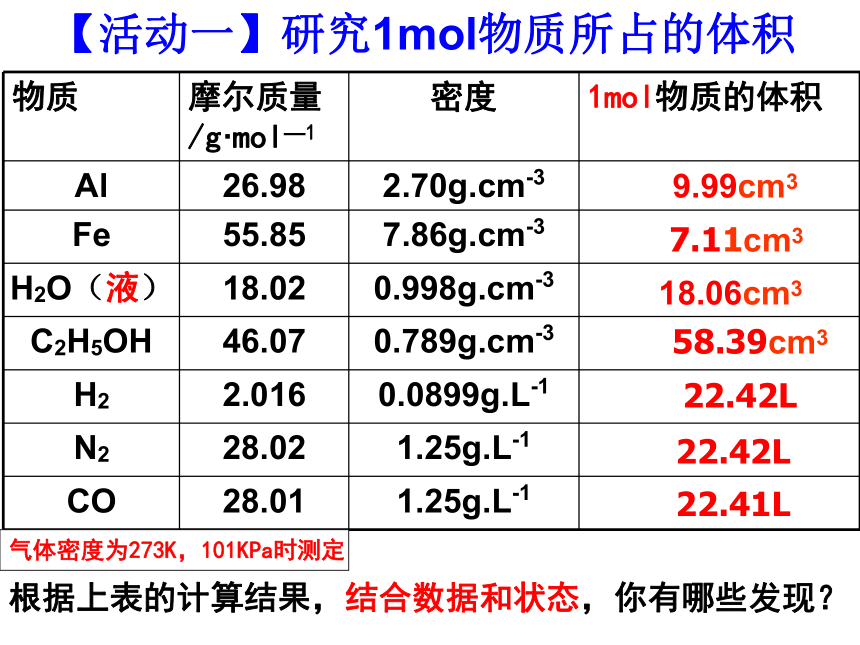
物质 摩尔质量/g·mol—1 密度 1mol物质的体积
Al 26.98 2.70g.cm-3
Fe 55.85 7.86g.cm-3
H2O(液) 18.02 0.998g.cm-3
C2H5OH 46.07 0.789g.cm-3
H2 2.016 0.0899g.L-1
N2 28.02 1.25g.L-1
CO 28.01 1.25g.L-1
7.11cm3
18.06cm3
58.39cm3
22.42L
22.42L
22.41L
9.99cm3
【活动一】研究1mol物质所占的体积
根据上表的计算结果,结合数据和状态,你有哪些发现?
气体密度为273K,101KPa时测定
小组交流计算结果
2、相同条件下,1mol的固体、液体体积一般是不同的。
1、相同条件下,1mol的气体体积要比固体、液体大得多。
3、相同条件下,1mol的不同气体体积几乎相同。
小组交流讨论
1、对于1mol不同的固体或液体物质,
为什么它们的体积各不相同?
2、而相同条件(标准状况)下,为什么
1mol不同气体的体积基本相同呢?
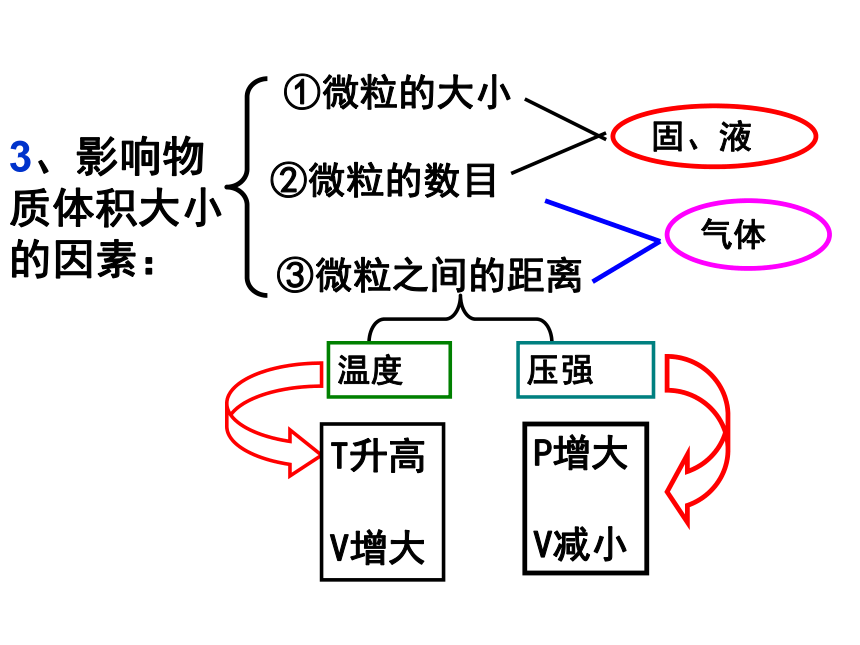
3、影响物质体积的因素有哪些?
1、对于固、液体物质,微粒间距很小,在粒子数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。1mol固体、液体的体积主要决定于组成它们的微粒大小。
2、对于气体,微粒之间的距离要比微粒本身的直径大很多倍,在粒子数目相同的情况下,气体的体积主要有粒子之间的距离决定。而不同的气体在一定温度和压强下,分子间的距离近似相等。相同条件下,1mol气体的体积主要决定于分子间的距离。
【小结】
3、影响物质体积大小的因素:
②微粒的数目
①微粒的大小
③微粒之间的距离
固、液
气体
温度
压强
T升高
V增大
P增大
V减小
课堂练习一
在给定一定物质的量的气体,影响其所占体积大小的主要因素是( )
A、分子直径的大小
B、分子间距离的大小
C、分子间引力的大小
D、分子数目的多少
B
课堂核心:气体摩尔体积
V
n
Vm = ——
1.定义:
2.符号:
3.单位:
4.公式:
单位物质的量的气体所占的体积。
Vm
L/mol 或 m3/mol等
回顾“摩尔质量”的概念,体会“气体摩尔体积”的概念
问题1、气体摩尔体积是固定不变的一个数值吗?
如果不是,它受什么影响?
问题2、气体摩尔体积与分子种类有关吗?
问题3、气体摩尔体积与22.4L/mol的关系?
问题4、使用V=nVm时应注意什么?
【活动二】 气体摩尔体积
在标准状况(273K、101KPa)下,1mol任何气体所占的体积都约为22.4L。
大量的科学研究表明:
在标准状况下,气体摩尔体积约为22.4L·mol—1。
理解的几点注意:
1、状况:
2、定量:
3、状态:
4、数值:
5、有关计算:
任何气体(纯净或混合气体)
1mol
标准状况才约为22 .4L
标准状况(0 ℃、101KPa)
(标准状况下)
V = n × 22.4L/mol
1、标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2、1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3、标准状况下,1molO2和N2混合气体的体积
约为22.4L。
(对,气体体积与分子种类无关)
课堂练习二
判断下列说法是否正确
4、22.4L气体所含分子数一定大于11.2L气体所含
的分子数。
5、标准状况下,气体的摩尔体积都是22.4L。
6、只有在标准状况下,气体的摩尔体积才可能
约为22.4L/mol。
(错,未指明气体体积是否在相同条件下测定)
(错,“约为”;单位应为L/mol)
(错,不一定)
课堂练习二
m
n
N
÷M
×M
×NA
÷NA
v
?
× Vm
÷Vm
1、标准状况下,11.2L的CO2的物质的量为 。
2、标准状况下,1molH2和O2混合气体的体积
约为 。
3、在标准状况下,4.48L的NH3的物质的量为 ,
质量为_ _,约含有 个NH3。
4、标准状况下,16gO2的体积是 。
5、含1.806X1023个分子的N2,在标准状况下的体积
是 。
0.5mol
22.4L
课堂练习三
11.2L
6.72L
0.2mol
3.4g
1.204 X 1023
书本P12例3
练习:32.5克的锌与足量的稀硫酸完全反应,最多可收集到多少体积(标准状况下)的氢气?
上下单位要一致,
左右关系要对应
有关化学方程式的计算
二、气体摩尔体积
一、影响物质体积的因素
m
n
N
÷M
×M
×NA
÷NA
× Vm
÷ Vm
(标准状况)
v
课后作业
完成练习四
物质的聚集状态
学案4
物质 摩尔质量/g·mol—1 密度 1mol物质的体积
Al 26.98 2.70g.cm-3
Fe 55.85 7.86g.cm-3
H2O(液) 18.02 0.998g.cm-3
C2H5OH 46.07 0.789g.cm-3
H2 2.016 0.0899g.L-1
N2 28.02 1.25g.L-1
CO 28.01 1.25g.L-1
7.11cm3
18.06cm3
58.39cm3
22.42L
22.42L
22.41L
9.99cm3
【活动一】研究1mol物质所占的体积
根据上表的计算结果,结合数据和状态,你有哪些发现?
气体密度为273K,101KPa时测定
小组交流计算结果
2、相同条件下,1mol的固体、液体体积一般是不同的。
1、相同条件下,1mol的气体体积要比固体、液体大得多。
3、相同条件下,1mol的不同气体体积几乎相同。
小组交流讨论
1、对于1mol不同的固体或液体物质,
为什么它们的体积各不相同?
2、而相同条件(标准状况)下,为什么
1mol不同气体的体积基本相同呢?
3、影响物质体积的因素有哪些?
1、对于固、液体物质,微粒间距很小,在粒子数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。1mol固体、液体的体积主要决定于组成它们的微粒大小。
2、对于气体,微粒之间的距离要比微粒本身的直径大很多倍,在粒子数目相同的情况下,气体的体积主要有粒子之间的距离决定。而不同的气体在一定温度和压强下,分子间的距离近似相等。相同条件下,1mol气体的体积主要决定于分子间的距离。
【小结】
3、影响物质体积大小的因素:
②微粒的数目
①微粒的大小
③微粒之间的距离
固、液
气体
温度
压强
T升高
V增大
P增大
V减小
课堂练习一
在给定一定物质的量的气体,影响其所占体积大小的主要因素是( )
A、分子直径的大小
B、分子间距离的大小
C、分子间引力的大小
D、分子数目的多少
B
课堂核心:气体摩尔体积
V
n
Vm = ——
1.定义:
2.符号:
3.单位:
4.公式:
单位物质的量的气体所占的体积。
Vm
L/mol 或 m3/mol等
回顾“摩尔质量”的概念,体会“气体摩尔体积”的概念
问题1、气体摩尔体积是固定不变的一个数值吗?
如果不是,它受什么影响?
问题2、气体摩尔体积与分子种类有关吗?
问题3、气体摩尔体积与22.4L/mol的关系?
问题4、使用V=nVm时应注意什么?
【活动二】 气体摩尔体积
在标准状况(273K、101KPa)下,1mol任何气体所占的体积都约为22.4L。
大量的科学研究表明:
在标准状况下,气体摩尔体积约为22.4L·mol—1。
理解的几点注意:
1、状况:
2、定量:
3、状态:
4、数值:
5、有关计算:
任何气体(纯净或混合气体)
1mol
标准状况才约为22 .4L
标准状况(0 ℃、101KPa)
(标准状况下)
V = n × 22.4L/mol
1、标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2、1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3、标准状况下,1molO2和N2混合气体的体积
约为22.4L。
(对,气体体积与分子种类无关)
课堂练习二
判断下列说法是否正确
4、22.4L气体所含分子数一定大于11.2L气体所含
的分子数。
5、标准状况下,气体的摩尔体积都是22.4L。
6、只有在标准状况下,气体的摩尔体积才可能
约为22.4L/mol。
(错,未指明气体体积是否在相同条件下测定)
(错,“约为”;单位应为L/mol)
(错,不一定)
课堂练习二
m
n
N
÷M
×M
×NA
÷NA
v
?
× Vm
÷Vm
1、标准状况下,11.2L的CO2的物质的量为 。
2、标准状况下,1molH2和O2混合气体的体积
约为 。
3、在标准状况下,4.48L的NH3的物质的量为 ,
质量为_ _,约含有 个NH3。
4、标准状况下,16gO2的体积是 。
5、含1.806X1023个分子的N2,在标准状况下的体积
是 。
0.5mol
22.4L
课堂练习三
11.2L
6.72L
0.2mol
3.4g
1.204 X 1023
书本P12例3
练习:32.5克的锌与足量的稀硫酸完全反应,最多可收集到多少体积(标准状况下)的氢气?
上下单位要一致,
左右关系要对应
有关化学方程式的计算
二、气体摩尔体积
一、影响物质体积的因素
m
n
N
÷M
×M
×NA
÷NA
× Vm
÷ Vm
(标准状况)
v
课后作业
完成练习四
