北京课标版化学上册第3章第一节 原子(19张PPT)
文档属性
| 名称 | 北京课标版化学上册第3章第一节 原子(19张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 583.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-30 09:23:55 | ||
图片预览


文档简介
(共20张PPT)
原子
学习目标
1、了解原子的结构,了解构成原子的各种粒子的分布及电性;
2、了解原子很小,原子核更小;
3、了解原子的质量和相对原子质量的概念,并学会从元素周期表中查找相对原子质量。
4、根据给出的信息,学习分析、处理和归纳信息的方法。
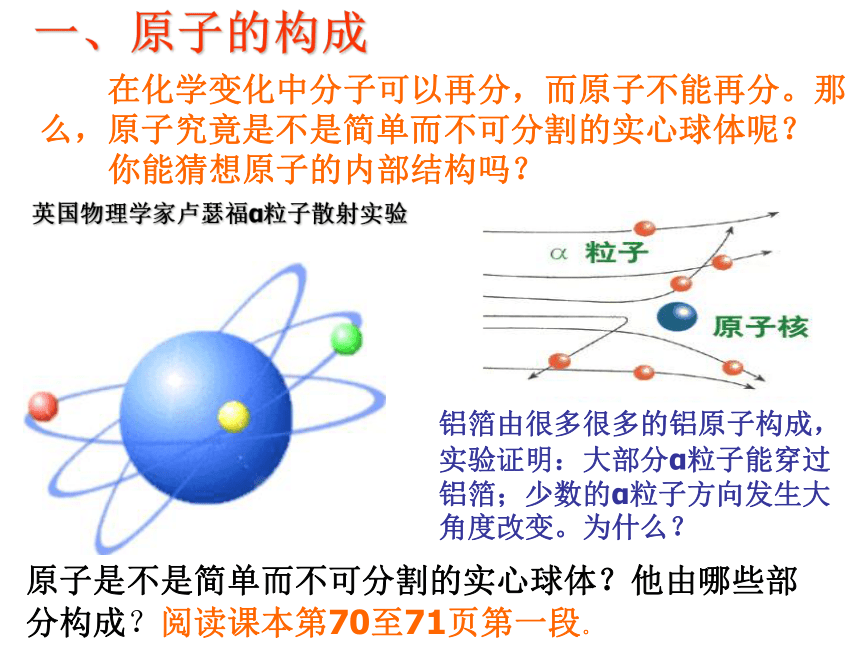
英国物理学家卢瑟福α粒子散射实验
铝箔由很多很多的铝原子构成,实验证明:大部分α粒子能穿过铝箔;少数的α粒子方向发生大角度改变。为什么?
原子是不是简单而不可分割的实心球体?他由哪些部分构成?阅读课本第70至71页第一段。
一、原子的构成
在化学变化中分子可以再分,而原子不能再分。那么,原子究竟是不是简单而不可分割的实心球体呢?
你能猜想原子的内部结构吗?
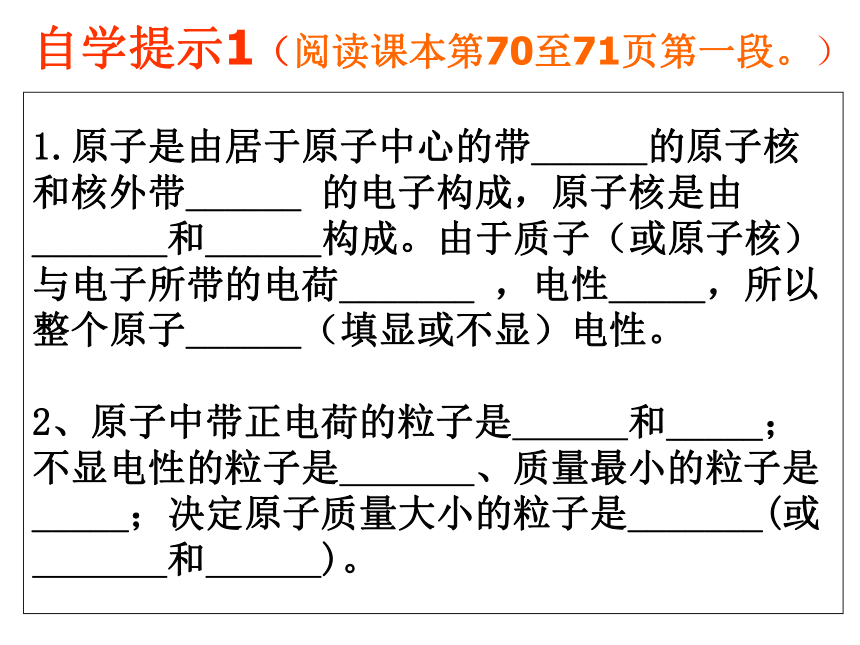
1.原子是由居于原子中心的带______的原子核和核外带______
的电子构成,原子核是由_______和______构成。由于质子(或原子核)与电子所带的电荷_______
,电性_____,所以整个原子______(填显或不显)电性。
2、原子中带正电荷的粒子是
和_____;不显电性的粒子是
、质量最小的粒子是_____;决定原子质量大小的粒子是_______(或
和
)。
自学提示1(阅读课本第70至71页第一段。)
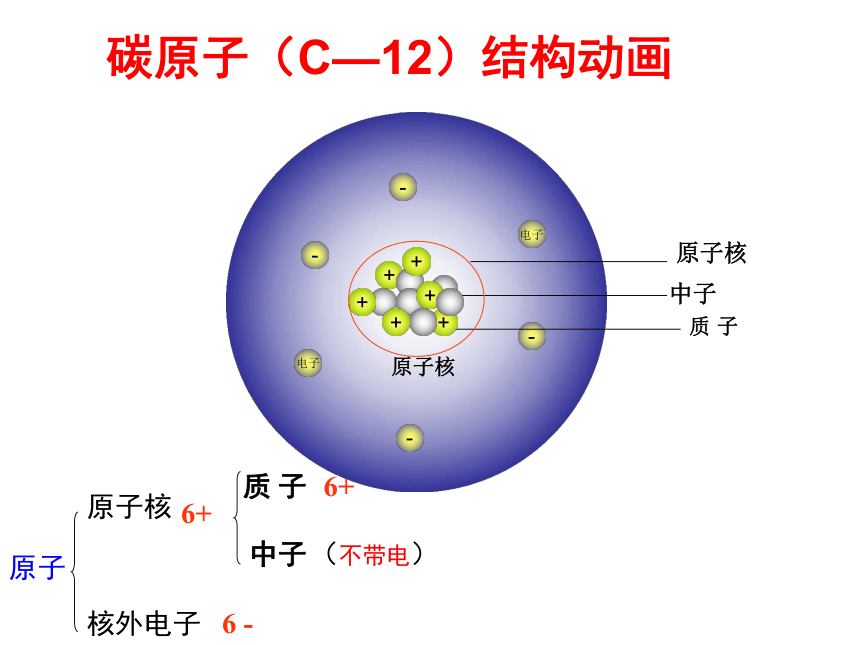
碳原子(C—12)结构动画
+
-
电子
-
-
-
电子
中子
质
子
原子核
原子
原子核
核外电子
中子
质
子
(不带电)
6+
6+
6
-
+
+
+
+
+
原子核
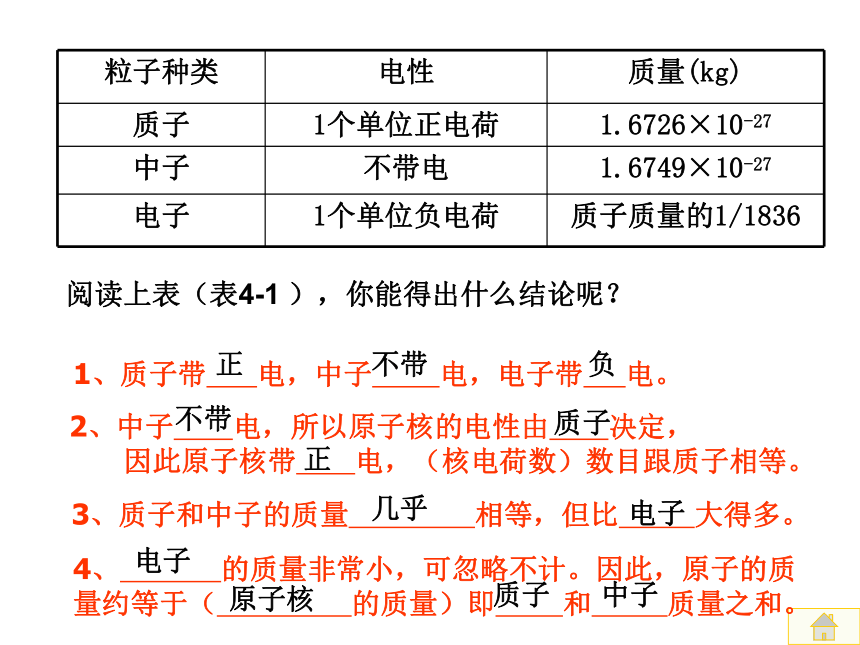
粒子种类
电性
质量(kg)
质子
1个单位正电荷
1.6726×10-27
中子
不带电
1.6749×10-27
电子
1个单位负电荷
质子质量的1/1836
阅读上表(表4-1
),你能得出什么结论呢?
1、质子带
电,中子
电,电子带
电。
3、质子和中子的质量
相等,但比
大得多。
2、中子
电,所以原子核的电性由
决定,
因此原子核带
电,(核电荷数)数目跟质子相等。
正
不带
负
不带
质子
正
几乎
4、
的质量非常小,可忽略不计。因此,原子的质量约等于(
的质量)即
和
质量之和。
原子核
质子
电子
中子
电子
原子种类
原子序数
质子数
中子数
核外电子数
氢
1
1
0
1
碳
6
6
6
6
氧
8
8
8
8
钠
11
11
12
11
氯
17
17
18
17
铁
26
26
30
26
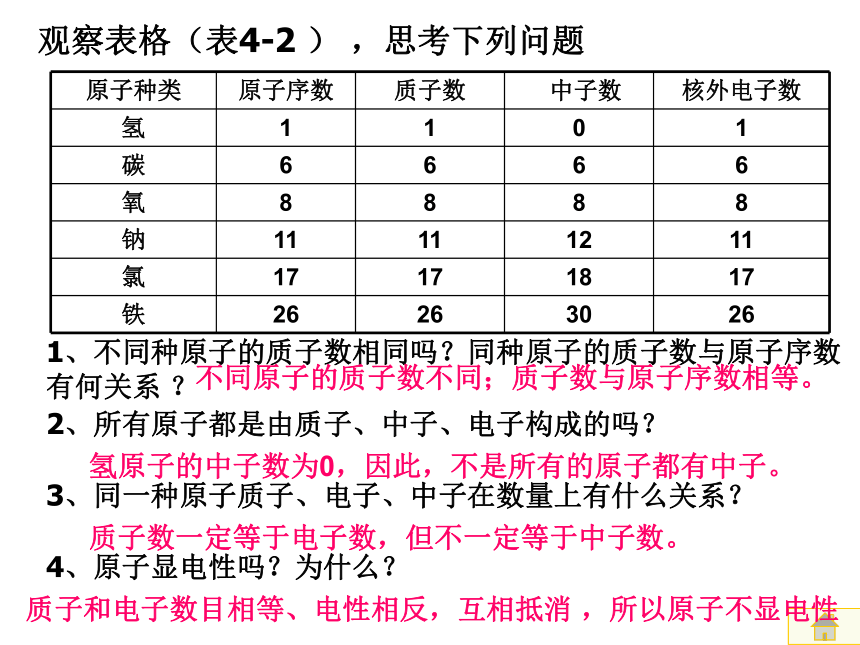
观察表格(表4-2
)
,思考下列问题
2、所有原子都是由质子、中子、电子构成的吗?
3、同一种原子质子、电子、中子在数量上有什么关系?
1、不同种原子的质子数相同吗?同种原子的质子数与原子序数有何关系
?
4、原子显电性吗?为什么?
不同原子的质子数不同;质子数与原子序数相等。
氢原子的中子数为0,因此,不是所有的原子都有中子。
质子数一定等于电子数,但不一定等于中子数。
质子和电子数目相等、电性相反,互相抵消
,所以原子不显电性
练习1
1.原子是由居于原子中心带______的原子核和核外带______
的电子构成,原子核是由_______和______构成。由于它们所带的电荷_______
,电性_____,所以整个原子______(填显或不显)电性。
2、能保持物质的化学性质的最小粒子是_____;化学变化中的最小粒子是______;原子中带正电荷的粒子是_
_和_____
_;不显电性的粒子是
、质量最小的粒子是_____;决定原子质量大小的粒子是________。
3、据报道,1994年12月科学家发现了一种新元素,它的原子核内有质子111个,中子161个,则该元素核外电子数是_____
正电
负电
质子
中子
相等
相反
不显
分子
原子
质子
中子
电子
原子核
111
原子核
你想知道原子和原子核究竟有多大吗?
一、原子的构成(小结)
原
子
电
子
原子核
质子
中子
(带
电)
(带
电)
(带
电)
(
电)
核电荷数
=
数
=
数(核外电子数)=原子
。
(
电性)
质子
电子
序数
不带
正
正
负
不显
原子的体积很小
原子与乒乓球体积比相当于乒乓球与地球的体积之比。
原子核(蚂蚁)
原子(体育场
)
原子核比原子小得多
原子很小,让我们看看一个原子有多重:
一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克
原子的质量很小,记忆、计算都很不方便,怎么办?
二、原子很小,原子核更小
(1)原子质量的单位是
。
“相对原子质量”单位为“
”
。
(2)原子质量是原子的
质量,“相对原子质量”是该种原子的
除以1.66×10-27
kg(碳原子的质量的1/12)所得
的一个比值。
(3)
教授为相对原子质量测定作出了卓越贡献。
什么叫相对原子质量?原子质量与相对原子质量相同吗
?有何区别?
自学提示2:阅读课本第
71页
三、相对原子质量(Ar)
相对原子质量就是以一种碳原子(C-12)质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比。
1.66×10-27
(kg)
Ar=
一种原子(A)的质量(kg)
氢原子的相对原子质量=
≈
1
1.67×10-27kg
1.66×10-27kg
碳原子的相对原子质量=
=12
1.66×10-27kg
1.992×10-26kg
氧原子的相对原子质量=
≈
16
1.66×10-27kg
2.657×10-26kg
(1)原子质量的单位是
。
“相对原子质量”单位为“
”
。
(2)原子质量是原子的
质量,
“相对原子质量”是该种原子的
的质量除以1.66×10-27
kg(碳原子的质量的1/12)所得的一个比值。
(3)
教授为相对原子质量测定作出了卓越贡献。
(4)根据元素周期表查出下列原子的相对原子质量:钾
、钠、镁、硫、氧、氮
千克(Kg)
1
实际
一个原子
小结:
张青莲
相对原子质量的近似值
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
氯
17
18
17
35
铁
26
30
26
56
看数值,找规律
核电荷数=核内质子数=核外电子数
相对原子质量≈质子数+中子数
1、同种原子核电荷数、质
子数与电子数有何关系?
2、同种原子质
子数与中子数与相对原子质量有何关系?
练习2
1、填表:
2、氧原子的相对原子质量为(
)
A、16g
B、16
C、2.657×10-26kg
D、16g
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为
,中子数为
,核外电子数为
。
4、练习(作业):学习指导32-33页
原子种类
核电荷数
质子数
中子数
电子数
相对原子质量
H
1
?
?
?
Mg
12
?
?
24
Fe
?
26
?
56
B
114
175
114
1
0
12
26
30
1
1
12
12
26
多
谢
指
导
原子
学习目标
1、了解原子的结构,了解构成原子的各种粒子的分布及电性;
2、了解原子很小,原子核更小;
3、了解原子的质量和相对原子质量的概念,并学会从元素周期表中查找相对原子质量。
4、根据给出的信息,学习分析、处理和归纳信息的方法。
英国物理学家卢瑟福α粒子散射实验
铝箔由很多很多的铝原子构成,实验证明:大部分α粒子能穿过铝箔;少数的α粒子方向发生大角度改变。为什么?
原子是不是简单而不可分割的实心球体?他由哪些部分构成?阅读课本第70至71页第一段。
一、原子的构成
在化学变化中分子可以再分,而原子不能再分。那么,原子究竟是不是简单而不可分割的实心球体呢?
你能猜想原子的内部结构吗?
1.原子是由居于原子中心的带______的原子核和核外带______
的电子构成,原子核是由_______和______构成。由于质子(或原子核)与电子所带的电荷_______
,电性_____,所以整个原子______(填显或不显)电性。
2、原子中带正电荷的粒子是
和_____;不显电性的粒子是
、质量最小的粒子是_____;决定原子质量大小的粒子是_______(或
和
)。
自学提示1(阅读课本第70至71页第一段。)
碳原子(C—12)结构动画
+
-
电子
-
-
-
电子
中子
质
子
原子核
原子
原子核
核外电子
中子
质
子
(不带电)
6+
6+
6
-
+
+
+
+
+
原子核
粒子种类
电性
质量(kg)
质子
1个单位正电荷
1.6726×10-27
中子
不带电
1.6749×10-27
电子
1个单位负电荷
质子质量的1/1836
阅读上表(表4-1
),你能得出什么结论呢?
1、质子带
电,中子
电,电子带
电。
3、质子和中子的质量
相等,但比
大得多。
2、中子
电,所以原子核的电性由
决定,
因此原子核带
电,(核电荷数)数目跟质子相等。
正
不带
负
不带
质子
正
几乎
4、
的质量非常小,可忽略不计。因此,原子的质量约等于(
的质量)即
和
质量之和。
原子核
质子
电子
中子
电子
原子种类
原子序数
质子数
中子数
核外电子数
氢
1
1
0
1
碳
6
6
6
6
氧
8
8
8
8
钠
11
11
12
11
氯
17
17
18
17
铁
26
26
30
26
观察表格(表4-2
)
,思考下列问题
2、所有原子都是由质子、中子、电子构成的吗?
3、同一种原子质子、电子、中子在数量上有什么关系?
1、不同种原子的质子数相同吗?同种原子的质子数与原子序数有何关系
?
4、原子显电性吗?为什么?
不同原子的质子数不同;质子数与原子序数相等。
氢原子的中子数为0,因此,不是所有的原子都有中子。
质子数一定等于电子数,但不一定等于中子数。
质子和电子数目相等、电性相反,互相抵消
,所以原子不显电性
练习1
1.原子是由居于原子中心带______的原子核和核外带______
的电子构成,原子核是由_______和______构成。由于它们所带的电荷_______
,电性_____,所以整个原子______(填显或不显)电性。
2、能保持物质的化学性质的最小粒子是_____;化学变化中的最小粒子是______;原子中带正电荷的粒子是_
_和_____
_;不显电性的粒子是
、质量最小的粒子是_____;决定原子质量大小的粒子是________。
3、据报道,1994年12月科学家发现了一种新元素,它的原子核内有质子111个,中子161个,则该元素核外电子数是_____
正电
负电
质子
中子
相等
相反
不显
分子
原子
质子
中子
电子
原子核
111
原子核
你想知道原子和原子核究竟有多大吗?
一、原子的构成(小结)
原
子
电
子
原子核
质子
中子
(带
电)
(带
电)
(带
电)
(
电)
核电荷数
=
数
=
数(核外电子数)=原子
。
(
电性)
质子
电子
序数
不带
正
正
负
不显
原子的体积很小
原子与乒乓球体积比相当于乒乓球与地球的体积之比。
原子核(蚂蚁)
原子(体育场
)
原子核比原子小得多
原子很小,让我们看看一个原子有多重:
一个碳原子的质量是:
0.00000000000000000000000001993千克
即1.993×10-26千克
一个氧原子的质量是:
0.00000000000000000000000002657千克
即2.657×10-26千克
一个铁原子的质量是:
0.00000000000000000000000009288千克
即9.288×10-26千克
原子的质量很小,记忆、计算都很不方便,怎么办?
二、原子很小,原子核更小
(1)原子质量的单位是
。
“相对原子质量”单位为“
”
。
(2)原子质量是原子的
质量,“相对原子质量”是该种原子的
除以1.66×10-27
kg(碳原子的质量的1/12)所得
的一个比值。
(3)
教授为相对原子质量测定作出了卓越贡献。
什么叫相对原子质量?原子质量与相对原子质量相同吗
?有何区别?
自学提示2:阅读课本第
71页
三、相对原子质量(Ar)
相对原子质量就是以一种碳原子(C-12)质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比。
1.66×10-27
(kg)
Ar=
一种原子(A)的质量(kg)
氢原子的相对原子质量=
≈
1
1.67×10-27kg
1.66×10-27kg
碳原子的相对原子质量=
=12
1.66×10-27kg
1.992×10-26kg
氧原子的相对原子质量=
≈
16
1.66×10-27kg
2.657×10-26kg
(1)原子质量的单位是
。
“相对原子质量”单位为“
”
。
(2)原子质量是原子的
质量,
“相对原子质量”是该种原子的
的质量除以1.66×10-27
kg(碳原子的质量的1/12)所得的一个比值。
(3)
教授为相对原子质量测定作出了卓越贡献。
(4)根据元素周期表查出下列原子的相对原子质量:钾
、钠、镁、硫、氧、氮
千克(Kg)
1
实际
一个原子
小结:
张青莲
相对原子质量的近似值
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
氯
17
18
17
35
铁
26
30
26
56
看数值,找规律
核电荷数=核内质子数=核外电子数
相对原子质量≈质子数+中子数
1、同种原子核电荷数、质
子数与电子数有何关系?
2、同种原子质
子数与中子数与相对原子质量有何关系?
练习2
1、填表:
2、氧原子的相对原子质量为(
)
A、16g
B、16
C、2.657×10-26kg
D、16g
3、最近,俄罗斯科学家宣布他们通过核反应合成了核电荷数为114、相对原子质量为289的超重元素原子,该原子内质子数为
,中子数为
,核外电子数为
。
4、练习(作业):学习指导32-33页
原子种类
核电荷数
质子数
中子数
电子数
相对原子质量
H
1
?
?
?
Mg
12
?
?
24
Fe
?
26
?
56
B
114
175
114
1
0
12
26
30
1
1
12
12
26
多
谢
指
导
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
