北京课标版化学上册第3章第二节 原子核外电子的排布 离子(21张PPT)
文档属性
| 名称 | 北京课标版化学上册第3章第二节 原子核外电子的排布 离子(21张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-30 09:26:29 | ||
图片预览



文档简介
(共22张PPT)
原子核外电子排布
学习目标
1.能说出核外电子是怎样运动的,知道原子的化学性质与其最外层电子数关系密切。
2.能说出稀有气体、金属、非金属原子最外层电子数,并能说出金属、非金属原子易得还是易失去电子。
3.
能判断粒子是否具有相对稳定结构。
4.能用质子数和核外电子数的关系判断微粒是原子还是离子。
5.能说出离子符号中的“数值”
和“正负号”
的意义。
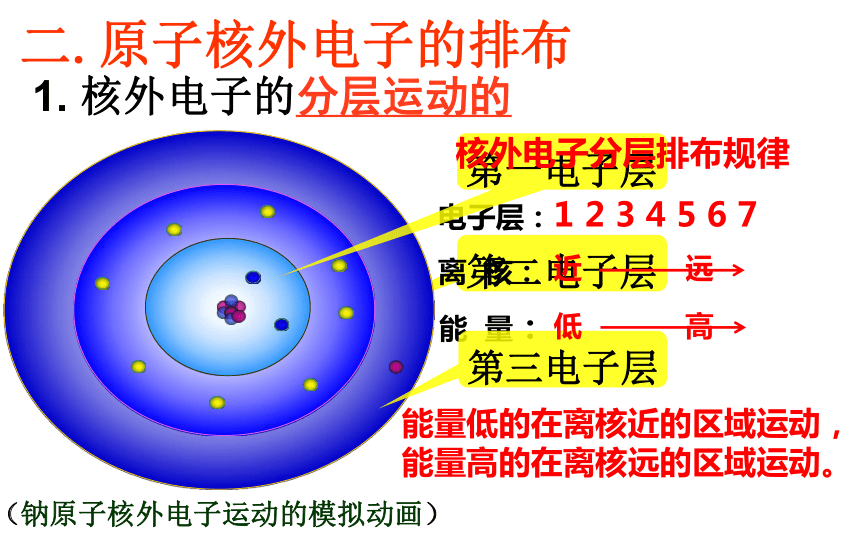
第二电子层
电子层:
离
核:
能
量:
第三电子层
(钠原子核外电子运动的模拟动画)
第一电子层
二.原子核外电子的排布
1.
核外电子的分层运动的
1
2
3
4
5
6
7
核外电子分层排布规律
近
远
低
高
能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
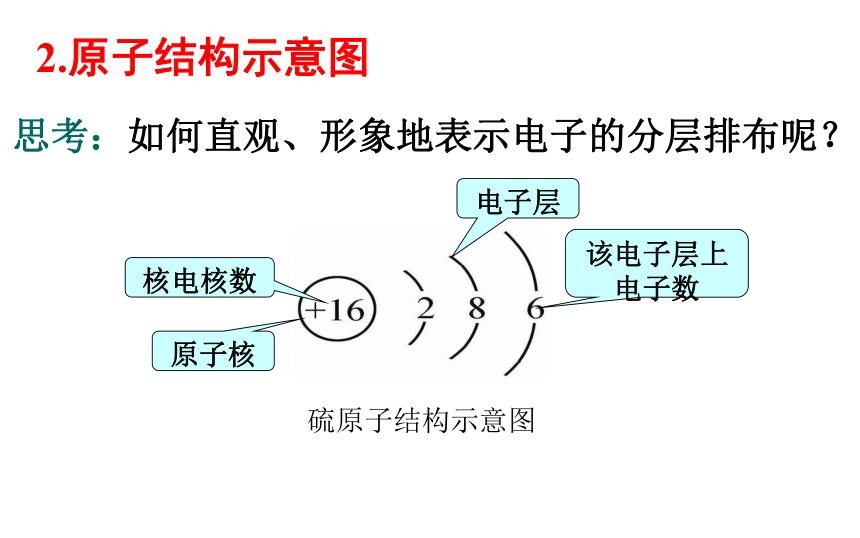
2.原子结构示意图
思考:如何直观、形象地表示电子的分层排布呢?
硫原子结构示意图
原子核
核电核数
电子层
该电子层上电子数
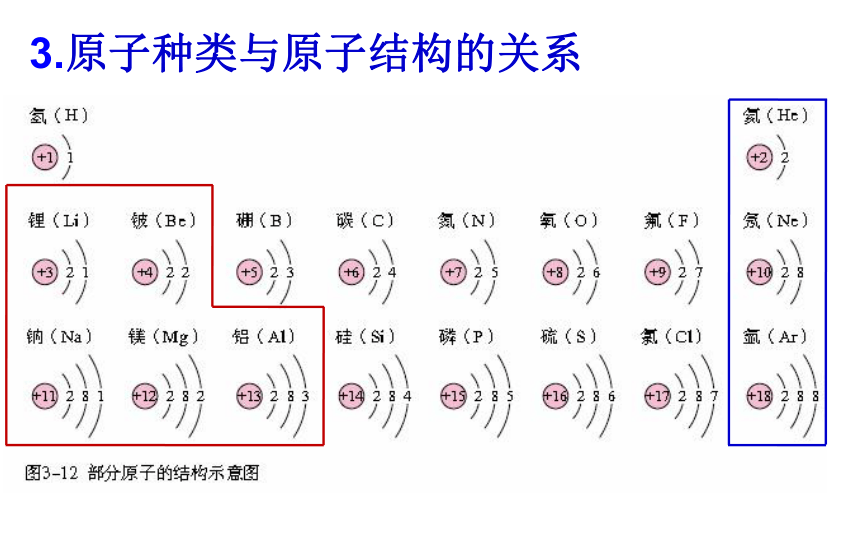
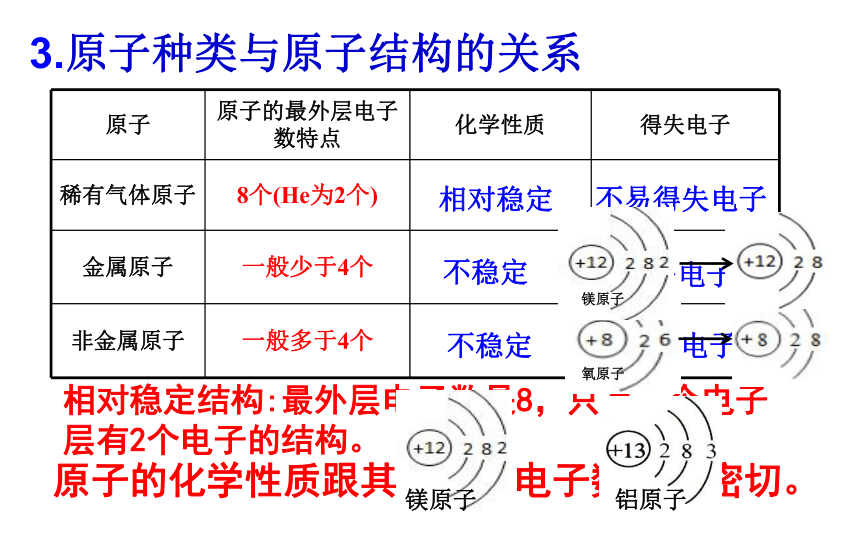
3.原子种类与原子结构的关系
原子
原子的最外层电子数特点
化学性质
得失电子
稀有气体原子
8个(He为2个)
金属原子
一般少于4个
非金属原子
一般多于4个
易失电子
易得电子
不易得失电子
相对稳定
不稳定
不稳定
相对稳定结构:最外层电子数是8,只有一个电子层有2个电子的结构。
3.原子种类与原子结构的关系
原子的化学性质跟其最外层电子数关系密切。
氧原子
镁原子
镁原子
铝原子
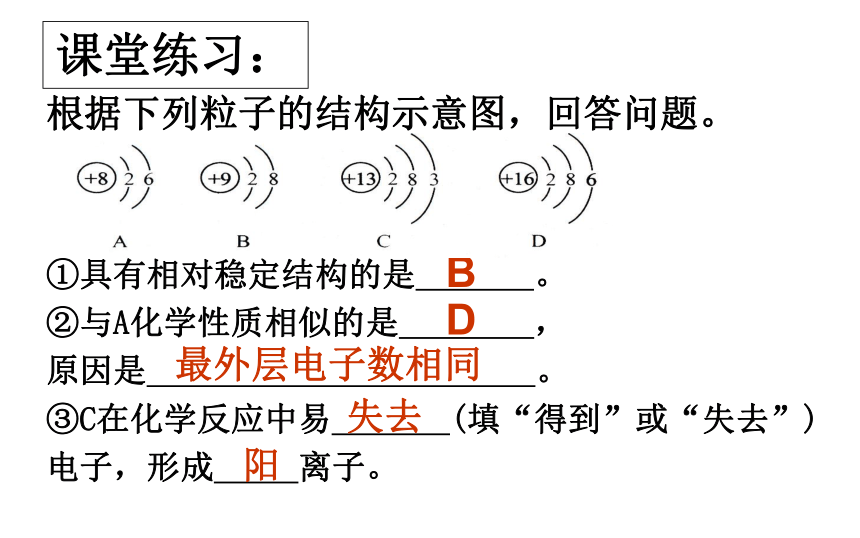
课堂练习:
根据下列粒子的结构示意图,回答问题。
①具有相对稳定结构的是
。
②与A化学性质相似的是
,
原因是
。
③C在化学反应中易
(填“得到”或“失去”)
电子,形成
离子。
D
B
失去
阳
最外层电子数相同
+12
-
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
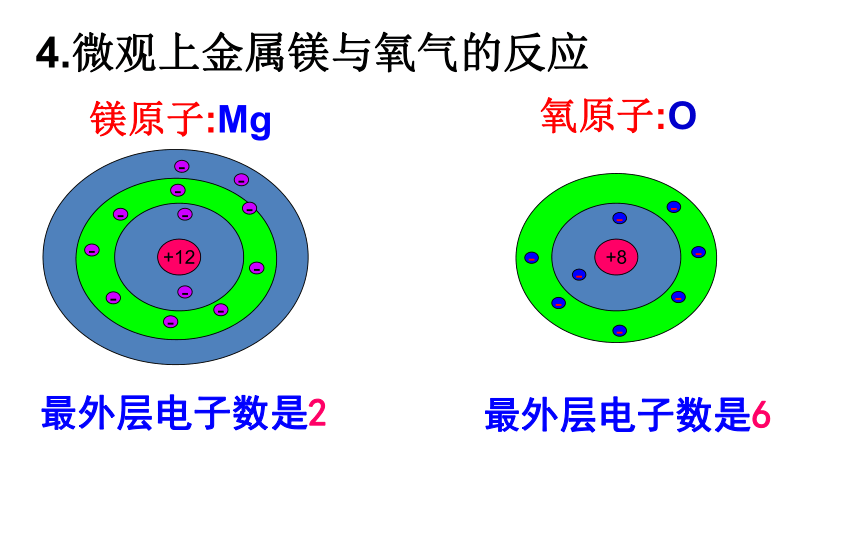
镁原子:Mg
氧原子:O
最外层电子数是2
4.微观上金属镁与氧气的反应
最外层电子数是6
-
+12
-
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁原子:Mg
氧原子:O
-
4.微观上金属镁与氧气的反应
+12
-
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁原子:Mg
氧原子:O
-
4.微观上金属镁与氧气的反应
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
-
-
形成相对稳定结构
形成相对稳定结构
4.微观上金属镁与氧气的反应
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
4.金属镁与氧气反应
-
-
静电作用
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
4.金属镁与氧气反应
-
-
静电作用
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
-
-
静电作用形成化合物
构成MgO
4.微观上金属镁与氧气的反应
表演金属镁与氧气反应
课堂活动:
氧原子
镁原子
你们能表演金属镁与氯气(Cl2)反应?
课堂活动:
氯原子
镁原子
7
5.离子符号
Na+
、Cl-
、Mg2+
离子符号的写法:
在元素符号的右上角标出“电量”
和“电性”
。
注意:“电量”
在前,“电性”
在后,
电量为“1”略去。
根据下列粒子的结构示意图,回答问题。
A
B
C
①A与C反应形成物质的符号是
。
②
B粒子的化学符号是
。
课堂练习:
Na2S
Al3+
Al
归纳与总结:你的收获
1.能说出核外电子是怎样运动的,知道原子的化学性质与其最外层电子数关系密切。
2.能说出稀有气体、金属、非金属原子最外层电子数,并能说出金属、非金属原子易得还是易失去电子。
3.
能判断粒子是否具有相对稳定结构。
4.能用质子数和核外电子数的关系判断微粒是原子还是离子。
5.能说出离子符号中的数值和正负号的意义。
再见
原子核外电子排布
学习目标
1.能说出核外电子是怎样运动的,知道原子的化学性质与其最外层电子数关系密切。
2.能说出稀有气体、金属、非金属原子最外层电子数,并能说出金属、非金属原子易得还是易失去电子。
3.
能判断粒子是否具有相对稳定结构。
4.能用质子数和核外电子数的关系判断微粒是原子还是离子。
5.能说出离子符号中的“数值”
和“正负号”
的意义。
第二电子层
电子层:
离
核:
能
量:
第三电子层
(钠原子核外电子运动的模拟动画)
第一电子层
二.原子核外电子的排布
1.
核外电子的分层运动的
1
2
3
4
5
6
7
核外电子分层排布规律
近
远
低
高
能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
2.原子结构示意图
思考:如何直观、形象地表示电子的分层排布呢?
硫原子结构示意图
原子核
核电核数
电子层
该电子层上电子数
3.原子种类与原子结构的关系
原子
原子的最外层电子数特点
化学性质
得失电子
稀有气体原子
8个(He为2个)
金属原子
一般少于4个
非金属原子
一般多于4个
易失电子
易得电子
不易得失电子
相对稳定
不稳定
不稳定
相对稳定结构:最外层电子数是8,只有一个电子层有2个电子的结构。
3.原子种类与原子结构的关系
原子的化学性质跟其最外层电子数关系密切。
氧原子
镁原子
镁原子
铝原子
课堂练习:
根据下列粒子的结构示意图,回答问题。
①具有相对稳定结构的是
。
②与A化学性质相似的是
,
原因是
。
③C在化学反应中易
(填“得到”或“失去”)
电子,形成
离子。
D
B
失去
阳
最外层电子数相同
+12
-
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁原子:Mg
氧原子:O
最外层电子数是2
4.微观上金属镁与氧气的反应
最外层电子数是6
-
+12
-
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁原子:Mg
氧原子:O
-
4.微观上金属镁与氧气的反应
+12
-
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁原子:Mg
氧原子:O
-
4.微观上金属镁与氧气的反应
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
-
-
形成相对稳定结构
形成相对稳定结构
4.微观上金属镁与氧气的反应
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
4.金属镁与氧气反应
-
-
静电作用
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
4.金属镁与氧气反应
-
-
静电作用
+12
-
-
-
-
-
-
-
-
-
-
+8
-
-
-
-
-
-
-
-
镁离子:Mg2+
氧离子:O2-
-
-
静电作用形成化合物
构成MgO
4.微观上金属镁与氧气的反应
表演金属镁与氧气反应
课堂活动:
氧原子
镁原子
你们能表演金属镁与氯气(Cl2)反应?
课堂活动:
氯原子
镁原子
7
5.离子符号
Na+
、Cl-
、Mg2+
离子符号的写法:
在元素符号的右上角标出“电量”
和“电性”
。
注意:“电量”
在前,“电性”
在后,
电量为“1”略去。
根据下列粒子的结构示意图,回答问题。
A
B
C
①A与C反应形成物质的符号是
。
②
B粒子的化学符号是
。
课堂练习:
Na2S
Al3+
Al
归纳与总结:你的收获
1.能说出核外电子是怎样运动的,知道原子的化学性质与其最外层电子数关系密切。
2.能说出稀有气体、金属、非金属原子最外层电子数,并能说出金属、非金属原子易得还是易失去电子。
3.
能判断粒子是否具有相对稳定结构。
4.能用质子数和核外电子数的关系判断微粒是原子还是离子。
5.能说出离子符号中的数值和正负号的意义。
再见
同课章节目录
- 第1章 走进化学
- 第一节 化学让世界更美好
- 第二节 实验是化学的基础
- 第2章 空气之谜
- 第一节 空气
- 第二节 氧气的制法
- 第三节 氧气的性质
- 第3章 构成物质的微粒
- 第一节 原子
- 第二节 原子核外电子的排布 离子
- 第三节 分子
- 第4章 最常见的液体——水
- 第一节 水的净化
- 第二节 水的变化
- 第三节 水资源的开发、利用和保护
- 第5章 化学元素与物质组成的表示
- 第一节 初步认识化学元素
- 第二节 物质组成的表示——化学式
- 第三节 化合价
- 第6章 燃烧的学问
- 第一节 探索燃烧与灭火
- 第二节 化学反应中的能量变化
- 第三节 化石燃料
- 第7章 化学反应的定量研究
- 第一节 质量守恒定律
- 第二节 化学方程式
- 第三节 依据化学方程式的简单计算
- 第8章 碳的世界
- 第一节 碳的单质
- 第二节 二氧化碳的性质和用途
- 第三节 二氧化碳的实验室制法
