人教版(2019)高中化学第二章第2节第2课时氯气的实验室制法氯离子的检验练习(解析版)
文档属性
| 名称 | 人教版(2019)高中化学第二章第2节第2课时氯气的实验室制法氯离子的检验练习(解析版) |  | |
| 格式 | doc | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-09-30 16:52:51 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
第2课时 氯气的实验室制法 氯离子的检验
基 础 达 标
一、选择题(每小题有1个或2个选项符合题意)
1.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( C )
解析:集气瓶_??¨?????????è?????_塞紧,只能进气,不能排气,则瓶内压强增大到一定程度,可能将橡胶塞弹出,A项错误;因为Cl2比空气的密度大,用B项装置收集时,Cl2应从短管进入,空气从长管排出,B项错误;C项装置既能收集Cl2,又能进行尾气处理且防倒吸,C项正确;由于Cl2和NaOH溶液反应,所以D项装置不能收集到Cl2,D项错误。21cnjy.com
2.下列离子方程式书写正确的是( A )
A.氯气溶于水:Cl2+H2O===H++Cl-+HClO
B.氯气和烧碱作用:Cl2+OH-===2Cl-+H2O
C.浓盐酸制取氯气:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.钠和水作用:Na+2H2O===Na++H2↑+2OH-
解析:HClO是难电离的弱酸,写化学式,A项正确;B项还有ClO-生成;C、D两项均没配平。
3.下列关于实验室制取Cl2的说法正确的是( D )
A.将混有HCl杂质的Cl2通过盛有饱和NaHCO3溶液的洗气瓶除去杂质
B.实验室制取Cl2的反应中,浓盐酸起到酸性和氧化剂作用
C.实验室用如图装置除去Cl2中少量的HCl
D.实验室制备Cl2,可用排饱和食盐水集气法收集
解析:Cl2可与饱和NaHCO3_??????????????????_CO2,引入新的杂质,并且消耗Cl2,A项不正确;实验室制取Cl2的反应中,浓盐酸起到酸性和还原剂的作用,B项不正确;用饱和食盐水除去Cl2中少量的HCl气体时,导气管应长进短出,C项不正确;因为Cl2能溶于水,而难溶于饱和食盐水,故实验室可用排饱和食盐水法收集Cl2,D项正确。21·cn·jy·com
4.现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的一种试剂是( C )
A.AgNO3溶液 B.酚酞溶液
C.紫色石蕊溶液 D.饱和食盐水
解析:紫色石蕊溶液遇盐酸变红,遇NaCl溶液无明显现象,遇NaOH溶液变蓝,遇新制氯水先变红后褪色。www.21-cn-jy.com
5.下列变化不能直接实现的是( D )
①(HCl)→②(Cl2)→③[Ca(ClO)2]→④(HClO)→⑤(CO2)
A.①→② B.②→③
C.③→④ D.④→⑤
解析:HClO的酸性比碳酸弱,所以HClO不能直接与碳酸盐反应生成CO2。
二、非选择题
6.有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是__KCl和K2CO3__,可能含有的成分是__KNO3__;
(2)请写出上述实验中有关反_????????????????¨?_式:__Ag++Cl-===AgCl↓,2Ag++CO===Ag2CO3↓,Ag2CO3+2H+===2Ag++H2O+CO2↑__。21教育网
解析:由②中产生白色_????·?????????????_色固体可能含有K2CO3和KCl中的一种或两种;由③中沉淀量减少且有气泡生成知,一定含有K2CO3;根据沉淀不完全消失可知,一定含有KCl。
7.Cl2是一种重要的化工原料,下图是一些含氯产品。
(1)①中钢瓶上应贴的标签为__C__。
A.腐蚀品 B.爆炸品
C.有毒品 D.易燃品
(2)工业上利用Cl2制_???é??????????????_方程式为__H2+Cl22HCl__。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是__D__。2·1·c·n·j·y
A.硝酸银溶液 B.酚酞溶液
C.碳酸钠溶液 D.紫色石蕊溶液
(3)将8.7 g MnO2与足量浓盐酸混合加热,被氧化的HCl的质量是__7.3__ g。
解析:(1)Cl2有毒,贮存Cl2的钢瓶应贴的标签为有毒品。
(2)久置氯水的成分为稀盐_é???????°????°??°?_中含有Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,新制氯水和稀盐酸均与AgNO3溶液反应生成白色沉淀,均与Na2CO3溶液反应放出CO2气体,遇酚酞溶液均无明显现象。新制氯水中加入紫色石蕊溶液先变红后褪色,而稀盐酸中加入紫色石蕊溶液只变红色。21·世纪*教育网
(3)利用化学方程式进行计算。
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
87 g 146 g
8.7 g m(HCl)
=
解得m(HCl)=14.6 g
被氧化的HCl的质量为参加反应HCl的质量的一半,即7.3 g。
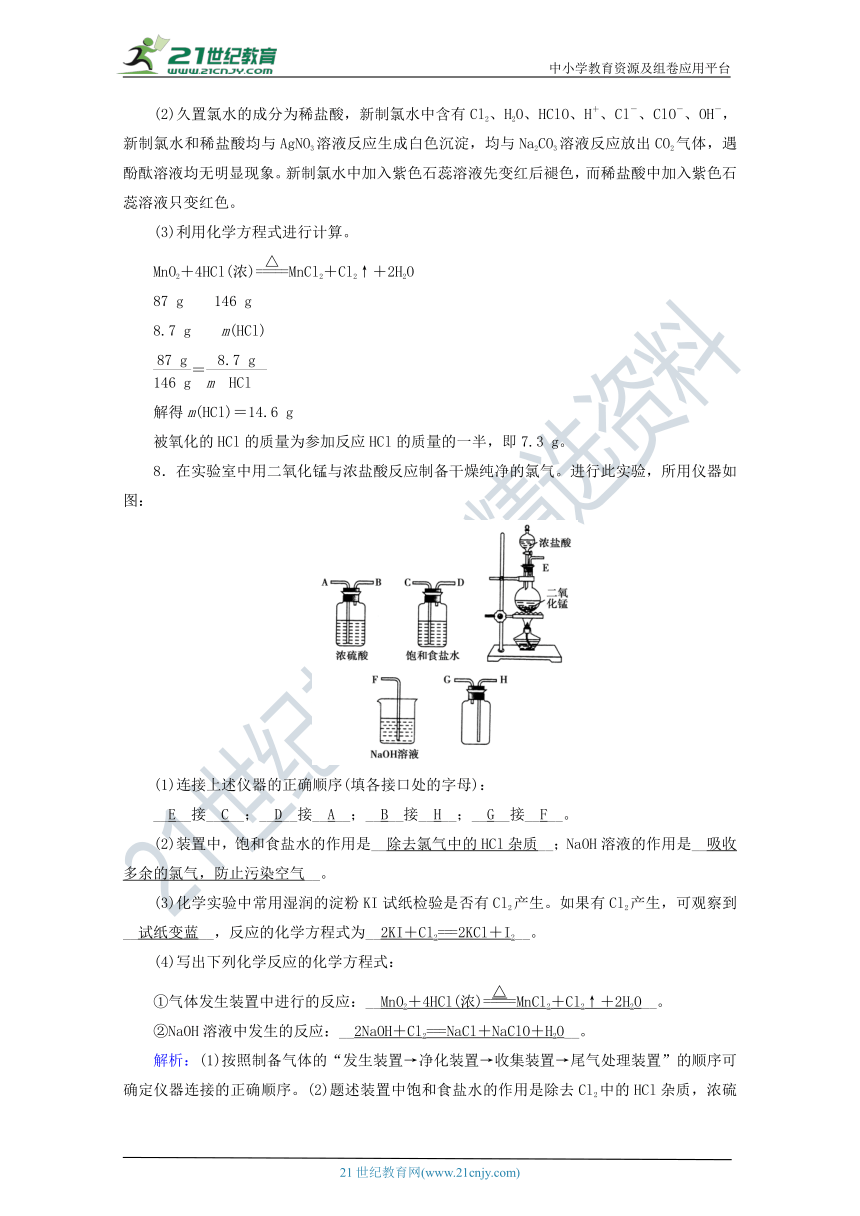
8.在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):
__E__接__C__;__D__接__A__;__B__接__H__;__G__接__F__。
(2)装置中,饱和食盐水的作用是__除去氯气中的HCl杂质__;NaOH溶液的作用是__吸收多余的氯气,防止污染空气__。【来源:21·世纪·教育·网】
(3)化学实验中_?????¨??????????·?_粉KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到__试纸变蓝__,反应的化学方程式为__2KI+Cl2===2KCl+I2__。www-2-1-cnjy-com
(4)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:__MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O__。
②NaOH溶液中发生的反应:__2NaOH+Cl2===NaCl+NaClO+H2O__。
解析:(1)按照制备气体的_?????????è????????_净化装置→收集装置→尾气处理装置”的顺序可确定仪器连接的正确顺序。(2)题述装置中饱和食盐水的作用是除去Cl2中的HCl杂质,浓硫酸的作用是干燥Cl2,NaOH溶液的作用是吸收多余的Cl2。(3)湿润的淀粉KI试纸遇Cl2时发生反应:Cl2+2KI===2KCl+I2,淀粉遇I2变蓝。21世纪教育网版权所有
能 力 提 升
一、选择题(每小题有1个或2个选项符合题意)
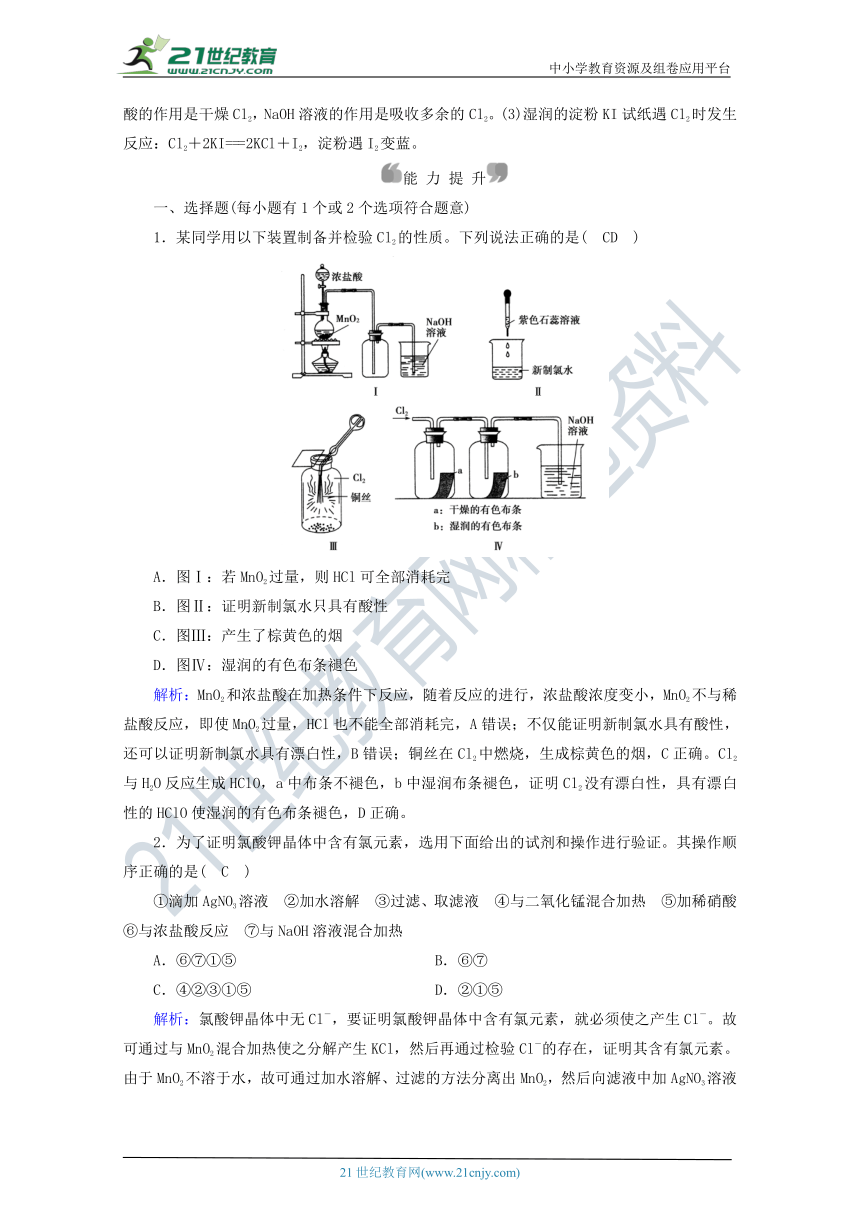
1.某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( CD )
A.图Ⅰ:若MnO2过量,则HCl可全部消耗完
B.图Ⅱ:证明新制氯水只具有酸性
C.图Ⅲ:产生了棕黄色的烟
D.图Ⅳ:湿润的有色布条褪色
解析:MnO2和浓_???é????¨?????????_件下反应,随着反应的进行,浓盐酸浓度变小,MnO2不与稀盐酸反应,即使MnO2过量,HCl也不能全部消耗完,A错误;不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性,B错误;铜丝在Cl2中燃烧,生成棕黄色的烟,C正确。Cl2与H2O反应生成HClO,a中布条不褪色,b中湿润布条褪色,证明Cl2没有漂白性,具有漂白性的HClO使湿润的有色布条褪色,D正确。2-1-c-n-j-y
2.为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。其操作顺序正确的是( C )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀硝酸 ⑥与浓盐酸反应 ⑦与NaOH溶液混合加热21*cnjy*com
A.⑥⑦①⑤ B.⑥⑦
C.④②③①⑤ D.②①⑤
解析:氯酸钾晶体中无Cl-,要证_????°?é??é????????_中含有氯元素,就必须使之产生Cl-。故可通过与MnO2混合加热使之分解产生KCl,然后再通过检验Cl-的存在,证明其含有氯元素。由于MnO2不溶于水,故可通过加水溶解、过滤的方法分离出MnO2,然后向滤液中加AgNO3溶液和稀硝酸进行验证。【来源:21cnj*y.co*m】
3.在自来水的_?????§?????????é??_入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用下列哪一种试剂来鉴别( D )【出处:21教育名师】
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
解析:因纯净水中不含氯离子,而自来水中含氯离子,所以向两样品中加入硝酸银溶液,产生白色浑浊的为自来水,反之是纯净水,D正确。21教育名师原创作品
二、非选择题
4.下面是两位同学设计的证明碳酸钠样品中含有氯化钠的实验方案。
甲:取样品少许加入试管中,加入适量的蒸馏水使之溶解,配成溶液,然后加入AgNO3溶液,看是否有白色沉淀生成。21*cnjy*com
乙:取样品少许加入试管中,加入适量的自来水使之溶解,配成溶液,然后滴加稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成。
(1)两个方案均有不合理之处,请指出:
甲__AgNO3溶液没有用稀硝酸酸化,不能排除CO的干扰__。
乙__用自来水配制溶液会引入Cl-,影响Cl-检验__。
(2)合理的实验方案为__取少许样品加入试管中,加入适量的蒸馏水配成溶液,然后加入稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成__。
解析:甲方案中没有用稀硝酸排除CO的干扰,Ag2CO3也是白色沉淀。乙方案中用自来水配制溶液,自来水中含有Cl-,影响Cl-的检验。
5.某校化学实验兴趣小组探究_??¨???é????¤????¤?_Cl2的过程中是否有水蒸气和HCl挥发出来,同时证明Cl2的某些性质。甲同学设计了如图所示的实验装置(部分支撑用的铁架台省略)。
按要求回答下列问题。
(1)①装置B中盛放的试剂名称为__无水硫酸铜__,作用是__证明有水蒸气挥发出来__,现象是__白色固体变为蓝色__。
②装置D和E中出现的不同现象说明__氯气无漂白性,次氯酸有漂白性__。
③装置F的作用是__吸收氯气__。
④写出装置G中发生反应的离子方程式:__Ag++Cl-===AgCl↓__。
(2)乙同学认为甲同_?????????é????????_陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在__F__与__G__之间(填装置字母),装置中应放入__湿润的淀粉-KI试纸(或湿润的有色布条)__(填试剂或用品名称)。
解析:(1)①白_è??????°????é??é??_吸水生成蓝色晶体,可检验挥发出的气体中含有水蒸气。②干燥的有色布条不褪色,说明氯气与HCl不具有漂白性;湿润的有色布条褪色,由于氯气与水反应生成HCl与次氯酸,盐酸不具有漂白性,所以使有色布条褪色的物质是次氯酸,故次氯酸具有漂白性。③用四氯化碳吸收氯气,防止干扰G中氯化氢的检验。④氯化氢与硝酸银反应生成氯化银和硝酸,反应离子方程式为Ag++Cl-===AgCl↓。
(2)未完全吸收的氯气_????°?????????????_成HCl,干扰G中氯化氢的检验,故在F、G之间加一装置,用湿润的淀粉-KI试纸或湿润的有色布条检验氯气是否被完全吸收。
6.某研究小组为了制备84消毒_???(???è????????_为NaClO)设计了如图装置。并查阅到下列资料:“氯气与水的反应是放热反应,在加热条件下氯气与碱液发生如下反应:3Cl2+6OH-5Cl-+ClO+3H2O”。【版权所有:21教育】
回答下列问题:
(1)装置中的试管内发生反应的离子方程式为__Cl2+2OH-===Cl-+ClO-+H2O__。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?__不能__(填
“能”或“不能”,下同),理由是__氯气中混有的HCl气体进入试管中会和氢氧化钠溶液反应,降低NaClO的产量和纯度__。
(3)装置中能否省去盛浓硫酸的洗气瓶?__能__,理由是__少量水蒸气进入试管中不影响反应__。
(4)装置中能否省去盛冰水的烧杯?__不能__,理由是__氯气与水的反应是放热反应,反应时温度升高,可能引起副反应生成NaClO3__。
解析:本题具有较强的_????????§???è?????_产生的Cl2在冰水冷却下与NaOH发生反应制得消毒液。发生装置产生的Cl2必须通过饱和NaCl溶液除去HCl,否则HCl与NaOH反应将生成NaCl,降低NaClO的产量和纯度;但干燥装置可以省略,因为少量水蒸气不会影响试管中反应;冷却装置不可省略,因为题给信息:氯气与水的反应是放热反应,会使试管内温度升高,引起副反应:3Cl2+6OH-5Cl-+ClO+3H2O。
_21?????????è?????(www.21cnjy.com)_
第2课时 氯气的实验室制法 氯离子的检验
基 础 达 标
一、选择题(每小题有1个或2个选项符合题意)
1.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。下列收集Cl2的正确装置是( C )
解析:集气瓶_??¨?????????è?????_塞紧,只能进气,不能排气,则瓶内压强增大到一定程度,可能将橡胶塞弹出,A项错误;因为Cl2比空气的密度大,用B项装置收集时,Cl2应从短管进入,空气从长管排出,B项错误;C项装置既能收集Cl2,又能进行尾气处理且防倒吸,C项正确;由于Cl2和NaOH溶液反应,所以D项装置不能收集到Cl2,D项错误。21cnjy.com
2.下列离子方程式书写正确的是( A )
A.氯气溶于水:Cl2+H2O===H++Cl-+HClO
B.氯气和烧碱作用:Cl2+OH-===2Cl-+H2O
C.浓盐酸制取氯气:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.钠和水作用:Na+2H2O===Na++H2↑+2OH-
解析:HClO是难电离的弱酸,写化学式,A项正确;B项还有ClO-生成;C、D两项均没配平。
3.下列关于实验室制取Cl2的说法正确的是( D )
A.将混有HCl杂质的Cl2通过盛有饱和NaHCO3溶液的洗气瓶除去杂质
B.实验室制取Cl2的反应中,浓盐酸起到酸性和氧化剂作用
C.实验室用如图装置除去Cl2中少量的HCl
D.实验室制备Cl2,可用排饱和食盐水集气法收集
解析:Cl2可与饱和NaHCO3_??????????????????_CO2,引入新的杂质,并且消耗Cl2,A项不正确;实验室制取Cl2的反应中,浓盐酸起到酸性和还原剂的作用,B项不正确;用饱和食盐水除去Cl2中少量的HCl气体时,导气管应长进短出,C项不正确;因为Cl2能溶于水,而难溶于饱和食盐水,故实验室可用排饱和食盐水法收集Cl2,D项正确。21·cn·jy·com
4.现有盐酸、NaCl溶液、NaOH溶液和新制氯水,可用来区别它们的一种试剂是( C )
A.AgNO3溶液 B.酚酞溶液
C.紫色石蕊溶液 D.饱和食盐水
解析:紫色石蕊溶液遇盐酸变红,遇NaCl溶液无明显现象,遇NaOH溶液变蓝,遇新制氯水先变红后褪色。www.21-cn-jy.com
5.下列变化不能直接实现的是( D )
①(HCl)→②(Cl2)→③[Ca(ClO)2]→④(HClO)→⑤(CO2)
A.①→② B.②→③
C.③→④ D.④→⑤
解析:HClO的酸性比碳酸弱,所以HClO不能直接与碳酸盐反应生成CO2。
二、非选择题
6.有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是__KCl和K2CO3__,可能含有的成分是__KNO3__;
(2)请写出上述实验中有关反_????????????????¨?_式:__Ag++Cl-===AgCl↓,2Ag++CO===Ag2CO3↓,Ag2CO3+2H+===2Ag++H2O+CO2↑__。21教育网
解析:由②中产生白色_????·?????????????_色固体可能含有K2CO3和KCl中的一种或两种;由③中沉淀量减少且有气泡生成知,一定含有K2CO3;根据沉淀不完全消失可知,一定含有KCl。
7.Cl2是一种重要的化工原料,下图是一些含氯产品。
(1)①中钢瓶上应贴的标签为__C__。
A.腐蚀品 B.爆炸品
C.有毒品 D.易燃品
(2)工业上利用Cl2制_???é??????????????_方程式为__H2+Cl22HCl__。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是__D__。2·1·c·n·j·y
A.硝酸银溶液 B.酚酞溶液
C.碳酸钠溶液 D.紫色石蕊溶液
(3)将8.7 g MnO2与足量浓盐酸混合加热,被氧化的HCl的质量是__7.3__ g。
解析:(1)Cl2有毒,贮存Cl2的钢瓶应贴的标签为有毒品。
(2)久置氯水的成分为稀盐_é???????°????°??°?_中含有Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,新制氯水和稀盐酸均与AgNO3溶液反应生成白色沉淀,均与Na2CO3溶液反应放出CO2气体,遇酚酞溶液均无明显现象。新制氯水中加入紫色石蕊溶液先变红后褪色,而稀盐酸中加入紫色石蕊溶液只变红色。21·世纪*教育网
(3)利用化学方程式进行计算。
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
87 g 146 g
8.7 g m(HCl)
=
解得m(HCl)=14.6 g
被氧化的HCl的质量为参加反应HCl的质量的一半,即7.3 g。
8.在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):
__E__接__C__;__D__接__A__;__B__接__H__;__G__接__F__。
(2)装置中,饱和食盐水的作用是__除去氯气中的HCl杂质__;NaOH溶液的作用是__吸收多余的氯气,防止污染空气__。【来源:21·世纪·教育·网】
(3)化学实验中_?????¨??????????·?_粉KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到__试纸变蓝__,反应的化学方程式为__2KI+Cl2===2KCl+I2__。www-2-1-cnjy-com
(4)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:__MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O__。
②NaOH溶液中发生的反应:__2NaOH+Cl2===NaCl+NaClO+H2O__。
解析:(1)按照制备气体的_?????????è????????_净化装置→收集装置→尾气处理装置”的顺序可确定仪器连接的正确顺序。(2)题述装置中饱和食盐水的作用是除去Cl2中的HCl杂质,浓硫酸的作用是干燥Cl2,NaOH溶液的作用是吸收多余的Cl2。(3)湿润的淀粉KI试纸遇Cl2时发生反应:Cl2+2KI===2KCl+I2,淀粉遇I2变蓝。21世纪教育网版权所有
能 力 提 升
一、选择题(每小题有1个或2个选项符合题意)
1.某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( CD )
A.图Ⅰ:若MnO2过量,则HCl可全部消耗完
B.图Ⅱ:证明新制氯水只具有酸性
C.图Ⅲ:产生了棕黄色的烟
D.图Ⅳ:湿润的有色布条褪色
解析:MnO2和浓_???é????¨?????????_件下反应,随着反应的进行,浓盐酸浓度变小,MnO2不与稀盐酸反应,即使MnO2过量,HCl也不能全部消耗完,A错误;不仅能证明新制氯水具有酸性,还可以证明新制氯水具有漂白性,B错误;铜丝在Cl2中燃烧,生成棕黄色的烟,C正确。Cl2与H2O反应生成HClO,a中布条不褪色,b中湿润布条褪色,证明Cl2没有漂白性,具有漂白性的HClO使湿润的有色布条褪色,D正确。2-1-c-n-j-y
2.为了证明氯酸钾晶体中含有氯元素,选用下面给出的试剂和操作进行验证。其操作顺序正确的是( C )
①滴加AgNO3溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热 ⑤加稀硝酸 ⑥与浓盐酸反应 ⑦与NaOH溶液混合加热21*cnjy*com
A.⑥⑦①⑤ B.⑥⑦
C.④②③①⑤ D.②①⑤
解析:氯酸钾晶体中无Cl-,要证_????°?é??é????????_中含有氯元素,就必须使之产生Cl-。故可通过与MnO2混合加热使之分解产生KCl,然后再通过检验Cl-的存在,证明其含有氯元素。由于MnO2不溶于水,故可通过加水溶解、过滤的方法分离出MnO2,然后向滤液中加AgNO3溶液和稀硝酸进行验证。【来源:21cnj*y.co*m】
3.在自来水的_?????§?????????é??_入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,利用自来水冒充纯净水桶装出售。为辨别真伪,可用下列哪一种试剂来鉴别( D )【出处:21教育名师】
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
解析:因纯净水中不含氯离子,而自来水中含氯离子,所以向两样品中加入硝酸银溶液,产生白色浑浊的为自来水,反之是纯净水,D正确。21教育名师原创作品
二、非选择题
4.下面是两位同学设计的证明碳酸钠样品中含有氯化钠的实验方案。
甲:取样品少许加入试管中,加入适量的蒸馏水使之溶解,配成溶液,然后加入AgNO3溶液,看是否有白色沉淀生成。21*cnjy*com
乙:取样品少许加入试管中,加入适量的自来水使之溶解,配成溶液,然后滴加稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成。
(1)两个方案均有不合理之处,请指出:
甲__AgNO3溶液没有用稀硝酸酸化,不能排除CO的干扰__。
乙__用自来水配制溶液会引入Cl-,影响Cl-检验__。
(2)合理的实验方案为__取少许样品加入试管中,加入适量的蒸馏水配成溶液,然后加入稀硝酸酸化的AgNO3溶液,看是否有白色沉淀生成__。
解析:甲方案中没有用稀硝酸排除CO的干扰,Ag2CO3也是白色沉淀。乙方案中用自来水配制溶液,自来水中含有Cl-,影响Cl-的检验。
5.某校化学实验兴趣小组探究_??¨???é????¤????¤?_Cl2的过程中是否有水蒸气和HCl挥发出来,同时证明Cl2的某些性质。甲同学设计了如图所示的实验装置(部分支撑用的铁架台省略)。
按要求回答下列问题。
(1)①装置B中盛放的试剂名称为__无水硫酸铜__,作用是__证明有水蒸气挥发出来__,现象是__白色固体变为蓝色__。
②装置D和E中出现的不同现象说明__氯气无漂白性,次氯酸有漂白性__。
③装置F的作用是__吸收氯气__。
④写出装置G中发生反应的离子方程式:__Ag++Cl-===AgCl↓__。
(2)乙同学认为甲同_?????????é????????_陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在__F__与__G__之间(填装置字母),装置中应放入__湿润的淀粉-KI试纸(或湿润的有色布条)__(填试剂或用品名称)。
解析:(1)①白_è??????°????é??é??_吸水生成蓝色晶体,可检验挥发出的气体中含有水蒸气。②干燥的有色布条不褪色,说明氯气与HCl不具有漂白性;湿润的有色布条褪色,由于氯气与水反应生成HCl与次氯酸,盐酸不具有漂白性,所以使有色布条褪色的物质是次氯酸,故次氯酸具有漂白性。③用四氯化碳吸收氯气,防止干扰G中氯化氢的检验。④氯化氢与硝酸银反应生成氯化银和硝酸,反应离子方程式为Ag++Cl-===AgCl↓。
(2)未完全吸收的氯气_????°?????????????_成HCl,干扰G中氯化氢的检验,故在F、G之间加一装置,用湿润的淀粉-KI试纸或湿润的有色布条检验氯气是否被完全吸收。
6.某研究小组为了制备84消毒_???(???è????????_为NaClO)设计了如图装置。并查阅到下列资料:“氯气与水的反应是放热反应,在加热条件下氯气与碱液发生如下反应:3Cl2+6OH-5Cl-+ClO+3H2O”。【版权所有:21教育】
回答下列问题:
(1)装置中的试管内发生反应的离子方程式为__Cl2+2OH-===Cl-+ClO-+H2O__。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?__不能__(填
“能”或“不能”,下同),理由是__氯气中混有的HCl气体进入试管中会和氢氧化钠溶液反应,降低NaClO的产量和纯度__。
(3)装置中能否省去盛浓硫酸的洗气瓶?__能__,理由是__少量水蒸气进入试管中不影响反应__。
(4)装置中能否省去盛冰水的烧杯?__不能__,理由是__氯气与水的反应是放热反应,反应时温度升高,可能引起副反应生成NaClO3__。
解析:本题具有较强的_????????§???è?????_产生的Cl2在冰水冷却下与NaOH发生反应制得消毒液。发生装置产生的Cl2必须通过饱和NaCl溶液除去HCl,否则HCl与NaOH反应将生成NaCl,降低NaClO的产量和纯度;但干燥装置可以省略,因为少量水蒸气不会影响试管中反应;冷却装置不可省略,因为题给信息:氯气与水的反应是放热反应,会使试管内温度升高,引起副反应:3Cl2+6OH-5Cl-+ClO+3H2O。
_21?????????è?????(www.21cnjy.com)_
