2011年广东省高考理科综合化学卷试题分析
图片预览





文档简介
(共63张PPT)
2011年
广东省高考理科综合化学科
答题分析、评卷总结及教学建议
讲 座 提 纲
第30题(有机题)答题分析及总结
第31题(计算题)答题分析及总结
第32题(无机题)答题分析及总结
第33题(实验题)答题分析及总结
对中学化学相关教学的建议
第30题 (有机题) 答题分析及总结
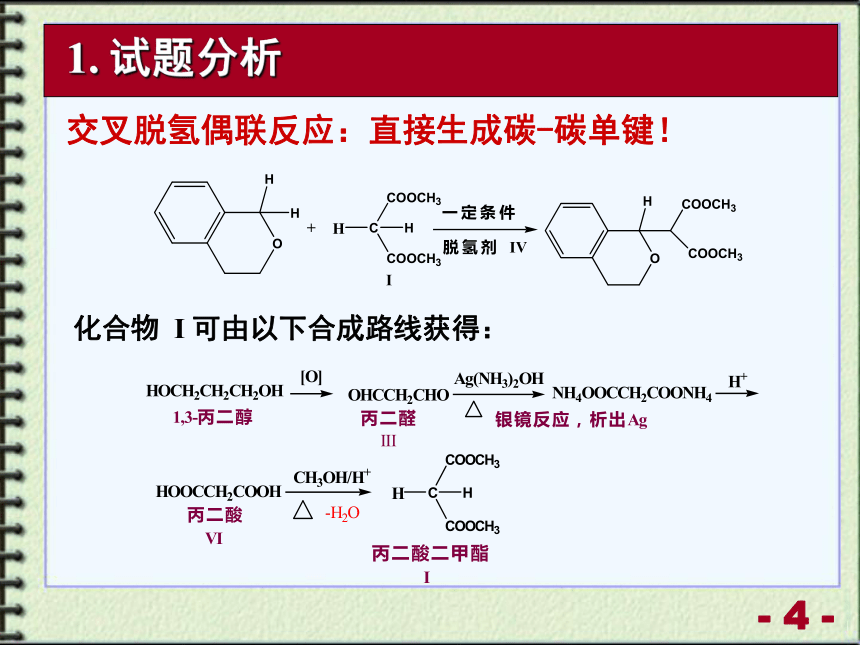
交叉脱氢偶联反应:直接生成碳-碳单键!
化合物 I 可由以下合成路线获得:
1. 试题分析
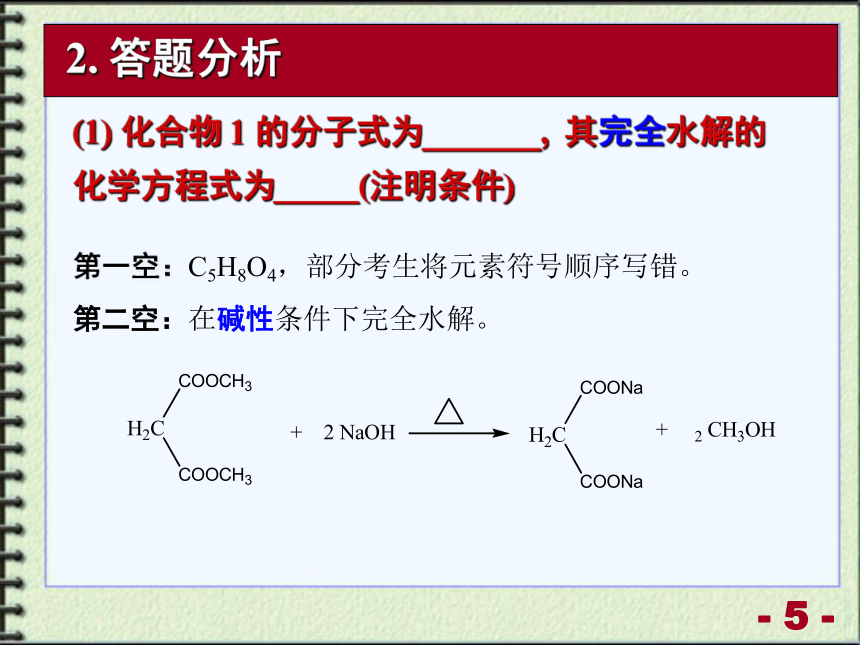
(1) 化合物 1 的分子式为_______, 其完全水解的化学方程式为_____(注明条件)
第一空:C5H8O4,部分考生将元素符号顺序写错。
第二空:在碱性条件下完全水解。
2. 答题分析
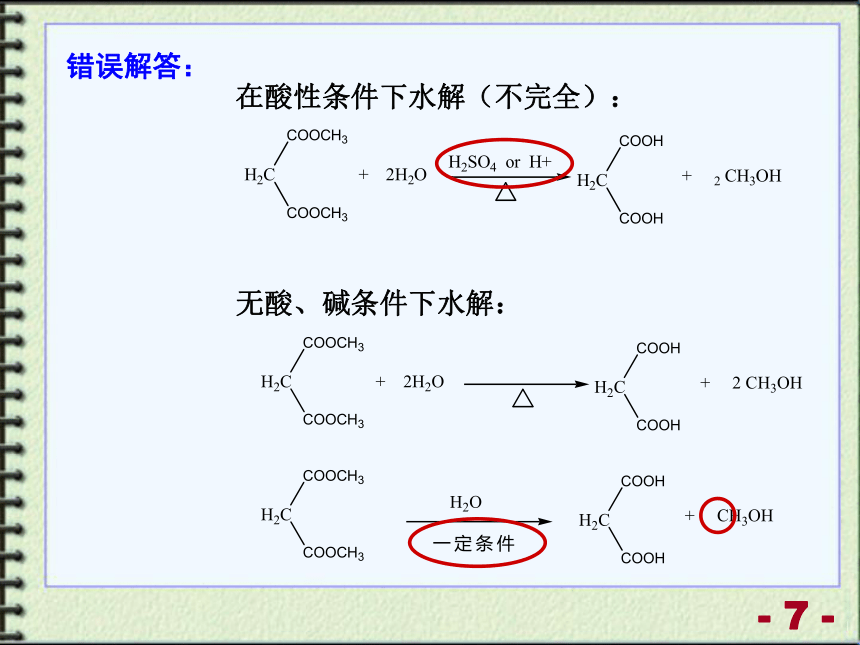
正确解答:
错误解答:
错误解答:
在酸性条件下水解(不完全):
无酸、碱条件下水解:
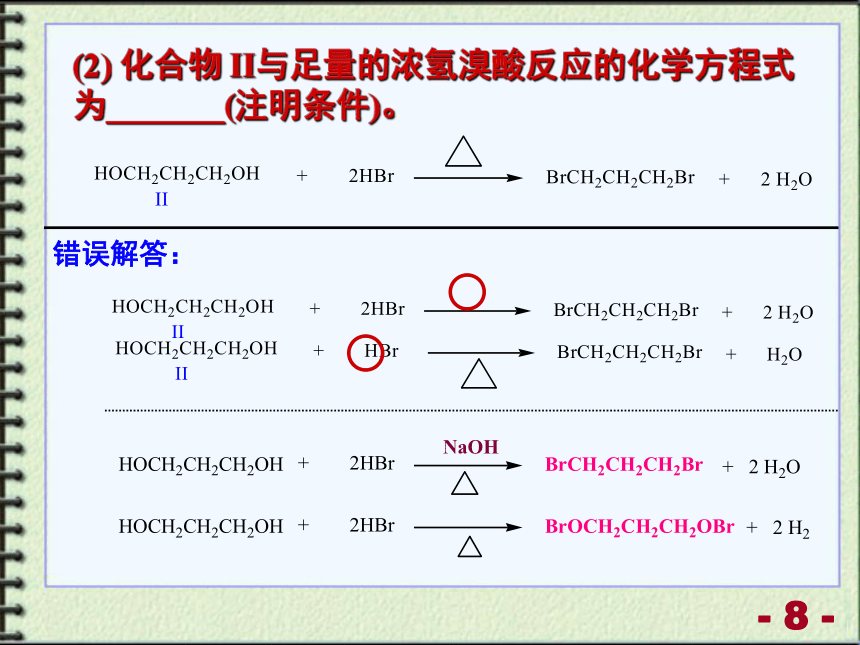
(2) 化合物 II与足量的浓氢溴酸反应的化学方程式为_______(注明条件)。
错误解答:
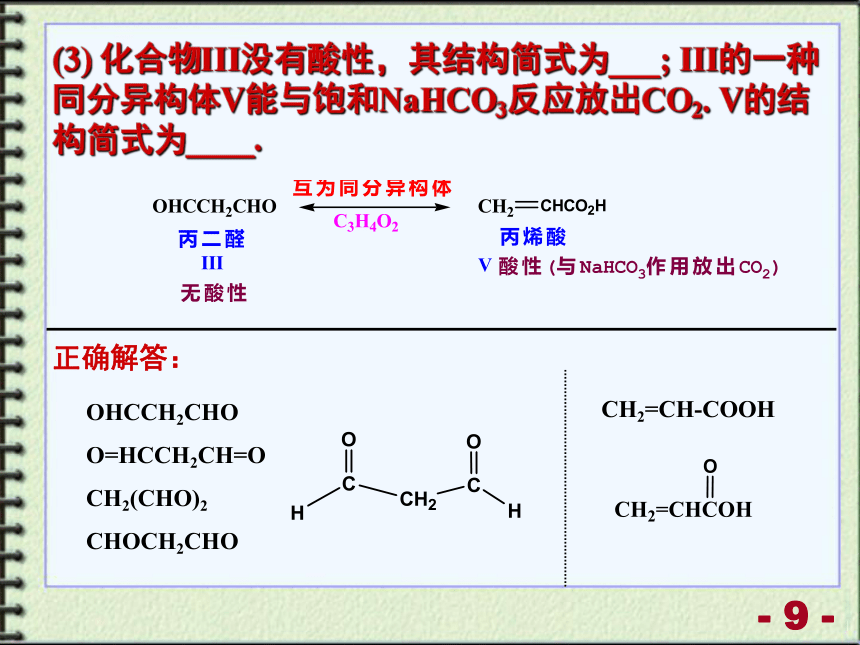
(3) 化合物III没有酸性,其结构简式为___; III的一种同分异构体V能与饱和NaHCO3反应放出CO2. V的结构简式为____.
正确解答:
OHCCH2CHO
O=HCCH2CH=O
CH2(CHO)2
CHOCH2CHO
CH2=CH-COOH
错误解答:
HCO-CH2CHO
CHO-CH2CHO
HO-CCH2CHO
OHCCHCHO
2HC=CHCOOH
CH2=CH2COOH
CH2CCOOH
CH=CHCOOH
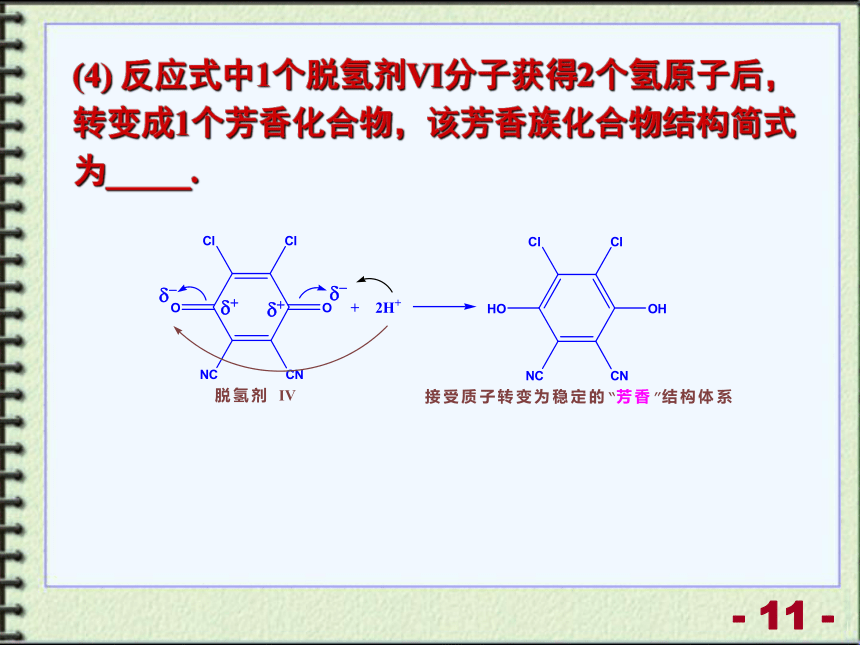
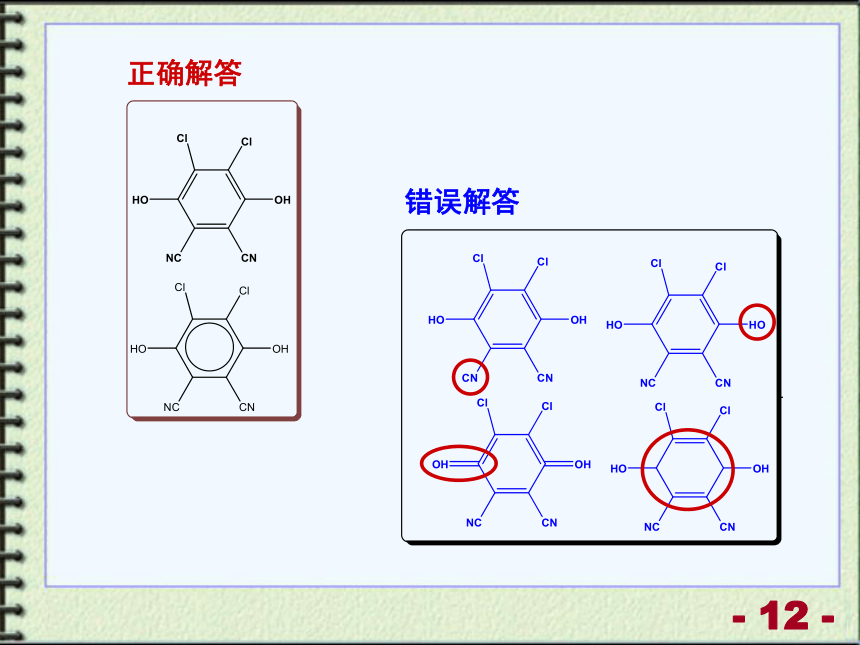
(4) 反应式中1个脱氢剂VI分子获得2个氢原子后,转变成1个芳香化合物,该芳香族化合物结构简式为_____.
错误解答
正确解答
(5) 1分子N,N-二甲基苯胺与1分子苯乙炔在一定条件下发生反应①的反应,其产物分子的结构简式为____; 1 mol该产物最多可与____mol H2发生加成反应。
错误解答
正确解答
规范:结构简式或结构式写法。
规范:化学键连接方式。
规范:有机化学方程式的写法。
规范:注意反应条件。
加强:信息迁移与推理能力的训练。
加强重点、难点教学:有机物结构、反应及性质;有机反应类型;官能团的相互转换。
3. 有机化学教学建议
第31题 (计算题) 答题分析及总结
难度适中,与2010年相比难度相当,但阅读量和计算量却增加很多。
得分情况:平均分:8.52。
1. 试题得分情况
参考答案:υⅢ>υⅡ>υⅠ,Ⅱ。大多考生正确;
部分考生书写不规范,如υ3>υ2>υ1,2等;
部分学生读图能力较差,不能理解平均反应速率的概念,没注意到限定时间为0-30小时内的平均速率,直接通过起点的斜率来读速率。
2. 答题分析
(1) 在0-30小时内,CH4的平均生产速率υⅢ、υⅡ、υⅠ从大到小的顺序为 ;反应开始后的12小时内,在第 种催化剂作用下,收集的CH4最多。
约一半考生能够准确理解化学反应过程中能量变化,并用图形表达出来。
有部分考生对反应基本原理理解不够,在画图过程中没有体现活化能峰。
(2) ① 在答题卡的坐标图中,画出反应过程中体系能量变化图(进行必要标注)
部分学生混淆吸热反应和放热反应(即:没有理解△H的正负号的含义)。
标注不规范、错误,如△H的单位写错,或△H写为E,或直接写成错误的数值等。
方法一:设CH4初始浓度为x mol·L-1
(2) ② 将等量物质的CH4和H2O充入1L恒容密闭反应器,某温度下反应达到平衡,平衡常数K=27,求CH4的平衡转化率(计算结果保留两位有效数字)
考生主要采用以下四种求解方法:
本小题大部分学生都可以按照转化率的计算格式来设未知数(初始或平衡时甲烷的浓度等);利用平衡常数公式代入数据进行计算;最后计算出甲烷的转化率。
方法二:设CH4平衡浓度为x mol·L-1
方法三:设CH4初始摩尔数为x mol
方法四:设CH4转化率为x
平衡表达式写错,主要是在平衡表达式中漏掉H2O的平衡浓度。
物质间量的关系对应错误、写错关系式。
计算错误:方法一、三中,求解出x=0.20,甚至计算0.1/0.11得0.09、0.99、0.0909等错误结果。
粗心大意:方程式抄错、漏掉3次方或3次方写为2次方、0.10写成0.2或0.01等。
有效数字错误。
书写不规范:不标注初始或平衡浓度。
审题不仔细:将甲烷初始的摩尔数设为1。
热化学方程式的书写部分,部分考生不会写或没时间写,做了的考生正确率较高。
主要错误:忘记物质状态,方程式没有配平,几个方程式相加错误等。
(3) 已知,CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ/mol,写出CO2生产CO的热反应方程式。
规范:方程式书写,单位表示,文字表达,画图(标注、坐标轴名称及单位、线型、曲线变化趋势及定位等),有效数字。
准确:计算要准确,单位换算要无误,物质间量的关系要清楚。
重点掌握原理概念:反应速率、平衡常数、转化率等原理概念要清晰、明确,计算公式才不会出问题。
3. 计算题教学建议
第32题 (无机题) 答题分析及总结
32题是一道工艺题,大部分考生对工业流程图不熟,难以短时间内对整个熔盐电离铝工艺流程有正确的理解,导致得分偏低。
中学化学教学中涉及络合物的内容较少,能正确写对铝电极的主要电极反应式的学生极少。
1. 得分总体情况
典型错误:反应物、生成物不正确;方程式没有配平。
2. 答题分析及总结
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的物质。相关的化学方程式为① 和② 。
8Al + 3Fe3O4 = 9Fe + 4Al2O3
Al + Fe2O3 = Fe + Al2O3
3Na2SiO3 + 2Al =Al2(SiO3)3 + 6Na
分析:考生对氧化铁和石英砂的概念不清。如将氧化铁写成FeO或Fe3O4;将石英砂写成Na2SiO3。
参考答案:HCl, AlCl3; NaCl
典型错误:普遍存在漏填,错填和多填现象。
(2) 将Cl2连续通入坩埚中的粗铝熔体,杂质也随气泡上浮除去,气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
H2, HCl; NaCl H2; NaCl
HCl; AlCl3 H2; AlCl3
分析:审题不清,没有注意到题目给出的条件:AlCl3在180 ℃升华,NaCl的熔点为801℃;所以在反应条件700 ℃条件下,尾气中应有AlCl3,而浮渣中应包含NaCl。
参考答案:Cl2+2OH-=Cl- + ClO- + H2O; H+ + OH- = H2O
典型错误:反应物、生成物不正确;只写化学方程式;离子方程式没有正确配平。
(3) 在用废碱液处理气体A的过程中,所发生的离子方程式为 。
Cl2 + 2OH- = Cl- + ClO-
Cl2 + 2NaOH = NaCl + NaClO + H2O
HCl + OH- = H2O + Cl-
分析:大部分学生能想到尾气中多余的氯气会与废碱液反应,但较少学生能想到粗铝含的氢气会与氯气反应形成氯化氢,所以较少学生能写出H+ + OH- = H2O方程式。
参考答案:阳 Al - 3e- + 7AlCl4- = 4Al2Cl7-
典型错误:第一空较多考生填写:正极。绝大部分考生在第二空(铝电极的主要电极反应式)没有写对。
(4) 镀铝电解池中,金属铝为 极,熔融盐电解液中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电极的主要电极反应式为 。
Al - 3e- + 4Cl- = AlCl4- Al - 6e- + 7Cl- = Al2Cl7-
Al - 3e- = Al3+ AlCl4- - 3e- = Al2Cl7-
分析:原电池与电解池的区别不清晰。原电池中电极分为正极和负极,而电解池中电极分为阳极和阴极。
参考答案:致密的的氧化膜能隔绝钢材与空气中的O2、CO2、H2O等接触,使电化学腐蚀和化学腐蚀不能发生。
典型错误:没正确解释氧化铝能防止钢材腐蚀的原因,没有回答到点子上。
(5) 钢材镀铝后,表面形成的致密氧化膜能防止钢材腐蚀,其原因是 。
分析:正确理解致密氧化铝膜的作用:① 氧化铝薄膜化学性质稳定,不与空气中O2、CO2 和 H2O 等反应;② 致密氧化铝薄膜可隔绝钢材与空气中O2、CO2 和 H2O 等接触。
镀铝后,钢材相当于原电池,铝作阳极保护钢材。
氧化铝与钢铁构成原电池,有利于防止钢材腐蚀。
氧化铝膜不与酸、碱反应。
氧化铝不发生化学反应。
致密的氧化铝隔绝了空气,使其不与铝发生反应。
氧化铝稳定,熔点、沸点高。
铝较活泼易被空气中的氧气氧化。
错误解答:
第33题 (实验题) 答题分析及总结
平均分:8.3;标准差:4.7。
给分分布情况:
1. 答题情况统计
答题情况:给分点1基本能拿到2分,给分点2得分的考生很少。
2. 考生答题分析
第一问:所剩不溶物仅为BaCO3的原因
表述不够严谨:如Ba2+与CO2反应、 Ba2+与CO32-反应、Ba(OH)2与H2CO3反应等,没有考虑试题提供的环境(空气中)。
表述不够准确:如Ba(OH)2吸收CO2、Ba(OH)2变质、Ba(OH)2与空气反应等。
科学性错误:如Ba2CO3、列出化学方程式反应物或产物错误、Ba(OH)2被CO2氧化、Ba(OH)2与O2反应生成BaCO3等。
逻辑性问题:部分学生仅从溶解度角度分析BaCO3不溶的原因,而没有考虑BaCO3是怎么来的,为什么未溶物全部都是BaCO3。
答题存在的问题:
Ba(OH)2与CO2全部反应。
大部分Ba(OH)2与CO2反应(剩余少量溶解)。
空气中SO2含量低,不与Ba(OH)2反应生成不溶BaSO3。
较佳解答:
大部分考生没有结合试题提供的溶解度信息来考虑 “ 仅 ” 这一个非常重要的限定词,因此这一点丢分很严重。
阅题不仔细:没有注意到“仅”这个字。
审题不清晰:没有正确理解“仅”的含义,仅回答Ba(OH)2溶解、BaCO3不溶、Ba(OH)2溶解度大于BaCO3等。
“量”把握不够:没有考虑Ba(OH)2溶解度有限,配制1 M浓度时会有大量Ba(OH)2不溶解。
答题存在问题:
命题设计:试题期望考生按照提供的信息及实验条件 检验
步骤2中滤液加稀硫酸后产生白色沉淀检验Ba2+,然后在步骤4中用pH计测定滤液pH值,明显大于9.6,两者结合检验Ba(OH)2。
步骤3中沉淀加稀盐酸后产生气体、气体通入澄清石灰水变浑浊检验BaCO3。
第二问:检验Ba(OH)2与BaCO3混合物
绝大部分考生直接通过步骤2中产生白色沉淀检验Ba(OH)2,不用pH方法检验;
对于BaCO3的检验较多学生加入盐酸后产生气泡就直接检验BaCO3,而没有继续检验气体。
有不少考生错误的理解试题提供的信息,用pH=9.6的方法检验BaCO3。
实际情况:
据大概统计:100个考生中,90人不用pH方法,剩下10人中有8个用pH检验BaCO3,只剩下2个人用pH方法检验Ba(OH)2。
问题1:通过pH值方法检验离子或化合物不常用,陌生度较高,当有更好方法时考生没有考虑用pH方法,也没有作为一种辅助检验手段。
问题2:试题提供的信息具有一定迷惑性,因此部分考生在步骤4中用pH值法检验BaCO3。
情况统计及反映的问题:
Ba(OH)2的检验:
现象描述不完整:如部分考生漏写沉淀颜色。
实验结论不明确:如存在Ba2+、沉淀为BaSO4、存在Ba(OH)2或BaCO3、存在Ba(OH)2与BaCO3等表述。
化学基本素养差:部分考生描述现象为生成白色沉淀同时产生气泡、结论为存在BaCO3等。
存在的问题:
BaCO3的检验:
答题情况:得分较高。答对考生中大半以上采用盐酸+石灰水方案,其余采用盐酸方案,少部分在前面两种方案基础上在步骤4中辅之以pH值方法检验BaCO3。
实验方案逻辑性问题:如沉淀中加水或NaOH,产生气体来检验BaCO3,或者将澄清石灰水直接加入放有沉淀的试管或加入盐酸后的试管,利用其变浑浊来检验BaCO3,取步骤1滤液加盐酸产生气体检验BaCO3等。
现象描述不完整、不准确:如加入盐酸时只描述沉淀溶解现象,加入硫酸时 “沉淀先溶解,然后又产生沉淀”等。
存在的问题:
实验结论不明确:如存在CO32-、存在Ba(OH)2或BaCO3等。
答题完整性问题:只写出实验步骤与现象,但不给出结论;或者没有实验步骤,写出实验现象和结论。
化学基本素养差:在滤液中检验BaCO3,在沉淀中检验Ba(OH)2等。
科学性错误:如Ba2CO3、Ba(OH)等。
第三问:酸碱滴定部分
错别字严重:如“搞、伴、抹、融、容”,特别是搅拌的“拌”字较多考生写错。
描述不完整:只写溶解,或者只写搅拌。
描述不规范:如摇匀等。
错误操作:如振荡、过滤等。
第一空:“搅拌溶解”,得分较高。
错别字严重:特别是“溶量瓶、容易瓶”。
不规范的名称:如定容瓶、定量瓶等。
量器选择错误:如锥形瓶、烧杯等。
体积错误:极少数考生写成500 mL容量瓶等。
第二空:“250 mL容量瓶”,得分较高。
考察点:(1) 有效数字,(2) 滴定剂体积要控制在20-25 mL左右,因此滴定剂与被滴定剂浓度比应接近滴定反应量比(2:1),Ba(OH)2浓度为0.1 M,所以盐酸浓度要选择接近0.2 M、有效数字为4位、符合要求的0.1980 M。
核心:酸碱滴定实验中对误差的控制,体现在有效数字及滴定体积 滴定剂浓度上。
第三空:“0.1980”,得分低。
没有考虑从250 mL溶液中取25.00 mL用于滴定的10倍数量关系。
没有考虑盐酸与Ba(OH)2滴定反应的量比。
遗漏体积单位换算(mL-L)。
分子量漏算8个结晶水。
公式进行了运算。
有效数字问题。
可能由于时间问题,较多考生该空为空白。
第四空:“质量分数公式”,得分极低。
第四问:1 mol/L氢氧化钡溶液能否配制
答题情况:大概一半左右考生能够答对。
加强中学化学实验教学,让学生多动手,多做实验,让感性认识与理论知识充分互动。
提高学生“五性”修养,即:科学性、逻辑性、准确性、完整性、规范性。
增强实验教学中对“量”的理解、控制及运用。
重视酸碱滴定相关实验、计算及分析,掌握“误差”相关理论知识。
3. 中学化学实验教学建议
结束,谢谢!
2011年
广东省高考理科综合化学科
答题分析、评卷总结及教学建议
讲 座 提 纲
第30题(有机题)答题分析及总结
第31题(计算题)答题分析及总结
第32题(无机题)答题分析及总结
第33题(实验题)答题分析及总结
对中学化学相关教学的建议
第30题 (有机题) 答题分析及总结
交叉脱氢偶联反应:直接生成碳-碳单键!
化合物 I 可由以下合成路线获得:
1. 试题分析
(1) 化合物 1 的分子式为_______, 其完全水解的化学方程式为_____(注明条件)
第一空:C5H8O4,部分考生将元素符号顺序写错。
第二空:在碱性条件下完全水解。
2. 答题分析
正确解答:
错误解答:
错误解答:
在酸性条件下水解(不完全):
无酸、碱条件下水解:
(2) 化合物 II与足量的浓氢溴酸反应的化学方程式为_______(注明条件)。
错误解答:
(3) 化合物III没有酸性,其结构简式为___; III的一种同分异构体V能与饱和NaHCO3反应放出CO2. V的结构简式为____.
正确解答:
OHCCH2CHO
O=HCCH2CH=O
CH2(CHO)2
CHOCH2CHO
CH2=CH-COOH
错误解答:
HCO-CH2CHO
CHO-CH2CHO
HO-CCH2CHO
OHCCHCHO
2HC=CHCOOH
CH2=CH2COOH
CH2CCOOH
CH=CHCOOH
(4) 反应式中1个脱氢剂VI分子获得2个氢原子后,转变成1个芳香化合物,该芳香族化合物结构简式为_____.
错误解答
正确解答
(5) 1分子N,N-二甲基苯胺与1分子苯乙炔在一定条件下发生反应①的反应,其产物分子的结构简式为____; 1 mol该产物最多可与____mol H2发生加成反应。
错误解答
正确解答
规范:结构简式或结构式写法。
规范:化学键连接方式。
规范:有机化学方程式的写法。
规范:注意反应条件。
加强:信息迁移与推理能力的训练。
加强重点、难点教学:有机物结构、反应及性质;有机反应类型;官能团的相互转换。
3. 有机化学教学建议
第31题 (计算题) 答题分析及总结
难度适中,与2010年相比难度相当,但阅读量和计算量却增加很多。
得分情况:平均分:8.52。
1. 试题得分情况
参考答案:υⅢ>υⅡ>υⅠ,Ⅱ。大多考生正确;
部分考生书写不规范,如υ3>υ2>υ1,2等;
部分学生读图能力较差,不能理解平均反应速率的概念,没注意到限定时间为0-30小时内的平均速率,直接通过起点的斜率来读速率。
2. 答题分析
(1) 在0-30小时内,CH4的平均生产速率υⅢ、υⅡ、υⅠ从大到小的顺序为 ;反应开始后的12小时内,在第 种催化剂作用下,收集的CH4最多。
约一半考生能够准确理解化学反应过程中能量变化,并用图形表达出来。
有部分考生对反应基本原理理解不够,在画图过程中没有体现活化能峰。
(2) ① 在答题卡的坐标图中,画出反应过程中体系能量变化图(进行必要标注)
部分学生混淆吸热反应和放热反应(即:没有理解△H的正负号的含义)。
标注不规范、错误,如△H的单位写错,或△H写为E,或直接写成错误的数值等。
方法一:设CH4初始浓度为x mol·L-1
(2) ② 将等量物质的CH4和H2O充入1L恒容密闭反应器,某温度下反应达到平衡,平衡常数K=27,求CH4的平衡转化率(计算结果保留两位有效数字)
考生主要采用以下四种求解方法:
本小题大部分学生都可以按照转化率的计算格式来设未知数(初始或平衡时甲烷的浓度等);利用平衡常数公式代入数据进行计算;最后计算出甲烷的转化率。
方法二:设CH4平衡浓度为x mol·L-1
方法三:设CH4初始摩尔数为x mol
方法四:设CH4转化率为x
平衡表达式写错,主要是在平衡表达式中漏掉H2O的平衡浓度。
物质间量的关系对应错误、写错关系式。
计算错误:方法一、三中,求解出x=0.20,甚至计算0.1/0.11得0.09、0.99、0.0909等错误结果。
粗心大意:方程式抄错、漏掉3次方或3次方写为2次方、0.10写成0.2或0.01等。
有效数字错误。
书写不规范:不标注初始或平衡浓度。
审题不仔细:将甲烷初始的摩尔数设为1。
热化学方程式的书写部分,部分考生不会写或没时间写,做了的考生正确率较高。
主要错误:忘记物质状态,方程式没有配平,几个方程式相加错误等。
(3) 已知,CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ/mol,写出CO2生产CO的热反应方程式。
规范:方程式书写,单位表示,文字表达,画图(标注、坐标轴名称及单位、线型、曲线变化趋势及定位等),有效数字。
准确:计算要准确,单位换算要无误,物质间量的关系要清楚。
重点掌握原理概念:反应速率、平衡常数、转化率等原理概念要清晰、明确,计算公式才不会出问题。
3. 计算题教学建议
第32题 (无机题) 答题分析及总结
32题是一道工艺题,大部分考生对工业流程图不熟,难以短时间内对整个熔盐电离铝工艺流程有正确的理解,导致得分偏低。
中学化学教学中涉及络合物的内容较少,能正确写对铝电极的主要电极反应式的学生极少。
1. 得分总体情况
典型错误:反应物、生成物不正确;方程式没有配平。
2. 答题分析及总结
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的物质。相关的化学方程式为① 和② 。
8Al + 3Fe3O4 = 9Fe + 4Al2O3
Al + Fe2O3 = Fe + Al2O3
3Na2SiO3 + 2Al =Al2(SiO3)3 + 6Na
分析:考生对氧化铁和石英砂的概念不清。如将氧化铁写成FeO或Fe3O4;将石英砂写成Na2SiO3。
参考答案:HCl, AlCl3; NaCl
典型错误:普遍存在漏填,错填和多填现象。
(2) 将Cl2连续通入坩埚中的粗铝熔体,杂质也随气泡上浮除去,气泡的主要成分除Cl2外还含有 ;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
H2, HCl; NaCl H2; NaCl
HCl; AlCl3 H2; AlCl3
分析:审题不清,没有注意到题目给出的条件:AlCl3在180 ℃升华,NaCl的熔点为801℃;所以在反应条件700 ℃条件下,尾气中应有AlCl3,而浮渣中应包含NaCl。
参考答案:Cl2+2OH-=Cl- + ClO- + H2O; H+ + OH- = H2O
典型错误:反应物、生成物不正确;只写化学方程式;离子方程式没有正确配平。
(3) 在用废碱液处理气体A的过程中,所发生的离子方程式为 。
Cl2 + 2OH- = Cl- + ClO-
Cl2 + 2NaOH = NaCl + NaClO + H2O
HCl + OH- = H2O + Cl-
分析:大部分学生能想到尾气中多余的氯气会与废碱液反应,但较少学生能想到粗铝含的氢气会与氯气反应形成氯化氢,所以较少学生能写出H+ + OH- = H2O方程式。
参考答案:阳 Al - 3e- + 7AlCl4- = 4Al2Cl7-
典型错误:第一空较多考生填写:正极。绝大部分考生在第二空(铝电极的主要电极反应式)没有写对。
(4) 镀铝电解池中,金属铝为 极,熔融盐电解液中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电极的主要电极反应式为 。
Al - 3e- + 4Cl- = AlCl4- Al - 6e- + 7Cl- = Al2Cl7-
Al - 3e- = Al3+ AlCl4- - 3e- = Al2Cl7-
分析:原电池与电解池的区别不清晰。原电池中电极分为正极和负极,而电解池中电极分为阳极和阴极。
参考答案:致密的的氧化膜能隔绝钢材与空气中的O2、CO2、H2O等接触,使电化学腐蚀和化学腐蚀不能发生。
典型错误:没正确解释氧化铝能防止钢材腐蚀的原因,没有回答到点子上。
(5) 钢材镀铝后,表面形成的致密氧化膜能防止钢材腐蚀,其原因是 。
分析:正确理解致密氧化铝膜的作用:① 氧化铝薄膜化学性质稳定,不与空气中O2、CO2 和 H2O 等反应;② 致密氧化铝薄膜可隔绝钢材与空气中O2、CO2 和 H2O 等接触。
镀铝后,钢材相当于原电池,铝作阳极保护钢材。
氧化铝与钢铁构成原电池,有利于防止钢材腐蚀。
氧化铝膜不与酸、碱反应。
氧化铝不发生化学反应。
致密的氧化铝隔绝了空气,使其不与铝发生反应。
氧化铝稳定,熔点、沸点高。
铝较活泼易被空气中的氧气氧化。
错误解答:
第33题 (实验题) 答题分析及总结
平均分:8.3;标准差:4.7。
给分分布情况:
1. 答题情况统计
答题情况:给分点1基本能拿到2分,给分点2得分的考生很少。
2. 考生答题分析
第一问:所剩不溶物仅为BaCO3的原因
表述不够严谨:如Ba2+与CO2反应、 Ba2+与CO32-反应、Ba(OH)2与H2CO3反应等,没有考虑试题提供的环境(空气中)。
表述不够准确:如Ba(OH)2吸收CO2、Ba(OH)2变质、Ba(OH)2与空气反应等。
科学性错误:如Ba2CO3、列出化学方程式反应物或产物错误、Ba(OH)2被CO2氧化、Ba(OH)2与O2反应生成BaCO3等。
逻辑性问题:部分学生仅从溶解度角度分析BaCO3不溶的原因,而没有考虑BaCO3是怎么来的,为什么未溶物全部都是BaCO3。
答题存在的问题:
Ba(OH)2与CO2全部反应。
大部分Ba(OH)2与CO2反应(剩余少量溶解)。
空气中SO2含量低,不与Ba(OH)2反应生成不溶BaSO3。
较佳解答:
大部分考生没有结合试题提供的溶解度信息来考虑 “ 仅 ” 这一个非常重要的限定词,因此这一点丢分很严重。
阅题不仔细:没有注意到“仅”这个字。
审题不清晰:没有正确理解“仅”的含义,仅回答Ba(OH)2溶解、BaCO3不溶、Ba(OH)2溶解度大于BaCO3等。
“量”把握不够:没有考虑Ba(OH)2溶解度有限,配制1 M浓度时会有大量Ba(OH)2不溶解。
答题存在问题:
命题设计:试题期望考生按照提供的信息及实验条件 检验
步骤2中滤液加稀硫酸后产生白色沉淀检验Ba2+,然后在步骤4中用pH计测定滤液pH值,明显大于9.6,两者结合检验Ba(OH)2。
步骤3中沉淀加稀盐酸后产生气体、气体通入澄清石灰水变浑浊检验BaCO3。
第二问:检验Ba(OH)2与BaCO3混合物
绝大部分考生直接通过步骤2中产生白色沉淀检验Ba(OH)2,不用pH方法检验;
对于BaCO3的检验较多学生加入盐酸后产生气泡就直接检验BaCO3,而没有继续检验气体。
有不少考生错误的理解试题提供的信息,用pH=9.6的方法检验BaCO3。
实际情况:
据大概统计:100个考生中,90人不用pH方法,剩下10人中有8个用pH检验BaCO3,只剩下2个人用pH方法检验Ba(OH)2。
问题1:通过pH值方法检验离子或化合物不常用,陌生度较高,当有更好方法时考生没有考虑用pH方法,也没有作为一种辅助检验手段。
问题2:试题提供的信息具有一定迷惑性,因此部分考生在步骤4中用pH值法检验BaCO3。
情况统计及反映的问题:
Ba(OH)2的检验:
现象描述不完整:如部分考生漏写沉淀颜色。
实验结论不明确:如存在Ba2+、沉淀为BaSO4、存在Ba(OH)2或BaCO3、存在Ba(OH)2与BaCO3等表述。
化学基本素养差:部分考生描述现象为生成白色沉淀同时产生气泡、结论为存在BaCO3等。
存在的问题:
BaCO3的检验:
答题情况:得分较高。答对考生中大半以上采用盐酸+石灰水方案,其余采用盐酸方案,少部分在前面两种方案基础上在步骤4中辅之以pH值方法检验BaCO3。
实验方案逻辑性问题:如沉淀中加水或NaOH,产生气体来检验BaCO3,或者将澄清石灰水直接加入放有沉淀的试管或加入盐酸后的试管,利用其变浑浊来检验BaCO3,取步骤1滤液加盐酸产生气体检验BaCO3等。
现象描述不完整、不准确:如加入盐酸时只描述沉淀溶解现象,加入硫酸时 “沉淀先溶解,然后又产生沉淀”等。
存在的问题:
实验结论不明确:如存在CO32-、存在Ba(OH)2或BaCO3等。
答题完整性问题:只写出实验步骤与现象,但不给出结论;或者没有实验步骤,写出实验现象和结论。
化学基本素养差:在滤液中检验BaCO3,在沉淀中检验Ba(OH)2等。
科学性错误:如Ba2CO3、Ba(OH)等。
第三问:酸碱滴定部分
错别字严重:如“搞、伴、抹、融、容”,特别是搅拌的“拌”字较多考生写错。
描述不完整:只写溶解,或者只写搅拌。
描述不规范:如摇匀等。
错误操作:如振荡、过滤等。
第一空:“搅拌溶解”,得分较高。
错别字严重:特别是“溶量瓶、容易瓶”。
不规范的名称:如定容瓶、定量瓶等。
量器选择错误:如锥形瓶、烧杯等。
体积错误:极少数考生写成500 mL容量瓶等。
第二空:“250 mL容量瓶”,得分较高。
考察点:(1) 有效数字,(2) 滴定剂体积要控制在20-25 mL左右,因此滴定剂与被滴定剂浓度比应接近滴定反应量比(2:1),Ba(OH)2浓度为0.1 M,所以盐酸浓度要选择接近0.2 M、有效数字为4位、符合要求的0.1980 M。
核心:酸碱滴定实验中对误差的控制,体现在有效数字及滴定体积 滴定剂浓度上。
第三空:“0.1980”,得分低。
没有考虑从250 mL溶液中取25.00 mL用于滴定的10倍数量关系。
没有考虑盐酸与Ba(OH)2滴定反应的量比。
遗漏体积单位换算(mL-L)。
分子量漏算8个结晶水。
公式进行了运算。
有效数字问题。
可能由于时间问题,较多考生该空为空白。
第四空:“质量分数公式”,得分极低。
第四问:1 mol/L氢氧化钡溶液能否配制
答题情况:大概一半左右考生能够答对。
加强中学化学实验教学,让学生多动手,多做实验,让感性认识与理论知识充分互动。
提高学生“五性”修养,即:科学性、逻辑性、准确性、完整性、规范性。
增强实验教学中对“量”的理解、控制及运用。
重视酸碱滴定相关实验、计算及分析,掌握“误差”相关理论知识。
3. 中学化学实验教学建议
结束,谢谢!
同课章节目录
