沪教课标版九年级化学上册 3.2溶液(24张ppt)
文档属性
| 名称 | 沪教课标版九年级化学上册 3.2溶液(24张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-06 00:00:00 | ||
图片预览








文档简介
溶液
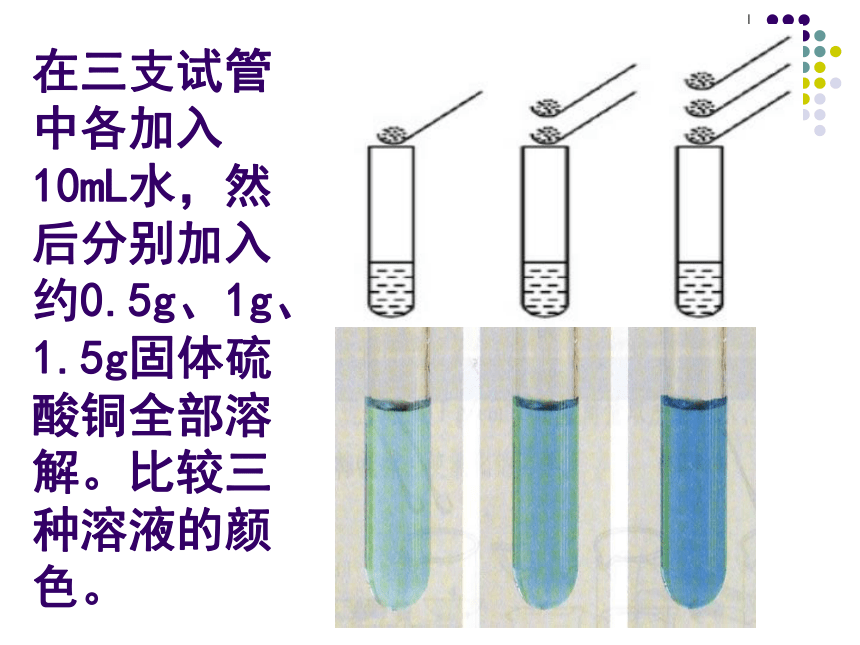
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜全部溶解。比较三种溶液的颜色。
1、医疗上给病人输入的葡萄糖
2、农业上施用的农药
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.
一、溶液的组成:
溶液由 组成
M溶液 =
溶质和溶剂
m溶质+m溶剂
溶质的质量
溶剂的质量
溶液的质量
浓度
分成三等份
加水
加入溶质
蒸发少量水
减少
减少
减少
不变
不变
增加
增加
变稀
增加
不变
增加
变浓
不变
变浓
加水
加硫酸铜
减少
减少
有一不饱和的硫酸铜溶液,按要求填空
二、溶质的质量分数
(表示溶液浓度)
溶质质量与全部溶液质量的比值。
溶质质量的质量分数=
溶质的质量
溶液的质量
注意几点:
(1)溶质质量是指已经溶解的质量,不一定等于加入的物质的质量。
(2)溶质的质量分数是一个比值,无单位。
(3)溶质的质量分数越大,表示一定量溶液中所含溶质质量越多,溶液越浓;相反,则表示一定量溶液中所含溶质质量越少,溶液越稀。
1、质量百分比浓度
定义:用溶质的质量占全部溶液质量百分比来表示的(简称百分比浓度,符号C?)
表示在100份质量的氯化钠溶液中含1份质量氯化钠
思考:1?的氯化钠溶液表示什么意义?
三、有关溶质质量分数的计算
10g
10g+90g
×100%
20g
20g+80g
×100%
=10%
=20%
例1
2、数学表达式:
讨论完成下列表格
溶液
溶质质量
溶剂质量
溶液质量
百分比浓度
1
4克
100克
2
180克
200克
3
300克
6%
4
240克
20%
96克
4%
20克
10%
18克
300克
60克
282克
公式变换:
练习
1、蒸干25克氯化钠溶液得到
5克氯化钠,计算该溶液的溶
质质量分数。
解:
C%=
5
25
×100%=20%
答:食盐溶液的溶质质量分数是20%。
练习
2、配制80克20%的硝酸钾溶液,
需硝酸钾和水各多少克?
解: m(硝酸钾)=80×20%=16(克)
m(水)=80-16=64(克)
答:配制80克20%的硝酸钾溶液需硝酸钾16克
和水64克。
3、在80克15%的硝酸钠溶液里
(1)加入20克水;
(2)加入20克硝酸钠;
(3)蒸发20克水
分别计算溶液的百分比浓度?
解(1):
(2):
(3):
若要使某溶液浓度增大或减小通常可采取什么方法?
1、增加溶质
2、增加溶剂
3、蒸发溶剂
配制过程:
例1: 配制50克5%的食盐水
计算:氯化钠的质量=50 × 5% = 2.5 (克)
水的质量=50 – 2.5 = 47.5 (克)水
称量:用天平称 2.5 克食盐 用量筒量47.5毫升水
溶解:将氯化钠放入烧杯中,加入水,搅拌溶解。
四、溶 液 的 配 制
A、计算
B、称量
C、溶解
配制操作流程图
配制的主要步骤,仪器:
计算
称量
溶解
烧杯、玻璃棒
称:
量:
你学会归纳整理了吗?
托盘天平、药匙
量筒、胶头滴管
在实际操作中可能会出现哪些错误、以及会造成的后果?
1、计算时错误;
2、称量时操作错误
3、溶解时的错误
思考:
一、溶液的组成:
小结:
溶液由 组成
溶质和溶剂
m液 =
m质+m剂
三、溶液的配制步骤
A、计算
B、称量
C、溶解
二、有关c%的计算
求以下蔗糖溶液中溶质的质量分数:
(1)、将30克蔗糖完全溶于120克水中;
(2)、将上述溶液平均分为三杯;
(3)、在一杯溶液中加入10克水;
(4)、向另一杯溶液中加入10克蔗糖且完全溶解;
(5)、将第三杯溶液蒸发掉10克水(无晶体析出);
(6)、若将(1)所得溶液中溶质的质量分数变为
原来一半,需加水多少克?
回家作业:
判断下列说法是否正确,并加以改正。
⑴在100克水中溶解30克食盐,溶质质量分数是
30%
⑵从100克10%的食盐溶液里取出10克,其浓度
是10%
⑶将100克10%的食盐溶液和100克10%的食盐溶
液混合,混合溶液的浓度是20%
⑷ 20℃时,100克水中最多溶解36克食盐,它的
溶解度是36克/100克水,浓度是36%
( × )
( √ )
( × )
( × )
在三支试管中各加入10mL水,然后分别加入约0.5g、1g、1.5g固体硫酸铜全部溶解。比较三种溶液的颜色。
1、医疗上给病人输入的葡萄糖
2、农业上施用的农药
飞机喷洒农药
喷洒药水
药液太稀不能杀死害虫和病菌,但药液太浓又会毒害农作物或树木.
一、溶液的组成:
溶液由 组成
M溶液 =
溶质和溶剂
m溶质+m溶剂
溶质的质量
溶剂的质量
溶液的质量
浓度
分成三等份
加水
加入溶质
蒸发少量水
减少
减少
减少
不变
不变
增加
增加
变稀
增加
不变
增加
变浓
不变
变浓
加水
加硫酸铜
减少
减少
有一不饱和的硫酸铜溶液,按要求填空
二、溶质的质量分数
(表示溶液浓度)
溶质质量与全部溶液质量的比值。
溶质质量的质量分数=
溶质的质量
溶液的质量
注意几点:
(1)溶质质量是指已经溶解的质量,不一定等于加入的物质的质量。
(2)溶质的质量分数是一个比值,无单位。
(3)溶质的质量分数越大,表示一定量溶液中所含溶质质量越多,溶液越浓;相反,则表示一定量溶液中所含溶质质量越少,溶液越稀。
1、质量百分比浓度
定义:用溶质的质量占全部溶液质量百分比来表示的(简称百分比浓度,符号C?)
表示在100份质量的氯化钠溶液中含1份质量氯化钠
思考:1?的氯化钠溶液表示什么意义?
三、有关溶质质量分数的计算
10g
10g+90g
×100%
20g
20g+80g
×100%
=10%
=20%
例1
2、数学表达式:
讨论完成下列表格
溶液
溶质质量
溶剂质量
溶液质量
百分比浓度
1
4克
100克
2
180克
200克
3
300克
6%
4
240克
20%
96克
4%
20克
10%
18克
300克
60克
282克
公式变换:
练习
1、蒸干25克氯化钠溶液得到
5克氯化钠,计算该溶液的溶
质质量分数。
解:
C%=
5
25
×100%=20%
答:食盐溶液的溶质质量分数是20%。
练习
2、配制80克20%的硝酸钾溶液,
需硝酸钾和水各多少克?
解: m(硝酸钾)=80×20%=16(克)
m(水)=80-16=64(克)
答:配制80克20%的硝酸钾溶液需硝酸钾16克
和水64克。
3、在80克15%的硝酸钠溶液里
(1)加入20克水;
(2)加入20克硝酸钠;
(3)蒸发20克水
分别计算溶液的百分比浓度?
解(1):
(2):
(3):
若要使某溶液浓度增大或减小通常可采取什么方法?
1、增加溶质
2、增加溶剂
3、蒸发溶剂
配制过程:
例1: 配制50克5%的食盐水
计算:氯化钠的质量=50 × 5% = 2.5 (克)
水的质量=50 – 2.5 = 47.5 (克)水
称量:用天平称 2.5 克食盐 用量筒量47.5毫升水
溶解:将氯化钠放入烧杯中,加入水,搅拌溶解。
四、溶 液 的 配 制
A、计算
B、称量
C、溶解
配制操作流程图
配制的主要步骤,仪器:
计算
称量
溶解
烧杯、玻璃棒
称:
量:
你学会归纳整理了吗?
托盘天平、药匙
量筒、胶头滴管
在实际操作中可能会出现哪些错误、以及会造成的后果?
1、计算时错误;
2、称量时操作错误
3、溶解时的错误
思考:
一、溶液的组成:
小结:
溶液由 组成
溶质和溶剂
m液 =
m质+m剂
三、溶液的配制步骤
A、计算
B、称量
C、溶解
二、有关c%的计算
求以下蔗糖溶液中溶质的质量分数:
(1)、将30克蔗糖完全溶于120克水中;
(2)、将上述溶液平均分为三杯;
(3)、在一杯溶液中加入10克水;
(4)、向另一杯溶液中加入10克蔗糖且完全溶解;
(5)、将第三杯溶液蒸发掉10克水(无晶体析出);
(6)、若将(1)所得溶液中溶质的质量分数变为
原来一半,需加水多少克?
回家作业:
判断下列说法是否正确,并加以改正。
⑴在100克水中溶解30克食盐,溶质质量分数是
30%
⑵从100克10%的食盐溶液里取出10克,其浓度
是10%
⑶将100克10%的食盐溶液和100克10%的食盐溶
液混合,混合溶液的浓度是20%
⑷ 20℃时,100克水中最多溶解36克食盐,它的
溶解度是36克/100克水,浓度是36%
( × )
( √ )
( × )
( × )
