鲁科版化学选修四第1章《化学反应与能量转化》测试题
文档属性
| 名称 | 鲁科版化学选修四第1章《化学反应与能量转化》测试题 |

|
|
| 格式 | docx | ||
| 文件大小 | 511.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-07 21:25:14 | ||
图片预览




文档简介
第1章《化学反应与能量转化》测试题
一、单选题
1.下列关于金属冶炼的说法不正确的是(
)
A.金属冶炼的方法选择是由金属的活泼性决定的
B.工业上常用电解熔融氯化物的方法来冶炼钠、镁、铝
C.热还原法冶炼金属常用的还原剂有焦炭、一氧化碳和氢气
D.金属冶炼的本质是找到合适的还原剂(或还原手段)将金属属从其化合物中还原出来
2.下列说法正确的是(
)
A.化学键断裂一定要吸收能量
B.吸热反应一定需加热才能发生
C.有能量变化的一定是化学反应
D.活化分子间的碰撞一定是有效碰撞
3.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如。下列说法错误的是
A.NH3在电极a极上失去电子,发生氧化反应
B.溶液中K+向电极b移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.正极的电极反应式为O2+4e-+2H2O=4OH-
4.完全燃烧mg液态乙醇得到液态水时放出的热量为akJ,经测定mg乙醇与Na反应时最多可生成0.5gH2,则液态乙醇完全燃烧的热化学方程式为(
)
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
?H=-akJ·mol-1
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
?H=+akJ·mol-1
C.C2H5OH(l)+O2(g)=CO2(g)+H2O(l)
?H=+akJ·mol-1
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
?H=-2akJ·mol-1
5.下列与金属腐蚀有关的说法正确的是(
)
A.图①中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.在③开关闭合的情况下,四个装置的铁腐蚀速率由快到慢的顺序是:④③①②
C.图③中,开关闭合时,Fe的腐蚀速率减小
D.图②和④的装置中Fe电极均被保护
6.普通水泥在固化过程中自由水分子减少,并且溶液呈碱性,根据这一物理化学特点,科学家发明了利用原电池原理测定水泥初凝时间,此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,下列有关说法错误的是(
)
A.Ag2O/Ag电极为正极
B.Cu电极为负极
C.电池工作时,OH-向Ag2O/Ag电极移动
D.电池工作时,有1molCu2O生成时,电路中有2mol电子通过
7.如图是铜锌原电池,下列说法正确的是
A.电流从锌片流出经电流表到铜片
B.锌电极发生还原反应
C.铜片上发生氧化反应
D.电解质溶液中的阴离子向负极移动
8.若用如图所示实验装置则可制得白色纯净的氢氧化亚铁沉淀,两极材料分别为石墨和铁。下列关于该实验的说法正确的是(
)
A.a电极材料为石墨,b电极材料为铁
B.a电极为负极,其反应式为:Fe-3e-=Fe3+
C.若白色沉淀在电极周围生成,则d是氯化钠溶液
D.液体c为苯,其作用是隔绝空气,防止白色沉淀被氧化
9.用惰性电极电解物质的量浓度相同、体积比为1:1的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O2Cu+4H++O2↑②Cu2++2Cl-Cu+Cl2↑
③2Cl-+2H2OH2↑+Cl2↑+2OH-④2H2O2H2↑+O2↑
A.①②③
B.①②④
C.②③④
D.②④
10.某蓄电池放电充电时反应为,下列推断不正确的是
A.放电时,负极的电极反应式是
B.放电时,每转移电子,正极上有被氧化
C.充电时,阳极的电极反应式是
D.该蓄电池的电极可浸在某种碱性电解质溶液中
11.近日,中国第36次南极科学考察队暨“雪龙2”号从深圳启航,前往南极执行科考任务。下列说法正确的是(
)
A.外壳镶嵌一些铅块等可提高科考船的抗腐蚀能力
B.利用牺牲阳极的阴极保护法保护船体,正极反应式为O2-4e-+2H2O=4OH-
C.停靠期间可以采用外加电流的阴极保护法,电源负极与船体相连接
D.科考船只能采用电化学保护法提高其抗腐蚀能力
12.下列有关原电池的说法中,正确的是
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.在原电池中,负极总会溶解进入溶液导致质量减小
D.在原电池中,正极材料本身都不会得电子
13.锂-空气电池是一种可充放电池,电池反应为2Li+O2=Li2O2,某锂-空气电池的构造原理图如图。下列说法正确的是
A.可选用有机电解液或水性电解液
B.含催化剂的多孔电极为电池的负极
C.放电时负极的电极反应式为Li-e-=Li+
D.充电时锂电极应连接外接电源的正极
14.相同材质的铁在下图中的四种情况下腐蚀最快的是
A.
B.
C.
D.
15.下列关于图所示的四个实验装置的说法正确的是(
)
A.装置甲能防止铁钉生锈
B.装置乙为电镀铜装置
C.装置丙中阳离子交换膜能避免氯气与碱反应,且b端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D.装置丁能测定中和反应的反应热
二、填空题
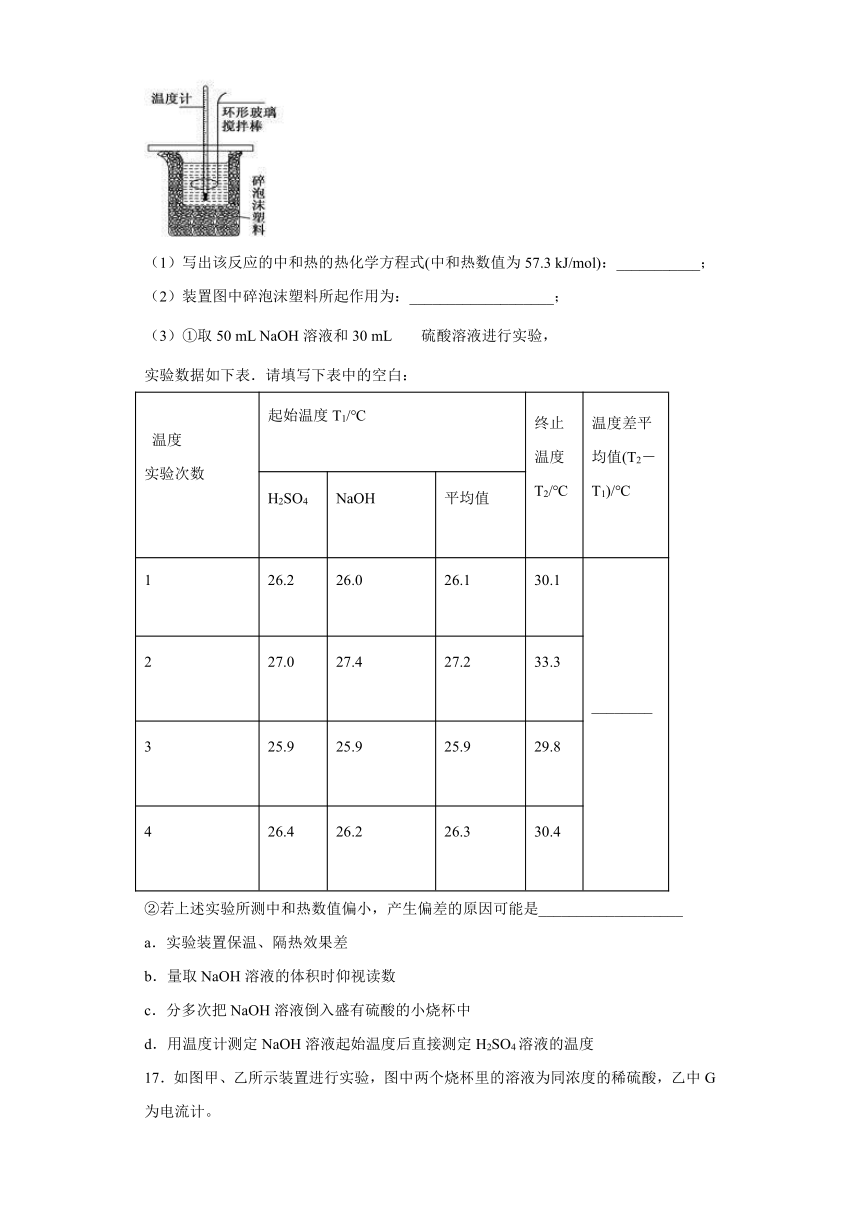
16.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的中和热的热化学方程式(中和热数值为57.3
kJ/mol):___________;
(2)装置图中碎泡沫塑料所起作用为:___________________;
(3)①取50
mL
NaOH溶液和30
mL硫酸溶液进行实验,
实验数据如下表.请填写下表中的空白:
温度
实验次数
起始温度T1/℃
终止温度T2/℃
温度差平均值(T2-T1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
________
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②若上述实验所测中和热数值偏小,产生偏差的原因可能是___________________
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
17.如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。
请回答下列问题。
(1)以下叙述中,正确的是______。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
(2)若反应过程中有发生转移,则生成氢气在状况下的体积为______。
(3)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是______。
A.
B.
C.
D.
18.84消毒液等含氯消毒剂等可有效灭活新型冠状病毒。了解这些消毒剂的制备原理、性质十分重要。
试回答下列问题:
(1)取少量84消毒液于试管中,滴几滴酚酞试液,溶液先变红后褪色,其主要原因是_______(用离子方程式表示)。
(2)采用如图所示的简易装置可以在家中制备84消毒液。a为电源______极,制备84消毒液的总反应的化学方程式为_______。
(3)盛装84消毒液宜选择塑料容器,不宜用铁器,其主要原因是________(答2条即可)。
19.某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是石墨电极。当将电源接通后,向乙中滴入酚酞试液,发现在F极附近溶液显红色。按要求回答下列问题:
(1)电极F的名称是______,电源B极的名称是______。
(2)甲装置中D电极的电极反应式是________________。
(3)乙装置中电解反应的总化学方程式_______________________。
(4)欲使丙装置发生:2Ag+2HCl=2AgCl+H2↑反应,则G电极的材料应是____(填化学式)
(5)丁装置中装有Fe(OH)3胶体,一段时间后胶体颜色变深的电极是:__________(填字母)
20.(1)甲醇属于可再生资源,能够代替汽油作为汽车的燃料。一定量的甲醇与足量的金属反应得到标准状况下的,若将这些甲醇完全燃烧生成二氧化碳气体和液态水,放出热量,则甲醇的摩尔燃烧焓为______。
(2)家用液化气的主要成分之一是丁烷,当丁烷完全燃烧生成二氧化碳气体和液态水时,放出热量。根据上述信息写出表示丁烷摩尔燃烧焓的热化学方程式:____________________。
三、推断题
21.Ⅰ.下表是元素周期表的一部分,
回答下列问题:
a
b
c
d
e
f
g
h
i
(1)d、e、f对应简单离子的半径由大到小的顺序为_______(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;写出a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式_________。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式_________。
Ⅱ.
(1)根据下列信息判断氢气燃烧生成水时的热量变化:
①H2(g)与O2(g)反应生成1molH2O(g)时放出的热量为________kJ;
②图中甲、乙、丙中物质所具有的总能量由大到小顺序为:________;
(2)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s)
+
PbO2(s)
+
2H2SO4(aq)
=
2PbSO4(s)
+
2H2O。负极反应式为__________,一段时间后,负极增重48克,转移电子_______mol。
22.A、B、C、D、E、F为中学化学常见的单质或化合物,其中A为淡黄色固体单质,B为气体,E的浓溶液能使铁、铝钝化,F为非金属单质。其转化关系如图所示(条件已略去)。
完成下列问题:
(1)写出E转化为C的化学方程式________________________。
(2)物质B电子式为________。实验室制取少量B时,可用其对应的盐与稀硫酸加热反应,不能选用浓硫酸制取的原因是________________________。
(3)空气中含有少量B时,能使银器表面失去金属光泽、逐渐变黑,将变黑的银器放入装满食盐水的铝盆中,二者直接接触,银器恢复往日光泽试写出银器恢复光亮的反应________________________________。
(4)设计实验证明C具有氧化性(实验方法及现象)________________________。
四、实验题
23.50mL
0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_________。
(2)烧杯间填满碎纸条的作用是_______
。
(3)若大烧杯上不盖硬纸板,求得的中和热?H_______(填“偏大”“偏小”或“无影响”)。
(4)若实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热
________(填“相等”或“不相等”),简述理由:________
24.原电池及原理已广泛应用于生产生活中。
(1)事实证明,能设计成原电池的反应通常是放热反应。下列化学反应中在理论上可以设计成原电池的是_______(填序号)。
a.C(s)+H2O(g)=CO(g)+H2(g)
ΔH>0
b.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH<0
c.Ba(OH)2(aq)
+
H2SO4(aq)=BaSO4(s)+2H2O(l)
ΔH<0
(2)某同学利用生活或实验室中常用的物品,设计了一个原电池,如图所示。实验原理:Fe+2=+H2↑
实验用品:电极(铁钉、铜钉)、稀硫酸、烧杯、导线、耳机(或电流表)。
①用原电池两个电极中的一极触碰耳机插头上的一极(注意:触碰的同时耳机的另一极是跟原电池的另一极相连的),这时,可以听见耳机发出“嚓嚓嚓……”的声音。其原因是在原电池中,将化学能转化为________,在耳机中又将电能转化为声音这种能量。
②如果将装置中的耳机改为电流表,则铁钉应连接电流表的________极,其电极反应式为________;铜钉上的电极反应式为________,该电极上发生了________(填“氧化”或“还原”)反应。
③反应结束后,测得铁钉质量减轻了
2.8
克,则转移电子的物质的量为______。
五、计算题
25.如图为相互串联的甲、乙两电解池.试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是______、______(填电极材料和电极名称),电极反应式为
______;应选用的电解质溶液是
______。
(2)乙池中滴入少量酚酞试液,电解一段时间后,铁极附近呈______色。C
极生成的物质为
______色。
(3)一段时间后若甲池阴极增重
4.32g,则乙槽中放出的气体在
标准状况下的体积是
______mL。
26.已知下列热化学方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)
△H1=-25kJ?mol-1;
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)
△H2=-47kJ?mol-1;
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
△H3=+19kJ?mol-1.
写出FeO(s)被CO还原成Fe和CO2的热化学方程式__。
参考答案
1.B
2.A
3.C
4.D
5.B
6.C
7.D
8.D
9.B
10.B
11.C
12.B
13.C
14.A
15.D
16.H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l)
ΔH=-57.3
kJ/mol
保温、隔热,防止热量损失
4.0
a、c、d
17.CD
C
18.
负
具有强氧化性,易腐蚀铁器;是电解质,铁器易发生吸氧腐蚀(合理即可)
19.阴极
负极
Cu2++2e-=Cu2+
2NaCl+2H2O2NaOH+H2↑+Cl2↑
Ag
Y
20.
21.O2->F->Na+
N2H4
H2-2e-+2OH-=2H2O
245
乙>甲>丙
Pb
+-2e-=
PbSO4
1
22.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
浓硫酸具有强氧化性,能氧化具有还原性的硫化氢,而得不到H2S气体
2Al+3Ag2S+6H2O=2Al(OH)3↓+6Ag+3H2S↑
将SO2通入到盛有H2S溶液的试管中,生成淡黄色的沉淀
23.环形玻璃搅拌棒
减小热量的散失
偏大
不相等
相等
因为酸、碱发生中和反应放出的热量与酸、碱的用量有关,而中和热是指酸跟碱发生中和反应生成1mol水所放出的热量,它与酸、碱的用量无关
24.b
电能
负
Fe-2e-=Fe2+
2H++2e-=H2↑
还原
0.1
mol
25.铁
阴极
Ag+
+
e-
=
Ag
AgNO3
溶液
红
浅黄绿色
896
26.CO(g)+FeO(s)=Fe(s)+CO2(g)
△H=-11kJ/mol
一、单选题
1.下列关于金属冶炼的说法不正确的是(
)
A.金属冶炼的方法选择是由金属的活泼性决定的
B.工业上常用电解熔融氯化物的方法来冶炼钠、镁、铝
C.热还原法冶炼金属常用的还原剂有焦炭、一氧化碳和氢气
D.金属冶炼的本质是找到合适的还原剂(或还原手段)将金属属从其化合物中还原出来
2.下列说法正确的是(
)
A.化学键断裂一定要吸收能量
B.吸热反应一定需加热才能发生
C.有能量变化的一定是化学反应
D.活化分子间的碰撞一定是有效碰撞
3.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如。下列说法错误的是
A.NH3在电极a极上失去电子,发生氧化反应
B.溶液中K+向电极b移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.正极的电极反应式为O2+4e-+2H2O=4OH-
4.完全燃烧mg液态乙醇得到液态水时放出的热量为akJ,经测定mg乙醇与Na反应时最多可生成0.5gH2,则液态乙醇完全燃烧的热化学方程式为(
)
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
?H=-akJ·mol-1
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
?H=+akJ·mol-1
C.C2H5OH(l)+O2(g)=CO2(g)+H2O(l)
?H=+akJ·mol-1
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
?H=-2akJ·mol-1
5.下列与金属腐蚀有关的说法正确的是(
)
A.图①中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.在③开关闭合的情况下,四个装置的铁腐蚀速率由快到慢的顺序是:④③①②
C.图③中,开关闭合时,Fe的腐蚀速率减小
D.图②和④的装置中Fe电极均被保护
6.普通水泥在固化过程中自由水分子减少,并且溶液呈碱性,根据这一物理化学特点,科学家发明了利用原电池原理测定水泥初凝时间,此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag,下列有关说法错误的是(
)
A.Ag2O/Ag电极为正极
B.Cu电极为负极
C.电池工作时,OH-向Ag2O/Ag电极移动
D.电池工作时,有1molCu2O生成时,电路中有2mol电子通过
7.如图是铜锌原电池,下列说法正确的是
A.电流从锌片流出经电流表到铜片
B.锌电极发生还原反应
C.铜片上发生氧化反应
D.电解质溶液中的阴离子向负极移动
8.若用如图所示实验装置则可制得白色纯净的氢氧化亚铁沉淀,两极材料分别为石墨和铁。下列关于该实验的说法正确的是(
)
A.a电极材料为石墨,b电极材料为铁
B.a电极为负极,其反应式为:Fe-3e-=Fe3+
C.若白色沉淀在电极周围生成,则d是氯化钠溶液
D.液体c为苯,其作用是隔绝空气,防止白色沉淀被氧化
9.用惰性电极电解物质的量浓度相同、体积比为1:1的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O2Cu+4H++O2↑②Cu2++2Cl-Cu+Cl2↑
③2Cl-+2H2OH2↑+Cl2↑+2OH-④2H2O2H2↑+O2↑
A.①②③
B.①②④
C.②③④
D.②④
10.某蓄电池放电充电时反应为,下列推断不正确的是
A.放电时,负极的电极反应式是
B.放电时,每转移电子,正极上有被氧化
C.充电时,阳极的电极反应式是
D.该蓄电池的电极可浸在某种碱性电解质溶液中
11.近日,中国第36次南极科学考察队暨“雪龙2”号从深圳启航,前往南极执行科考任务。下列说法正确的是(
)
A.外壳镶嵌一些铅块等可提高科考船的抗腐蚀能力
B.利用牺牲阳极的阴极保护法保护船体,正极反应式为O2-4e-+2H2O=4OH-
C.停靠期间可以采用外加电流的阴极保护法,电源负极与船体相连接
D.科考船只能采用电化学保护法提高其抗腐蚀能力
12.下列有关原电池的说法中,正确的是
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.在原电池中,负极总会溶解进入溶液导致质量减小
D.在原电池中,正极材料本身都不会得电子
13.锂-空气电池是一种可充放电池,电池反应为2Li+O2=Li2O2,某锂-空气电池的构造原理图如图。下列说法正确的是
A.可选用有机电解液或水性电解液
B.含催化剂的多孔电极为电池的负极
C.放电时负极的电极反应式为Li-e-=Li+
D.充电时锂电极应连接外接电源的正极
14.相同材质的铁在下图中的四种情况下腐蚀最快的是
A.
B.
C.
D.
15.下列关于图所示的四个实验装置的说法正确的是(
)
A.装置甲能防止铁钉生锈
B.装置乙为电镀铜装置
C.装置丙中阳离子交换膜能避免氯气与碱反应,且b端产生的气体能使湿润的淀粉碘化钾试纸变蓝
D.装置丁能测定中和反应的反应热
二、填空题
16.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的中和热的热化学方程式(中和热数值为57.3
kJ/mol):___________;
(2)装置图中碎泡沫塑料所起作用为:___________________;
(3)①取50
mL
NaOH溶液和30
mL硫酸溶液进行实验,
实验数据如下表.请填写下表中的空白:
温度
实验次数
起始温度T1/℃
终止温度T2/℃
温度差平均值(T2-T1)/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
30.1
________
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②若上述实验所测中和热数值偏小,产生偏差的原因可能是___________________
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
17.如图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。
请回答下列问题。
(1)以下叙述中,正确的是______。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大
D.乙中电流从铜片经导线流向锌片
(2)若反应过程中有发生转移,则生成氢气在状况下的体积为______。
(3)原电池在工作时,下列反应不可能作为原电池工作时发生的反应的是______。
A.
B.
C.
D.
18.84消毒液等含氯消毒剂等可有效灭活新型冠状病毒。了解这些消毒剂的制备原理、性质十分重要。
试回答下列问题:
(1)取少量84消毒液于试管中,滴几滴酚酞试液,溶液先变红后褪色,其主要原因是_______(用离子方程式表示)。
(2)采用如图所示的简易装置可以在家中制备84消毒液。a为电源______极,制备84消毒液的总反应的化学方程式为_______。
(3)盛装84消毒液宜选择塑料容器,不宜用铁器,其主要原因是________(答2条即可)。
19.某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是石墨电极。当将电源接通后,向乙中滴入酚酞试液,发现在F极附近溶液显红色。按要求回答下列问题:
(1)电极F的名称是______,电源B极的名称是______。
(2)甲装置中D电极的电极反应式是________________。
(3)乙装置中电解反应的总化学方程式_______________________。
(4)欲使丙装置发生:2Ag+2HCl=2AgCl+H2↑反应,则G电极的材料应是____(填化学式)
(5)丁装置中装有Fe(OH)3胶体,一段时间后胶体颜色变深的电极是:__________(填字母)
20.(1)甲醇属于可再生资源,能够代替汽油作为汽车的燃料。一定量的甲醇与足量的金属反应得到标准状况下的,若将这些甲醇完全燃烧生成二氧化碳气体和液态水,放出热量,则甲醇的摩尔燃烧焓为______。
(2)家用液化气的主要成分之一是丁烷,当丁烷完全燃烧生成二氧化碳气体和液态水时,放出热量。根据上述信息写出表示丁烷摩尔燃烧焓的热化学方程式:____________________。
三、推断题
21.Ⅰ.下表是元素周期表的一部分,
回答下列问题:
a
b
c
d
e
f
g
h
i
(1)d、e、f对应简单离子的半径由大到小的顺序为_______(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;写出a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式_________。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式_________。
Ⅱ.
(1)根据下列信息判断氢气燃烧生成水时的热量变化:
①H2(g)与O2(g)反应生成1molH2O(g)时放出的热量为________kJ;
②图中甲、乙、丙中物质所具有的总能量由大到小顺序为:________;
(2)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s)
+
PbO2(s)
+
2H2SO4(aq)
=
2PbSO4(s)
+
2H2O。负极反应式为__________,一段时间后,负极增重48克,转移电子_______mol。
22.A、B、C、D、E、F为中学化学常见的单质或化合物,其中A为淡黄色固体单质,B为气体,E的浓溶液能使铁、铝钝化,F为非金属单质。其转化关系如图所示(条件已略去)。
完成下列问题:
(1)写出E转化为C的化学方程式________________________。
(2)物质B电子式为________。实验室制取少量B时,可用其对应的盐与稀硫酸加热反应,不能选用浓硫酸制取的原因是________________________。
(3)空气中含有少量B时,能使银器表面失去金属光泽、逐渐变黑,将变黑的银器放入装满食盐水的铝盆中,二者直接接触,银器恢复往日光泽试写出银器恢复光亮的反应________________________________。
(4)设计实验证明C具有氧化性(实验方法及现象)________________________。
四、实验题
23.50mL
0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_________。
(2)烧杯间填满碎纸条的作用是_______
。
(3)若大烧杯上不盖硬纸板,求得的中和热?H_______(填“偏大”“偏小”或“无影响”)。
(4)若实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热
________(填“相等”或“不相等”),简述理由:________
24.原电池及原理已广泛应用于生产生活中。
(1)事实证明,能设计成原电池的反应通常是放热反应。下列化学反应中在理论上可以设计成原电池的是_______(填序号)。
a.C(s)+H2O(g)=CO(g)+H2(g)
ΔH>0
b.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH<0
c.Ba(OH)2(aq)
+
H2SO4(aq)=BaSO4(s)+2H2O(l)
ΔH<0
(2)某同学利用生活或实验室中常用的物品,设计了一个原电池,如图所示。实验原理:Fe+2=+H2↑
实验用品:电极(铁钉、铜钉)、稀硫酸、烧杯、导线、耳机(或电流表)。
①用原电池两个电极中的一极触碰耳机插头上的一极(注意:触碰的同时耳机的另一极是跟原电池的另一极相连的),这时,可以听见耳机发出“嚓嚓嚓……”的声音。其原因是在原电池中,将化学能转化为________,在耳机中又将电能转化为声音这种能量。
②如果将装置中的耳机改为电流表,则铁钉应连接电流表的________极,其电极反应式为________;铜钉上的电极反应式为________,该电极上发生了________(填“氧化”或“还原”)反应。
③反应结束后,测得铁钉质量减轻了
2.8
克,则转移电子的物质的量为______。
五、计算题
25.如图为相互串联的甲、乙两电解池.试回答:
(1)若甲电解池利用电解原理在铁上镀银,则A是______、______(填电极材料和电极名称),电极反应式为
______;应选用的电解质溶液是
______。
(2)乙池中滴入少量酚酞试液,电解一段时间后,铁极附近呈______色。C
极生成的物质为
______色。
(3)一段时间后若甲池阴极增重
4.32g,则乙槽中放出的气体在
标准状况下的体积是
______mL。
26.已知下列热化学方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)
△H1=-25kJ?mol-1;
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)
△H2=-47kJ?mol-1;
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
△H3=+19kJ?mol-1.
写出FeO(s)被CO还原成Fe和CO2的热化学方程式__。
参考答案
1.B
2.A
3.C
4.D
5.B
6.C
7.D
8.D
9.B
10.B
11.C
12.B
13.C
14.A
15.D
16.H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(l)
ΔH=-57.3
kJ/mol
保温、隔热,防止热量损失
4.0
a、c、d
17.CD
C
18.
负
具有强氧化性,易腐蚀铁器;是电解质,铁器易发生吸氧腐蚀(合理即可)
19.阴极
负极
Cu2++2e-=Cu2+
2NaCl+2H2O2NaOH+H2↑+Cl2↑
Ag
Y
20.
21.O2->F->Na+
N2H4
H2-2e-+2OH-=2H2O
245
乙>甲>丙
Pb
+-2e-=
PbSO4
1
22.C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
浓硫酸具有强氧化性,能氧化具有还原性的硫化氢,而得不到H2S气体
2Al+3Ag2S+6H2O=2Al(OH)3↓+6Ag+3H2S↑
将SO2通入到盛有H2S溶液的试管中,生成淡黄色的沉淀
23.环形玻璃搅拌棒
减小热量的散失
偏大
不相等
相等
因为酸、碱发生中和反应放出的热量与酸、碱的用量有关,而中和热是指酸跟碱发生中和反应生成1mol水所放出的热量,它与酸、碱的用量无关
24.b
电能
负
Fe-2e-=Fe2+
2H++2e-=H2↑
还原
0.1
mol
25.铁
阴极
Ag+
+
e-
=
Ag
AgNO3
溶液
红
浅黄绿色
896
26.CO(g)+FeO(s)=Fe(s)+CO2(g)
△H=-11kJ/mol
