人教高中化学选修四 1.3盖斯定律、反应热的计算 课件(35张ppt)
文档属性
| 名称 | 人教高中化学选修四 1.3盖斯定律、反应热的计算 课件(35张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-07 00:00:00 | ||
图片预览









文档简介
(共35张PPT)
第三节
化学反应热的计算
学习目标:
1、从能量守恒角度理解并掌握盖斯定律;
2、能正确运用盖斯定律解决具体问题;
3、学会化学反应热的有关计算。
1、已知:H2(g)+Cl2(g)=2HCl(g)
△H=-184.6kJ/mol
则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为(
)
A.+184.6
kJ/mol
B.-92.3
kJ/mol
C.-369.2
kJ/mol
D.+92.3
kJ/mol
复习:
D
2、甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1g甲硅烷自燃放出44.6kJ热量,其燃烧热化学方程式为_____________________________________________
SiH4(g)+O2(g)=SiO2(s)+H2O(l)
△H=-1427.2kJ/mol
规律:
“正逆”反应的反应热效应数值相等,符号相反
在化学科研中,经常要测量化学反应的反应热,但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。如对于反应:
C(s)+1/2O2(g)
=
CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的△H
无法直接测得,那么该反应的反应热是如何确定的呢?
问题
情景
此外,在生产中,对燃料的燃烧,反应条件的控制以及废热的利用,也需要进行反应热的计算。
1、定义:不管化学反应是分一步完成或分几步完成,其反应热是相同的。
换句话说:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
一、盖斯定律
盖斯是俄国化学家,早年从事分析化学研究,1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的能量。1836年经过多次试验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1840年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求计算反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。
A
B
请思考:由起点A到终点B有多少条途径?
从不同途径由A点到B点的位移有什么关系?
登山的高度与上山的途径无关,只与起点和终点的相对高度有关
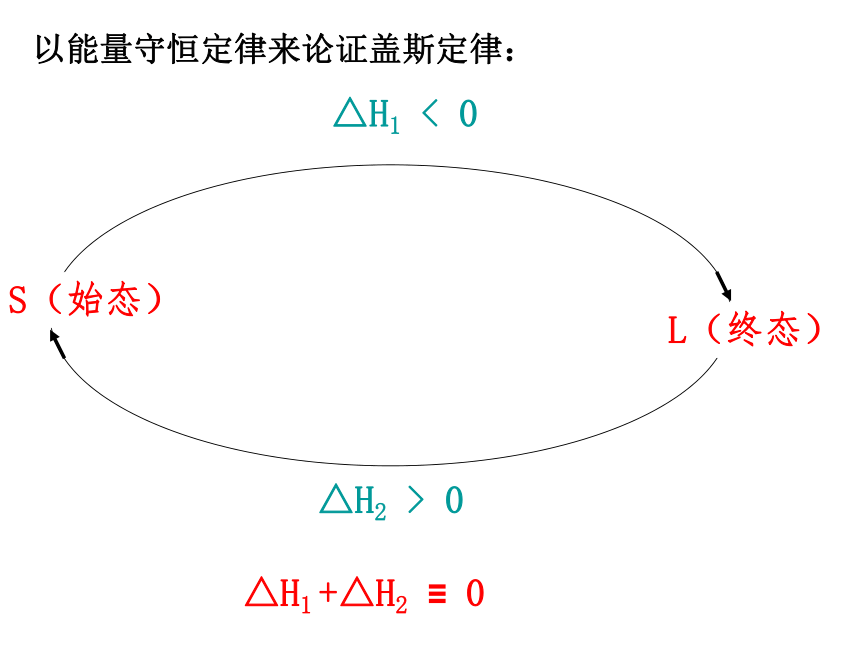
为了理解盖斯定律,可以以登山为例:
△H2
>
0
△H1
<
0
S(始态)
L(终态)
△H1
+△H2
≡
0
以能量守恒定律来论证盖斯定律:
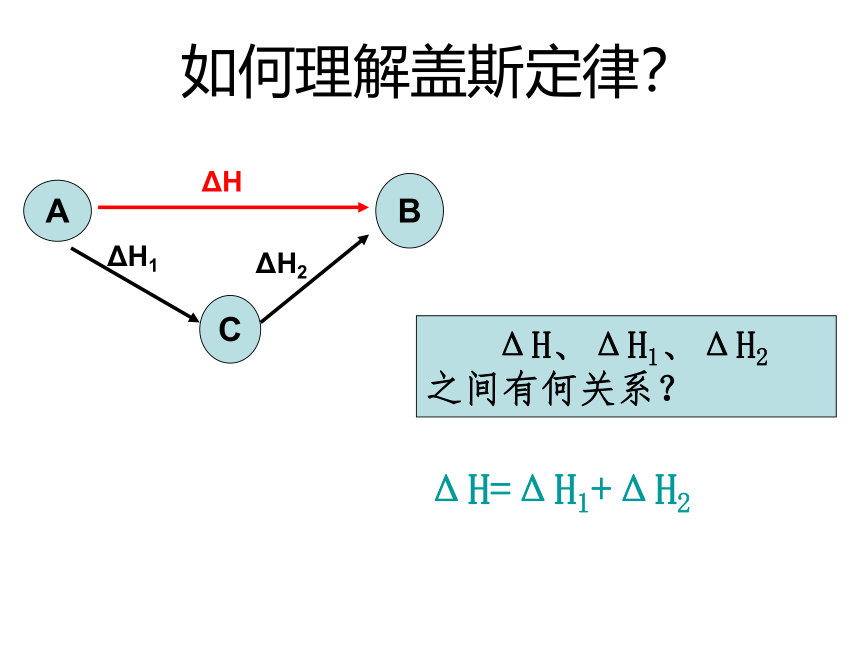
如何理解盖斯定律?
ΔH、ΔH1、ΔH2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
CO(g)
C(s)
CO2(g)
H1
H3
H2
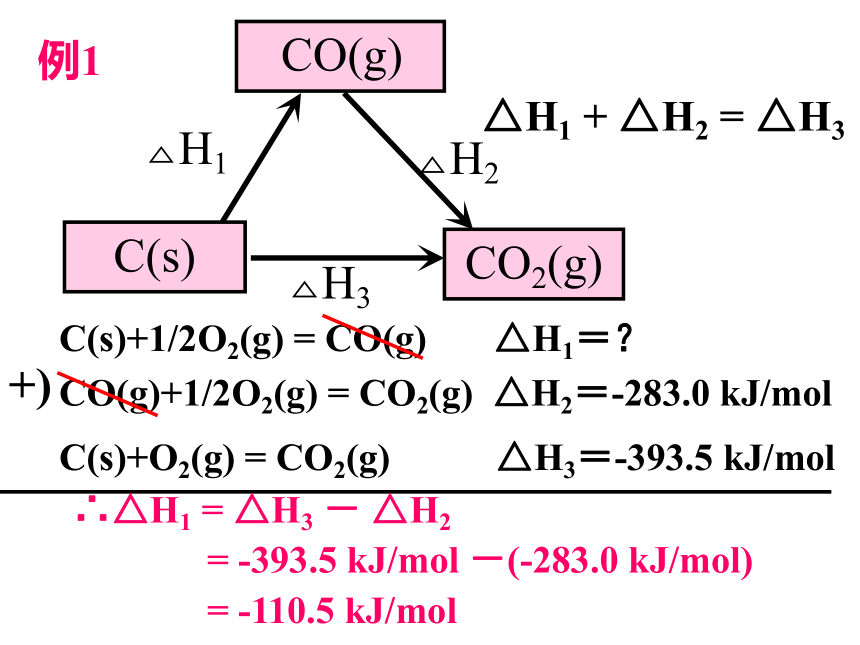
例1
C(s)+1/2O2(g)
=
CO(g)
△H1=?
CO(g)+1/2O2(g)
=
CO2(g)
△H2=-283.0
kJ/mol
C(s)+O2(g)
=
CO2(g)
△H3=-393.5
kJ/mol
+)
△H1
+
△H2
=
△H3
∴△H1
=
△H3
-
△H2
=
-393.5
kJ/mol
-(-283.0
kJ/mol)
=
-110.5
kJ/mol
下列数据表示H2的燃烧热吗?
H2(g)+1/2O2(g)
=
H2O
(g)
△H1=-241.8kJ/mol
②
H2O(g)
=
H2O
(l)
△H2=-44
kJ/mol
已知
③
H2(g)+1/2O2(g)
=
H2O
(l)
①+②=③
△H=△H1+
△H2=-285.8kJ/mol
实例2
①
那么,H2的燃烧热△H究竟是多少?如何计算?
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
2、盖斯定律的应用
关键:目标方程式的“四则运算式”的导出。
方法(1)写出目标方程式确定“过渡物质”(要消去的物质)
(2)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
消去的技巧:目标方程式和已知方程式
同类物质(同为反应物或同为生成物)相加;
不同类物质(一个为反应物与一个为生成物相减;
遵循数学基本原则
例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s)
△H
=
-1206.8
kJ/mol
②Ca(s)+1/2O2(g)=CaO(s)
△H
=
-635.1
kJ/mol
③C(s,石墨)+O2(g)=CO2(g)
△H
=
-393.5
kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变
△H=+178.2
kJ/mol
④=②+③-①
例2:写出石墨变成金刚石的热化学方程式
(25℃,101kPa时)
查燃烧热表知:
①C(石墨,s)+O2(g)=CO2(g)
△H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)=CO2(g)
△H2=-395.0kJ/mol
所以,
①-
②得:
C(石墨,s)=C(金刚石,s)
△H=+1.5kJ/mol
例3:同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
①P4(s、白磷)+5O2(g)=P4O10(s)△H1=-2983.2
kJ/mol
②P(s、红磷)+5/4O2(g)=1/4P4O10(s)
△H2=
-738.5
kJ/mol
试写出白磷转化为红磷的热化学方程式
。
P4(s、白磷)=4P(s、红磷)
△H=-29.2kJ/mol
①-
4×②:
小结:
(1)热化学方程式与数学上的方程式相似,可以移项同时改变正、负号;当热化学方程式中各物质的化学计量数改变,其反应热数值改变相同的倍数
(2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式。
(3)可燃物产生的热量=可燃物的物质的量
×
燃烧热
注意事项:
(1)热化学方程式乘上某一个数时,反应热数值也须乘上该数;
(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
(3)将一个热化学方程式颠倒时,
△H的“+”
“-”号必须随之改变。
你知道神六的火箭燃料是什么吗?
例4:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)==2NO2(g)
△H1=+67.2kJ/mol
②N2H4(g)+O2(g)==N2(g)+2H2O(l)
△H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2
N2H4(g)+
2NO2(g)=
3N2(g)+4H2O(l)
△H=-1135.2kJ/mol
2
×
②-①:
思考:为什么在热化学反应方程式中通常可不表明反应条件?
正逆反应的反应热效应数值相等,符号相反。
“+”不能省去。
练习
1.已知石墨的燃烧热:△H=-393.5kJ/mol
(1)写出石墨的完全燃烧的热化学方程式
(2)二氧化碳转化为石墨和氧气的热化学方程式
热化学方程式还可以表示理论可进行实际难进行的化学反应
①C(石墨,s)+O2(g)=CO2(g)
△H
=-393.5kJ/mol
②CO2(g)=C(石墨,s)+O2(g)
△H
=+393.5kJ/mol
2.已知
①
CO(g)+1/2O2(g)=CO2(g)
ΔH1=
-283.0
kJ/mol
②
H2(g)+1/2O2(g)=H2O(l)
ΔH2=
-285.8
kJ/mol
③C2H5OH(l)+
3O2(g)=2CO2(g)+3H2O(l)
ΔH3=-1370
kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2
+
②×4
-
③
所以,ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?????
=-283.2×2
-285.8×4
+1370
kJ/mol
=-339.2
kJ/mol
3.
在100
g
碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+1/2O2(g)=CO(g)
△H=-110.35kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是(
)
392.92
kJ
B.
2489.44
kJ
C.
784.92
kJ
D.
3274.3
kJ
C
利用反应热的概念、盖斯定律、热化学方程式进行有关反应热的计算:
题型一:有关热化学反应方程式的的含义及书写
题型二:燃烧热、中和热的判断、求算及测量
二.反应热的计算:
具体内容:
1.
已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
2、有关反应热的计算:
(1)盖斯定律及其应用
(2)
根据一定量的物质参加反应放出或吸收的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
Q
=
n×(-ΔH)
比热公式:△H
=
c
m△T
(3)利用键能计算反应热
①
△H
=
∑E(吸)
-
∑E(放)
②
△H
=
反应物的键能总和
–
生成物的键能总和
③
△H
=
∑E(生成物)
-
∑E(反应物)
△H的计算数值:吸“+”放“-”
练习1、在298
K、101
kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
A
A
A
②×3/2-②即得目标方程式,故有:
△H=3/2△H2-△H1=824.35kJ·mol-1
练习4、已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l)
△H1=-870.3kJ/mol
(2)C(s)+O2(g)
==CO2(g)
△H2=-393.5kJ/mol
(3)
H2(g)+1/2O2(g)
==H2O(l)
△H3=-285.8kJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)
==CH3COOH(l)
②×2+③×2-①得:
△H===2
△H2+2
△H3-①
==2×(-393.5)+
2×(-285.8)-(-870.3)==
-488.3kJ/mol
练习4、由金红石?TiO2?制取单质Ti,涉及到的步骤为::
TiO2
TiCl4
Ti
已知:①
C?s?+O2?g?=CO2?g?;
?H=?393?5
kJ·mol?1
②
2CO?g?+O2?g?=2CO2?g?;
?H=?566
kJ·mol?1
③
TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g?;
?H=+141
kJ·mol?1
则TiO2?s?+2Cl2?g?+2C?s?=TiCl4?s?+2CO?g?
的?H=
。
练习5、焙烧产生的SO2可用于制硫酸。已知25℃、101
kPa时:
2SO2(g)
+O2(g)
2SO3(g)
△H1=
一197
kJ/mol;
2H2O
(g)=2H2O(1)
△H2=一44
kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)
△H3=一545
kJ/mol。
则SO3
(g)与H2O(l)反应的热化学方程式是
SO3(g)+H2O(l)===H2SO4(l) ΔH=-152
kJ·mol-1
练习6、捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2
可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
(NH4)2CO3(aq)
△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
(NH4)2HCO3(aq)
△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
2(NH4)2HCO3(aq)
△H3
请回答下列问题:
△H3与△H1、△H2之间的关系是:△H3
=
。
2△H2
–△H1
练习7、碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)=2LiI
(s)
△H
已知:4Li(s)+O2(g)=2Li2O(s)
△H1
4
LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则电池反应的△H=___________________________;
1/2
(ΔH1-ΔH2)
练习8、将煤转化为清洁气体燃料。
已知:H2(g)+
1/2O2=H2O(g)
△H=-241.8kJ·mol-1
C(s)+
△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:
。
C(s)+H2O(g)=CO(g)+H2(g)
△H=+131.3KJ·mol-1
[练习9] 已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25
kJ·mol-1
(2)3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47
kJ·mol-1
(3)Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19
kJ·mol-1
试写出FeO(s)被CO还原成Fe和CO2的热化学方程式____________________________。
FeO(s)+CO(g)===Fe(s)+CO2(g)
ΔH=-11
kJ·mol-1
课堂小结:
1.“盖斯定律”是指化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。即
2.化学反应的反应热的数值与各物质的化学计量数成正比。
3.正逆反应的反应热数值相同,符号相反。
第三节
化学反应热的计算
学习目标:
1、从能量守恒角度理解并掌握盖斯定律;
2、能正确运用盖斯定律解决具体问题;
3、学会化学反应热的有关计算。
1、已知:H2(g)+Cl2(g)=2HCl(g)
△H=-184.6kJ/mol
则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为(
)
A.+184.6
kJ/mol
B.-92.3
kJ/mol
C.-369.2
kJ/mol
D.+92.3
kJ/mol
复习:
D
2、甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水。已知室温下1g甲硅烷自燃放出44.6kJ热量,其燃烧热化学方程式为_____________________________________________
SiH4(g)+O2(g)=SiO2(s)+H2O(l)
△H=-1427.2kJ/mol
规律:
“正逆”反应的反应热效应数值相等,符号相反
在化学科研中,经常要测量化学反应的反应热,但是某些物质的反应热,由于种种原因不能直接测得,只能通过化学计算的方式间接获得。如对于反应:
C(s)+1/2O2(g)
=
CO(g),因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的△H
无法直接测得,那么该反应的反应热是如何确定的呢?
问题
情景
此外,在生产中,对燃料的燃烧,反应条件的控制以及废热的利用,也需要进行反应热的计算。
1、定义:不管化学反应是分一步完成或分几步完成,其反应热是相同的。
换句话说:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
一、盖斯定律
盖斯是俄国化学家,早年从事分析化学研究,1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的能量。1836年经过多次试验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1840年以热的加和性守恒定律形式发表。这就是举世闻名的盖斯定律。盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。当一个不能直接发生的反应要求计算反应热时,便可以用分步法测定反应热并加和起来而间接求得。故而我们常称盖斯是热化学的奠基人。
A
B
请思考:由起点A到终点B有多少条途径?
从不同途径由A点到B点的位移有什么关系?
登山的高度与上山的途径无关,只与起点和终点的相对高度有关
为了理解盖斯定律,可以以登山为例:
△H2
>
0
△H1
<
0
S(始态)
L(终态)
△H1
+△H2
≡
0
以能量守恒定律来论证盖斯定律:
如何理解盖斯定律?
ΔH、ΔH1、ΔH2
之间有何关系?
ΔH=ΔH1+ΔH2
B
ΔH
A
C
ΔH1
ΔH2
CO(g)
C(s)
CO2(g)
H1
H3
H2
例1
C(s)+1/2O2(g)
=
CO(g)
△H1=?
CO(g)+1/2O2(g)
=
CO2(g)
△H2=-283.0
kJ/mol
C(s)+O2(g)
=
CO2(g)
△H3=-393.5
kJ/mol
+)
△H1
+
△H2
=
△H3
∴△H1
=
△H3
-
△H2
=
-393.5
kJ/mol
-(-283.0
kJ/mol)
=
-110.5
kJ/mol
下列数据表示H2的燃烧热吗?
H2(g)+1/2O2(g)
=
H2O
(g)
△H1=-241.8kJ/mol
②
H2O(g)
=
H2O
(l)
△H2=-44
kJ/mol
已知
③
H2(g)+1/2O2(g)
=
H2O
(l)
①+②=③
△H=△H1+
△H2=-285.8kJ/mol
实例2
①
那么,H2的燃烧热△H究竟是多少?如何计算?
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
2、盖斯定律的应用
关键:目标方程式的“四则运算式”的导出。
方法(1)写出目标方程式确定“过渡物质”(要消去的物质)
(2)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
消去的技巧:目标方程式和已知方程式
同类物质(同为反应物或同为生成物)相加;
不同类物质(一个为反应物与一个为生成物相减;
遵循数学基本原则
例1:已知下列各反应的焓变
①Ca(s)+C(s,石墨)+3/2O2(g)=CaCO3(s)
△H
=
-1206.8
kJ/mol
②Ca(s)+1/2O2(g)=CaO(s)
△H
=
-635.1
kJ/mol
③C(s,石墨)+O2(g)=CO2(g)
△H
=
-393.5
kJ/mol
试求④CaCO3(s)=CaO(s)+CO2(g)的焓变
△H=+178.2
kJ/mol
④=②+③-①
例2:写出石墨变成金刚石的热化学方程式
(25℃,101kPa时)
查燃烧热表知:
①C(石墨,s)+O2(g)=CO2(g)
△H1=-393.5kJ/mol
②C(金刚石,s)+O2(g)=CO2(g)
△H2=-395.0kJ/mol
所以,
①-
②得:
C(石墨,s)=C(金刚石,s)
△H=+1.5kJ/mol
例3:同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:
①P4(s、白磷)+5O2(g)=P4O10(s)△H1=-2983.2
kJ/mol
②P(s、红磷)+5/4O2(g)=1/4P4O10(s)
△H2=
-738.5
kJ/mol
试写出白磷转化为红磷的热化学方程式
。
P4(s、白磷)=4P(s、红磷)
△H=-29.2kJ/mol
①-
4×②:
小结:
(1)热化学方程式与数学上的方程式相似,可以移项同时改变正、负号;当热化学方程式中各物质的化学计量数改变,其反应热数值改变相同的倍数
(2)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式。
(3)可燃物产生的热量=可燃物的物质的量
×
燃烧热
注意事项:
(1)热化学方程式乘上某一个数时,反应热数值也须乘上该数;
(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
(3)将一个热化学方程式颠倒时,
△H的“+”
“-”号必须随之改变。
你知道神六的火箭燃料是什么吗?
例4:某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
①N2(g)+2O2(g)==2NO2(g)
△H1=+67.2kJ/mol
②N2H4(g)+O2(g)==N2(g)+2H2O(l)
△H2=-534kJ/mol
假如都在相同状态下,请写出发射火箭反应的热化学方程式。
2
N2H4(g)+
2NO2(g)=
3N2(g)+4H2O(l)
△H=-1135.2kJ/mol
2
×
②-①:
思考:为什么在热化学反应方程式中通常可不表明反应条件?
正逆反应的反应热效应数值相等,符号相反。
“+”不能省去。
练习
1.已知石墨的燃烧热:△H=-393.5kJ/mol
(1)写出石墨的完全燃烧的热化学方程式
(2)二氧化碳转化为石墨和氧气的热化学方程式
热化学方程式还可以表示理论可进行实际难进行的化学反应
①C(石墨,s)+O2(g)=CO2(g)
△H
=-393.5kJ/mol
②CO2(g)=C(石墨,s)+O2(g)
△H
=+393.5kJ/mol
2.已知
①
CO(g)+1/2O2(g)=CO2(g)
ΔH1=
-283.0
kJ/mol
②
H2(g)+1/2O2(g)=H2O(l)
ΔH2=
-285.8
kJ/mol
③C2H5OH(l)+
3O2(g)=2CO2(g)+3H2O(l)
ΔH3=-1370
kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH?
【解】:根据盖斯定律,反应④不论是一步完成还是分几步完成,其反应热效应都是相同的。下面就看看反应④能不能由①②③三个反应通过加减乘除组合而成,也就是说,看看反应④能不能分成①②③几步完成。
①×2
+
②×4
-
③
所以,ΔH=ΔH1×2
+ΔH2×4
-ΔH3
?????
=-283.2×2
-285.8×4
+1370
kJ/mol
=-339.2
kJ/mol
3.
在100
g
碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且
C(s)+1/2O2(g)=CO(g)
△H=-110.35kJ/mol
CO(g)+1/2O2(g)=CO2(g)
△H=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是(
)
392.92
kJ
B.
2489.44
kJ
C.
784.92
kJ
D.
3274.3
kJ
C
利用反应热的概念、盖斯定律、热化学方程式进行有关反应热的计算:
题型一:有关热化学反应方程式的的含义及书写
题型二:燃烧热、中和热的判断、求算及测量
二.反应热的计算:
具体内容:
1.
已知一定量的物质参加反应放出的热量,写出其热化学反应方程式。
2、有关反应热的计算:
(1)盖斯定律及其应用
(2)
根据一定量的物质参加反应放出或吸收的热量(或根据已知的热化学方程式),进行有关反应热的计算或比较大小。
Q
=
n×(-ΔH)
比热公式:△H
=
c
m△T
(3)利用键能计算反应热
①
△H
=
∑E(吸)
-
∑E(放)
②
△H
=
反应物的键能总和
–
生成物的键能总和
③
△H
=
∑E(生成物)
-
∑E(反应物)
△H的计算数值:吸“+”放“-”
练习1、在298
K、101
kPa时,已知:
2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2
B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2
D.ΔH3=ΔH1-ΔH2
A
A
A
②×3/2-②即得目标方程式,故有:
△H=3/2△H2-△H1=824.35kJ·mol-1
练习4、已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)==2CO2(g)+2H2O(l)
△H1=-870.3kJ/mol
(2)C(s)+O2(g)
==CO2(g)
△H2=-393.5kJ/mol
(3)
H2(g)+1/2O2(g)
==H2O(l)
△H3=-285.8kJ/mol
试计算下列反应的反应热:
2C(s)+2H2(g)+O2(g)
==CH3COOH(l)
②×2+③×2-①得:
△H===2
△H2+2
△H3-①
==2×(-393.5)+
2×(-285.8)-(-870.3)==
-488.3kJ/mol
练习4、由金红石?TiO2?制取单质Ti,涉及到的步骤为::
TiO2
TiCl4
Ti
已知:①
C?s?+O2?g?=CO2?g?;
?H=?393?5
kJ·mol?1
②
2CO?g?+O2?g?=2CO2?g?;
?H=?566
kJ·mol?1
③
TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g?;
?H=+141
kJ·mol?1
则TiO2?s?+2Cl2?g?+2C?s?=TiCl4?s?+2CO?g?
的?H=
。
练习5、焙烧产生的SO2可用于制硫酸。已知25℃、101
kPa时:
2SO2(g)
+O2(g)
2SO3(g)
△H1=
一197
kJ/mol;
2H2O
(g)=2H2O(1)
△H2=一44
kJ/mol
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)
△H3=一545
kJ/mol。
则SO3
(g)与H2O(l)反应的热化学方程式是
SO3(g)+H2O(l)===H2SO4(l) ΔH=-152
kJ·mol-1
练习6、捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2
可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
(NH4)2CO3(aq)
△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
(NH4)2HCO3(aq)
△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
2(NH4)2HCO3(aq)
△H3
请回答下列问题:
△H3与△H1、△H2之间的关系是:△H3
=
。
2△H2
–△H1
练习7、碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)=2LiI
(s)
△H
已知:4Li(s)+O2(g)=2Li2O(s)
△H1
4
LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则电池反应的△H=___________________________;
1/2
(ΔH1-ΔH2)
练习8、将煤转化为清洁气体燃料。
已知:H2(g)+
1/2O2=H2O(g)
△H=-241.8kJ·mol-1
C(s)+
△H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:
。
C(s)+H2O(g)=CO(g)+H2(g)
△H=+131.3KJ·mol-1
[练习9] 已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25
kJ·mol-1
(2)3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47
kJ·mol-1
(3)Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+19
kJ·mol-1
试写出FeO(s)被CO还原成Fe和CO2的热化学方程式____________________________。
FeO(s)+CO(g)===Fe(s)+CO2(g)
ΔH=-11
kJ·mol-1
课堂小结:
1.“盖斯定律”是指化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。即
2.化学反应的反应热的数值与各物质的化学计量数成正比。
3.正逆反应的反应热数值相同,符号相反。
