化学反应原理>>第一章 化学反应与能量>>第一节 化学反应与能量变化
文档属性
| 名称 | 化学反应原理>>第一章 化学反应与能量>>第一节 化学反应与能量变化 |

|
|
| 格式 | rar | ||
| 文件大小 | 314.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-09-23 00:00:00 | ||
图片预览











文档简介
(共31张PPT)
第 课时
化学反应及其能量变化
第 一 章
化学反应中的能量变化
下列说法正确的是( )
①吸热反应发生过程中需要不断地从外界获得能量,放热反应发生过程中不需要外界能量
②是放热反应还是吸热反应要由反应物、生成物所具有的总能量的相对大小决定
③热化学方程式不仅表明了化学反应中物质的变化,也表明了反应中的能量变化
体验1
②③
④0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ热量,其热化学方程式为CH4(g)+2O2(g) CO2(g)+2H2O(l);
ΔH=+890 kJ·mol-1
⑤已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1
⑥在稀溶液中,醋酸与氢氧化钠发生中和反应而生成1 mol水,这时的反应热叫中和热
下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
体验2
A
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(s,石墨)+O2(g) CO2(g);
ΔH=-393.51kJ·mol-1
C(s,金刚石)+O2(g) CO2(g);
ΔH=-395.41kJ·mol-1
据此判断,下列说法中正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
体验3
A
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
(2009高考·重庆)下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A.C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(g);ΔH=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);ΔH=+57.3 kJ/mol(中和热)
C.S(s)+O2(g) SO2(g);
ΔH=-296.8 kJ/mol(反应热)
D.2NO2 O2+2NO;
ΔH=+116.2 kJ/mol(反应热)
体验4
C
选项A,H2O呈气态时不稳定,不是表示燃烧热的热化学方程式。选项B,中和反应为放热反应,ΔH<0,ΔH=-57.3 kJ/mol,B错误。选项C,S燃烧生成SO2的反应是放热反应,ΔH<0,同时表明了物质的聚集状态等,C正确。选项D,未注明物质的聚集状态,D错误。
解析
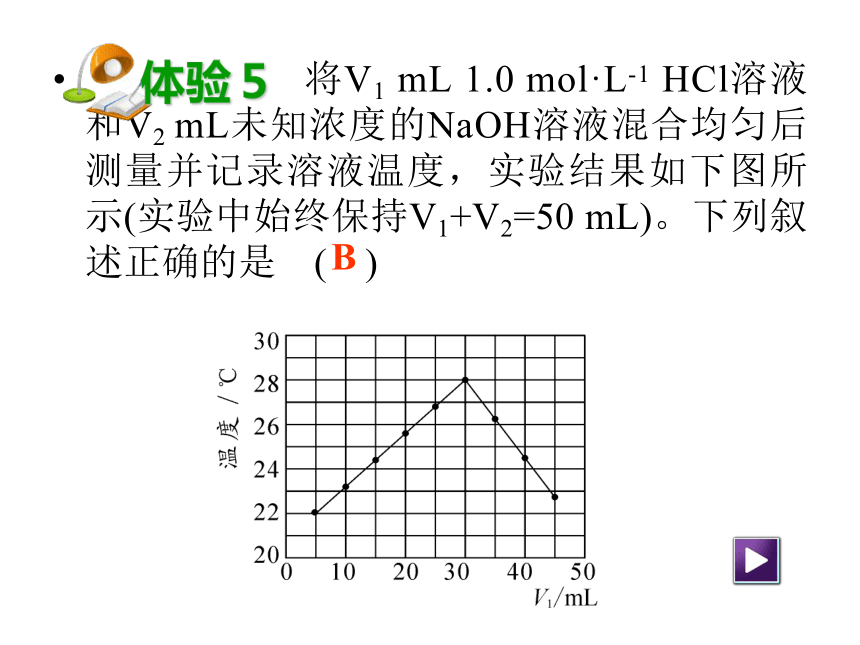
将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是 ( )
体验5
B
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应二、
已知:
H2(g)+ O2(g) H2O(l);
ΔH=-285.8kJ·mol-1,则:
H2O(l) H2(g)+ O2(g);
ΔH= ;
2H2(g)+O2(g) 2H2O(l);
ΔH= 。
体验6
+285.8kJ·mol-1
-571.6kJ·mol-1
我国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉的好处在于 ( )
A.增大煤炭燃烧时的燃烧热
B.减少炉中杂质气体(如SO2等)的形成
C.使化学平衡发生移动
D.使得燃料燃烧充分,从而提高燃料的利用率
体验7
D
热化学方程式的意义与书写
1.意义:热化学方程式不仅表明了化学反应中的物质变化,同时也表明了化学反应中的能量变化。
2.书写:①要注明反应的温度和压强,若反应是在298 K和1.013×105 Pa条件下进行,可不予注明。②要注明反应物和生成物的聚集状态或晶型。常用s、l、g分别表示固体、液体、气体。
考点一
③ΔH与方程式化学计量数有关,注意方程式与对应ΔH不要弄错,化学计量数以“mol”为单位,可以是小数或分数。④在所写化学反应方程式后写下ΔH的数值和单位,方程式与ΔH之间应用分号隔开。⑤当ΔH为“-”或ΔH<0时,为放热反应,当ΔH为“+”或ΔH>0时,为吸热反应。
3.注意:燃烧热是以1 mol物质完全燃烧生成稳定的氧化物所放出的热量来定义的,因此书写热化学方程式时,通常以燃烧1 mol物质为标准来配平其余物质的化学计量数。
【例1】(2010高考·浙江)下列热化学方程式或离子方程式中正确的是( )
【解析】本题考查热化学方程式与离子方程式的书写。A选项中标准燃烧热是指1 mol可燃物完全燃烧生成稳定氧化物时放出的热量(标准指298K,1atm),所以产物水应为液态,方程式系数就是物质的量,故A错。B选项中,为可逆反应,所以根据热化学方程式的含义,与之对应的热量是1 mol氮气完全反应时的热量,但反应为可逆反应故放出的热量大于38.6 kJ·mol-1。C选项氨水为弱电解质不能拆开写。
【答案】D
【变式1】已知25 ℃ 101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(g);
ΔH=-48.40 kJ·mol-1
B
B.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(l);
ΔH=-5518 kJ·mol-1
C.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(l);
ΔH=+5518 kJ·mol-1
D.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(l);
ΔH=-48.40 kJ·mol-1
有关反应热计算
1.根据物质的总能量进行求算
如果用E(反)表示反应物所具有的总能量,E(生)表示生成物所具有的总能量。
反应热:ΔH=E(生)-E(反)
考点二
2.根据反应物与生成物的键能求算(键能为拆开1 mol化学键所吸收的能量)
化学反应发生时,必然会出现旧键的断裂和新键的形成。
反应热:ΔH=反应物的键能总和-生成物的键能总和。
3.根据已有的热化学方程式进行加、减或乘以某一系数后进行加、减求算。
【例2】(2010高考·全国Ⅱ)下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+O2(g)===4CO2(g)+5H2O(l) DH=-2878 kJ/mol
②C4H10(g)+O2(g)===4CO2(g)+5H2O(g) DH=-2658 kJ/mol
③C4H10(g)+O2(g)===4CO(g)+5H2O(l) DH=-1746 kJ/mol
④C4H10(g)+O2(g)===4CO(g)+5H2O(g) DH=-1526 kJ/mol
由此判断,正丁烷的燃烧热是( )
A.-2878 kJ/mol B.-2658 kJ/mol
C.-1746 kJ/mol D.-1526 kJ/mol
根据燃烧热的概念“1 mol物质”“完全燃烧”“生成稳定的氧化物”,可知①放出的热量即为燃烧热,故正确选择为A;第②项水应为液体,故错,第③④项碳元素应转变为CO2(g),故错。
【答案】A
解析
【变式2】(2010高考·重庆)已知H2(g)+Br2(l)===2HBr(g) DH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30kJ,其他的相关数据如下表:
H2(g) Br2(g) HBr(g)
1 mol分子中的化学键断裂时需要吸收的能量/kJ 436 a 369
则表中a为( )
A.404 B.260 C.230 D.200
D
反应热的大小比较
1.反应物和生成物的聚集状态、化学计量数不同,ΔH不同。
2.ΔH是带符号比较的,所有吸热反应的ΔH比所有放热反应的ΔH大。放热反应的反应热ΔH<0,放热越多,|ΔH|越大,ΔH越小。
考点二
3.物质的气、液、固三态变化的热效应:
注意:同一物质由固态→液态→气态及弱电解质的电离都有吸热过程,但不能称为吸热反应。
4.对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的数值。例如:2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ·mol-1,则向密闭容器中通入2 mol SO2和1 mol O2,反应达到平衡后,放出的热量要小于196.6 kJ。
【例3】(2010高考·广东)在298K、100kPa时,已知:
2H2O(g)===O2(g)+2H2(g) DH1
Cl2(g)+H2(g)===2HCl(g) DH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) DH3
则DH3与DH1和DH2间的关系正确的是( )
A.DH3=DH1+2DH2
B.DH3=DH1+DH2
C.DH3=DH1-2DH2
D.DH3=DH1-DH2
由盖斯定律可知,第三个方程式可由第二个方程式乘以2与第一个方程式相加而得。
【答案】A
解析
【变式3】下列各组热化学方程式中,化学反应的DH前者大于后者的是( )
①C(s)+O2(g)===CO2(g);DH1
C(s)+O2(g)===CO(g);DH2
②S(s)+O2(g)===SO2(g);DH3
S(g)+O2(g)===SO2(g);DH4
③H2(g)+O2(g)===H2O(l);DH5
2H2(g)+O2(g)===2H2O(l);DH6
④CaCO3(s)===CaO(s)+CO2(g);DH7
CaO(s)+H2O(l)===Ca(OH)2(s);DH8
A.① B.④
C.②③④ D.①②③
C
①中前者为完全燃烧,后者为不完全燃烧,热效应是前者大于后者,但DH1、DH2均为负数,故DH1解析
第 课时
化学反应及其能量变化
第 一 章
化学反应中的能量变化
下列说法正确的是( )
①吸热反应发生过程中需要不断地从外界获得能量,放热反应发生过程中不需要外界能量
②是放热反应还是吸热反应要由反应物、生成物所具有的总能量的相对大小决定
③热化学方程式不仅表明了化学反应中物质的变化,也表明了反应中的能量变化
体验1
②③
④0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ热量,其热化学方程式为CH4(g)+2O2(g) CO2(g)+2H2O(l);
ΔH=+890 kJ·mol-1
⑤已知在101 kPa时,2 g碳燃烧生成CO放出热量为Q kJ,则碳的燃烧热为6Q kJ·mol-1
⑥在稀溶液中,醋酸与氢氧化钠发生中和反应而生成1 mol水,这时的反应热叫中和热
下列反应中生成物总能量高于反应物总能量的是 ( )
A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
体验2
A
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(s,石墨)+O2(g) CO2(g);
ΔH=-393.51kJ·mol-1
C(s,金刚石)+O2(g) CO2(g);
ΔH=-395.41kJ·mol-1
据此判断,下列说法中正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
体验3
A
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
(2009高考·重庆)下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A.C2H5OH(l)+3O2(g) 2CO2(g)+3H2O(g);ΔH=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);ΔH=+57.3 kJ/mol(中和热)
C.S(s)+O2(g) SO2(g);
ΔH=-296.8 kJ/mol(反应热)
D.2NO2 O2+2NO;
ΔH=+116.2 kJ/mol(反应热)
体验4
C
选项A,H2O呈气态时不稳定,不是表示燃烧热的热化学方程式。选项B,中和反应为放热反应,ΔH<0,ΔH=-57.3 kJ/mol,B错误。选项C,S燃烧生成SO2的反应是放热反应,ΔH<0,同时表明了物质的聚集状态等,C正确。选项D,未注明物质的聚集状态,D错误。
解析
将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是 ( )
体验5
B
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应二、
已知:
H2(g)+ O2(g) H2O(l);
ΔH=-285.8kJ·mol-1,则:
H2O(l) H2(g)+ O2(g);
ΔH= ;
2H2(g)+O2(g) 2H2O(l);
ΔH= 。
体验6
+285.8kJ·mol-1
-571.6kJ·mol-1
我国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉的好处在于 ( )
A.增大煤炭燃烧时的燃烧热
B.减少炉中杂质气体(如SO2等)的形成
C.使化学平衡发生移动
D.使得燃料燃烧充分,从而提高燃料的利用率
体验7
D
热化学方程式的意义与书写
1.意义:热化学方程式不仅表明了化学反应中的物质变化,同时也表明了化学反应中的能量变化。
2.书写:①要注明反应的温度和压强,若反应是在298 K和1.013×105 Pa条件下进行,可不予注明。②要注明反应物和生成物的聚集状态或晶型。常用s、l、g分别表示固体、液体、气体。
考点一
③ΔH与方程式化学计量数有关,注意方程式与对应ΔH不要弄错,化学计量数以“mol”为单位,可以是小数或分数。④在所写化学反应方程式后写下ΔH的数值和单位,方程式与ΔH之间应用分号隔开。⑤当ΔH为“-”或ΔH<0时,为放热反应,当ΔH为“+”或ΔH>0时,为吸热反应。
3.注意:燃烧热是以1 mol物质完全燃烧生成稳定的氧化物所放出的热量来定义的,因此书写热化学方程式时,通常以燃烧1 mol物质为标准来配平其余物质的化学计量数。
【例1】(2010高考·浙江)下列热化学方程式或离子方程式中正确的是( )
【解析】本题考查热化学方程式与离子方程式的书写。A选项中标准燃烧热是指1 mol可燃物完全燃烧生成稳定氧化物时放出的热量(标准指298K,1atm),所以产物水应为液态,方程式系数就是物质的量,故A错。B选项中,为可逆反应,所以根据热化学方程式的含义,与之对应的热量是1 mol氮气完全反应时的热量,但反应为可逆反应故放出的热量大于38.6 kJ·mol-1。C选项氨水为弱电解质不能拆开写。
【答案】D
【变式1】已知25 ℃ 101 kPa下,1 g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40 kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(g);
ΔH=-48.40 kJ·mol-1
B
B.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(l);
ΔH=-5518 kJ·mol-1
C.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(l);
ΔH=+5518 kJ·mol-1
D.C8H18(l)+12.5O2(g) 8CO2(g)+9H2O(l);
ΔH=-48.40 kJ·mol-1
有关反应热计算
1.根据物质的总能量进行求算
如果用E(反)表示反应物所具有的总能量,E(生)表示生成物所具有的总能量。
反应热:ΔH=E(生)-E(反)
考点二
2.根据反应物与生成物的键能求算(键能为拆开1 mol化学键所吸收的能量)
化学反应发生时,必然会出现旧键的断裂和新键的形成。
反应热:ΔH=反应物的键能总和-生成物的键能总和。
3.根据已有的热化学方程式进行加、减或乘以某一系数后进行加、减求算。
【例2】(2010高考·全国Ⅱ)下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+O2(g)===4CO2(g)+5H2O(l) DH=-2878 kJ/mol
②C4H10(g)+O2(g)===4CO2(g)+5H2O(g) DH=-2658 kJ/mol
③C4H10(g)+O2(g)===4CO(g)+5H2O(l) DH=-1746 kJ/mol
④C4H10(g)+O2(g)===4CO(g)+5H2O(g) DH=-1526 kJ/mol
由此判断,正丁烷的燃烧热是( )
A.-2878 kJ/mol B.-2658 kJ/mol
C.-1746 kJ/mol D.-1526 kJ/mol
根据燃烧热的概念“1 mol物质”“完全燃烧”“生成稳定的氧化物”,可知①放出的热量即为燃烧热,故正确选择为A;第②项水应为液体,故错,第③④项碳元素应转变为CO2(g),故错。
【答案】A
解析
【变式2】(2010高考·重庆)已知H2(g)+Br2(l)===2HBr(g) DH=-72 kJ/mol,蒸发1 mol Br2(l)需要吸收的能量为30kJ,其他的相关数据如下表:
H2(g) Br2(g) HBr(g)
1 mol分子中的化学键断裂时需要吸收的能量/kJ 436 a 369
则表中a为( )
A.404 B.260 C.230 D.200
D
反应热的大小比较
1.反应物和生成物的聚集状态、化学计量数不同,ΔH不同。
2.ΔH是带符号比较的,所有吸热反应的ΔH比所有放热反应的ΔH大。放热反应的反应热ΔH<0,放热越多,|ΔH|越大,ΔH越小。
考点二
3.物质的气、液、固三态变化的热效应:
注意:同一物质由固态→液态→气态及弱电解质的电离都有吸热过程,但不能称为吸热反应。
4.对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于相应热化学方程式中的数值。例如:2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 kJ·mol-1,则向密闭容器中通入2 mol SO2和1 mol O2,反应达到平衡后,放出的热量要小于196.6 kJ。
【例3】(2010高考·广东)在298K、100kPa时,已知:
2H2O(g)===O2(g)+2H2(g) DH1
Cl2(g)+H2(g)===2HCl(g) DH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) DH3
则DH3与DH1和DH2间的关系正确的是( )
A.DH3=DH1+2DH2
B.DH3=DH1+DH2
C.DH3=DH1-2DH2
D.DH3=DH1-DH2
由盖斯定律可知,第三个方程式可由第二个方程式乘以2与第一个方程式相加而得。
【答案】A
解析
【变式3】下列各组热化学方程式中,化学反应的DH前者大于后者的是( )
①C(s)+O2(g)===CO2(g);DH1
C(s)+O2(g)===CO(g);DH2
②S(s)+O2(g)===SO2(g);DH3
S(g)+O2(g)===SO2(g);DH4
③H2(g)+O2(g)===H2O(l);DH5
2H2(g)+O2(g)===2H2O(l);DH6
④CaCO3(s)===CaO(s)+CO2(g);DH7
CaO(s)+H2O(l)===Ca(OH)2(s);DH8
A.① B.④
C.②③④ D.①②③
C
①中前者为完全燃烧,后者为不完全燃烧,热效应是前者大于后者,但DH1、DH2均为负数,故DH1
