沪教版(全国)化学九年级上第4章《认识化学变化》测试题(含答案)
文档属性
| 名称 | 沪教版(全国)化学九年级上第4章《认识化学变化》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 244.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-09 08:15:21 | ||
图片预览


文档简介
第4章《认识化学变化》测试题
一、单选题
1.20
°C时,下列能体现“1
+1=2”这一结论的是()
A.将1
g铜粉与1
g铁粉混合,所得混合物质量为2
g
B.点燃条件下,1个氢气分子与1个氧气分子反应生成2个水分子
C.向1g碳酸钠粉末中加入1g稀硫酸,得到2g溶液
D.将1
g面粉与1
g水混合后充分振荡,得到2
g面粉溶液
2.NO2中氮元素的化合价为
A.+2
B.-2
C.+4
D.-4
3.下列关于酒精灯的使用方法,正确的是
A.用酒精灯引燃另一只酒精灯
B.用嘴吹灭酒精灯
C.用湿抹布盖灭桌上燃烧的酒精
D.用酒精灯内焰加热
4.汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程如图所示。下列有关说法错误的是( )
A.反应前后铂催化剂的质量不变
B.反应前后分子的种类发生改变
C.反应中二氧化氮与氮气的分子个数之比为1:1
D.“、、”这三种微粒构成的物质均为化合物
5.1854年5月30日,英国战舰“欧罗巴”的船舱里装滿了供战马吃的草料,航行途中突然草料着火,整个战舰瞬间变为火海。则下列有关说法错误的是
A.草料舱没有氧气
B.草料舱通风不好
C.草料发生缓慢氧化积累了大量的热
D.草料温度达到了草料的着火点
6.已知亚硫酸钠对应的亚硫酸盐中硫元素的化合价为+4,则亚硫酸钠的化学式为:(
)
A.H2SO4
B.SO2
C.Na2SO3
D.H2SO3
7.对于方程式
4Al+3O2
2Al2O3的下列说法正确是
(
)
A.铝加氧气等于氧化铝
B.铝跟氧气在点燃的条件下,反应生成氧化铝
C.4个铝原子和3个氧分子等于2个氧化铝分子
D.4个铝原子和6个氧原子等于2个氧化铝分子
8.如图A、B、C是三个与磷燃烧有关的实验.下列说法正确的是( )
A.实验一的目的是探究空气中氧气的含量
B.实验二中,既可利用玻璃管引燃红磷,又可用气球缓冲瓶内压力
C.实验三中,采用了对比实验的研究方法,②③对比说明物质燃烧需要氧气
D.实验三中,采用了对比实验的研究方法,①③对比说明两物质的着火点不同
9.如图所示是某反应的微观小意图,其中不同的球代表不同元素的原子。下列说法正确的是
A.该反应属于置换反应
B.1个X分子中有3个原子
C.反应物分子的个数比为1:3
D.黑球表示的元素化合价在反应前后未改变
10.油炸食物不宜多吃,因为食物长时间煎炸后产生微量的丙烯醛(化学式C3H4O)等有毒物质,会损害人体健康.下列有关的说法不正确的是( )
A.丙烯醛是氧化物
B.丙烯醛是由碳、氢、氧三种元素组成
C.丙烯醛中碳、氢、氧三种元素的原子个数比为3:4:1
D.该物质碳、氢、氧元素的质量比是9:1:4
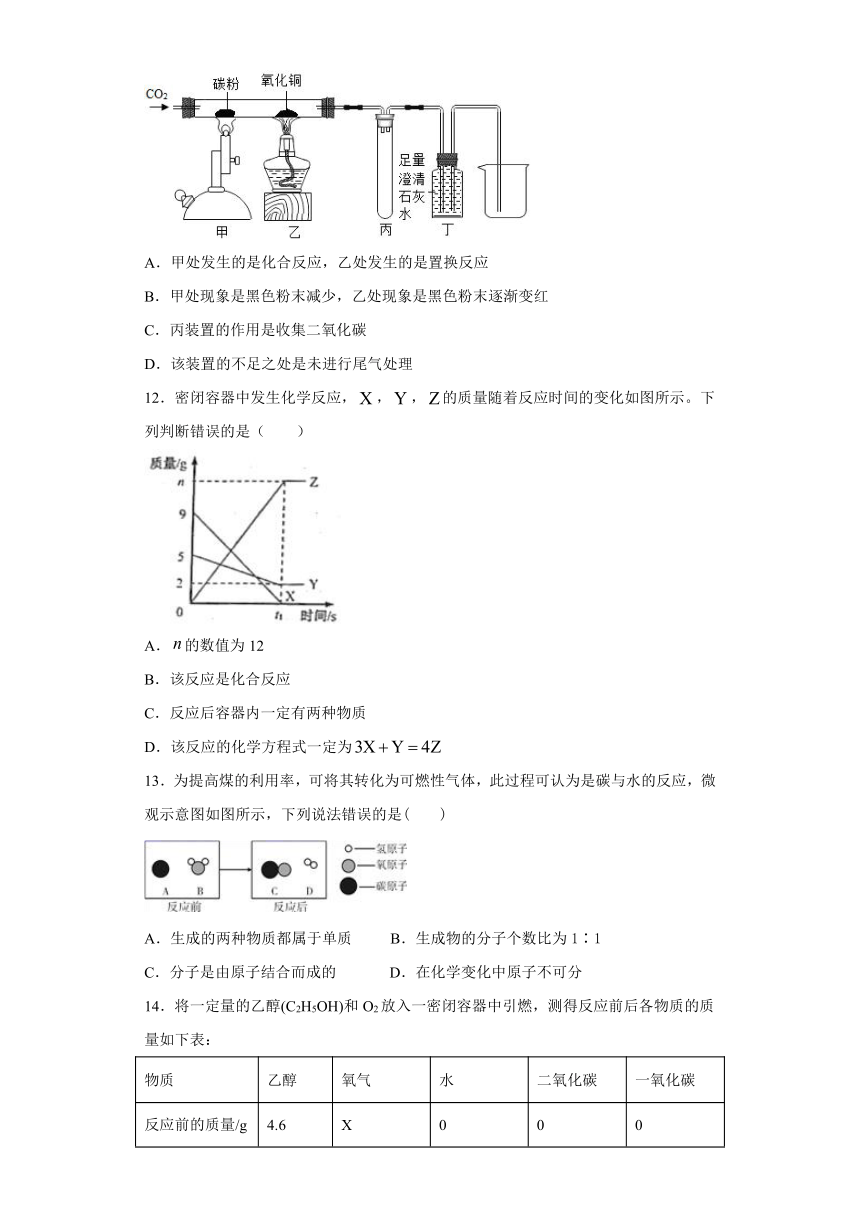
11.如图所示进行有关碳及其氧化物的性质实验,下列说法正确的是( )
A.甲处发生的是化合反应,乙处发生的是置换反应
B.甲处现象是黑色粉末减少,乙处现象是黑色粉末逐渐变红
C.丙装置的作用是收集二氧化碳
D.该装置的不足之处是未进行尾气处理
12.密闭容器中发生化学反应,,,的质量随着反应时间的变化如图所示。下列判断错误的是( )
A.的数值为12
B.该反应是化合反应
C.反应后容器内一定有两种物质
D.该反应的化学方程式一定为
13.为提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,微观示意图如图所示,下列说法错误的是( )
A.生成的两种物质都属于单质
B.生成物的分子个数比为1∶1
C.分子是由原子结合而成的
D.在化学变化中原子不可分
14.将一定量的乙醇(C2H5OH)和O2放入一密闭容器中引燃,测得反应前后各物质的质量如下表:
物质
乙醇
氧气
水
二氧化碳
一氧化碳
反应前的质量/g
4.6
X
0
0
0
反应后的质量/g
0
0
Y
4.4
2.8
下列判断错误的是
A.表中Y的值为5.4
B.在该反应中,生成水和二氧化碳的分子个数比为3:2
C.该反应是氧化反应
D.若起始时氧气的质量为9.6g,则无CO生成
二、填空题
15.清洁、高效的能源是人类永恒的追求。
(1)下列环境问题与燃煤有直接关系的是_____(填字母)
A.酸雨
B.温室效应
C.臭氧层破坏
D.可吸入颗粒物增加
(2)车用乙醇汽油是新型汽车燃料,可以节省化石燃料,减少汽车尾气排放。写出乙醇完
全燃烧的化学方程式_____。
(3)2016
年
11
月,我国新一代长征五号运载火箭首飞成功,长征五号是大推力无毒无污
染绿色环保型运载火箭,全面大量使用液氢/液氧低温推进剂代替有腐蚀性和污染的偏二甲肼/液氧推进剂。氢气作为驱动火箭的理想燃料的原因是_____(填序号)
A.获得氢气的成本低
B.氢气燃烧放出的热量高
C.氢气便于贮存和运输
D.氢气燃烧的产物不污染环境
16.构建知识网络是一种重要的学习方法.
(1)将“分子”、“原子”、“元素”填入如图序号所对应的横线上.
①
②
③
(2)蔗糖是贮藏在某些植物(如蔗糖、甜菜等)中的糖,其化学式为C12H22O11,它由
种元素组成,每个蔗糖分子由
原子构成.
17.化学与我们的生活息息相关。
(1)目前,人类以化石燃料为主要能源。煤、__________和天然气是常见的化石燃料。天然气充分燃烧的化学方程式为__________。
(2)洁净的空气对人类非常重要。下列做法不利于保护大气的是__________(填字母序号)。
A.燃煤取暖改为天然气供暖
B.积极植树造林
C.工业废气处理后排放
D.焚烧落叶和垃圾
(3)为减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。下图为该反应的微观示意图,根据图示回答下列问题。
反应前
反应后
A
B
C
D
以上4种质中不属于氧化物的是__________(填字母序号)。
18.在下列转化关系中,各物质均是初中化学常见物质,其中甲、乙、丙属于单质,A为黑色固体(一种金属氧化物),C属于盐。
回答下列问题:
(1)用化学式表示:A________B________
(2)写出甲单质在生活中的一个用途______________________________________
(3)反应③的化学方程式___________________________________________
19.质量守恒定律对科学发展具有重大意义。
(1)用如图1所示的3个实验验证质量守恒定律,其中不能达到实验目的的是_____(填写字母)。
(2)由质量守恒定律可知,化学反应前后一定不变的是_________(填序号)
①原子种类
②原子数目
③分子种类
④分子数目
⑤元素种类
⑥物质种类
(3)图2是某反应的微观示意图(其中“”和“”分别表示不同的原子),反应后方框内应再填入_____个“
”微粒。
三、推断题
20.A、B、C、D是初中化学中常见的物质。其中A为大理石的主要成分,B、D为氧化物且D为气体。它们之间的相互关系如图所示(图中反应条件及部分反应物和生成物已略去.“一”表示能反应,“→”表示能转化)。
(1)A转化为D的化学方程式_______________。
(2)A转化为B的反应属于______________(填基本反应类型)。
(3)利用物质B转化为C的反应过程中会_______________,常用于自热食品的发热。
(4)既能与B反应,又能与D反应的氧化物是__________________。
21.甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示。
(1)若甲和丁均为单质,丙和乙是组成的元素相同且含有氧元素,则乙的名称为__________,甲的用途是___________。
(2)若甲、乙、丙、丁均含有同一种元素,且甲中含有三种元素,其中一种为金属元素,乙、丙、丁均为氧化物,且丙为黑色固体,则丙→乙的化学方程式为__________,乙→丁的化学方程式为___________。
四、实验题
22.某校化学学习小组设计了如图所示装置,并进行白磷燃烧实验。
(1)当烧杯内的水受热,温度计显示30℃时,打开活塞,锥形瓶内反应的化学方程式是:______,化学反应基本类型是______;白磷未燃烧的原因是______。
(2)随着水温升高,温度计显示45℃时,再次打开活塞,白磷在水里燃烧。常言道,水火不相容。水能灭火的原因是______,而本实验中白磷在水里还能燃烧的原因是______;白磷燃烧的化学方程式是:______。
23.“对比试验”是化学学习中行之有效的思维方法.某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下试验,请你参与并回答问题.
(1)通过试验A,可以说明燃烧的条件之一是
,实验中使用铜片,是利用了铜的
性(填一条物理性质).
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是由于铁与水和
直接接触.欲除去铁锈可用加
浸洗的方法,铁制品除锈时
(填“能”或“不能”)长时间浸在酸溶液中.
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2和NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的.当烧杯①中液体时浓氨水时,烧杯②中的酚酞溶液由无色变为
色;当烧杯①中液体换成浓盐酸,且烧杯②中液体换成滴有酚酞NaOH溶液时,一段时间后,溶液颜色的变化是
。
五、计算题
24.CO2是一种宝贵的碳氧资源。一定条件下,将CO2转变成燃烧甲醇(CH3OH)的原理如下:CO2+3H2CH3OH+H2O。请计算:
(1)甲醇中氢元素的质量分数______________。
(2)生产64吨甲醇可消耗多少吨的CO2______________?
25.某同学要用含CaCO380%的大理石与足量的稀盐酸反应制备1000
mL标准状况下的二氧化碳气体。已知标准状况下的二氧化碳气体的密度为1.98
g/L。假设大理石中的杂质不与稀盐酸反应,计算该同学最少需要准备多少克大理石。
参考答案
1.A
2.C
3.C
4.C
5.A
6.C
7.B
8.A
9.B
10.A
11.B
12.D
13.A
14.B
15.
ABD
C2H5OH+3O2点燃3H2O+2CO2
BD
16.(1)元素,原子,分子;
(2)3,45.
17.
石油
CH4
+2O2
CO2
+2H2O
D
BD
18.
CuO
H2O
供给呼吸或支持燃烧
CuO
+
2HCl
=
CuCl2
+
H2O
19.B
①②⑤
2
20.(或CaCO3
CaO+CO2↑)
分解反应.
放出热量
H2O
(或水)
21.水
做燃料等
或
22.2H2O22H2O+O2↑
分解反应
温度未达到白磷的着火点
可以使可燃物温度降至着火点以下和隔绝氧气
温度达到着火点,同时又与氧气充分接触
4P+5O22P2O5
23.(1)温度达到可燃物的着火点,导热.(2)空气,盐酸或稀硫酸,不能.
(3)2NaOH+CO2═Na2CO3+H2O(4)红色;红色逐渐褪去变为无色.
24.12.5%
88吨
25.5.625g
一、单选题
1.20
°C时,下列能体现“1
+1=2”这一结论的是()
A.将1
g铜粉与1
g铁粉混合,所得混合物质量为2
g
B.点燃条件下,1个氢气分子与1个氧气分子反应生成2个水分子
C.向1g碳酸钠粉末中加入1g稀硫酸,得到2g溶液
D.将1
g面粉与1
g水混合后充分振荡,得到2
g面粉溶液
2.NO2中氮元素的化合价为
A.+2
B.-2
C.+4
D.-4
3.下列关于酒精灯的使用方法,正确的是
A.用酒精灯引燃另一只酒精灯
B.用嘴吹灭酒精灯
C.用湿抹布盖灭桌上燃烧的酒精
D.用酒精灯内焰加热
4.汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程如图所示。下列有关说法错误的是( )
A.反应前后铂催化剂的质量不变
B.反应前后分子的种类发生改变
C.反应中二氧化氮与氮气的分子个数之比为1:1
D.“、、”这三种微粒构成的物质均为化合物
5.1854年5月30日,英国战舰“欧罗巴”的船舱里装滿了供战马吃的草料,航行途中突然草料着火,整个战舰瞬间变为火海。则下列有关说法错误的是
A.草料舱没有氧气
B.草料舱通风不好
C.草料发生缓慢氧化积累了大量的热
D.草料温度达到了草料的着火点
6.已知亚硫酸钠对应的亚硫酸盐中硫元素的化合价为+4,则亚硫酸钠的化学式为:(
)
A.H2SO4
B.SO2
C.Na2SO3
D.H2SO3
7.对于方程式
4Al+3O2
2Al2O3的下列说法正确是
(
)
A.铝加氧气等于氧化铝
B.铝跟氧气在点燃的条件下,反应生成氧化铝
C.4个铝原子和3个氧分子等于2个氧化铝分子
D.4个铝原子和6个氧原子等于2个氧化铝分子
8.如图A、B、C是三个与磷燃烧有关的实验.下列说法正确的是( )
A.实验一的目的是探究空气中氧气的含量
B.实验二中,既可利用玻璃管引燃红磷,又可用气球缓冲瓶内压力
C.实验三中,采用了对比实验的研究方法,②③对比说明物质燃烧需要氧气
D.实验三中,采用了对比实验的研究方法,①③对比说明两物质的着火点不同
9.如图所示是某反应的微观小意图,其中不同的球代表不同元素的原子。下列说法正确的是
A.该反应属于置换反应
B.1个X分子中有3个原子
C.反应物分子的个数比为1:3
D.黑球表示的元素化合价在反应前后未改变
10.油炸食物不宜多吃,因为食物长时间煎炸后产生微量的丙烯醛(化学式C3H4O)等有毒物质,会损害人体健康.下列有关的说法不正确的是( )
A.丙烯醛是氧化物
B.丙烯醛是由碳、氢、氧三种元素组成
C.丙烯醛中碳、氢、氧三种元素的原子个数比为3:4:1
D.该物质碳、氢、氧元素的质量比是9:1:4
11.如图所示进行有关碳及其氧化物的性质实验,下列说法正确的是( )
A.甲处发生的是化合反应,乙处发生的是置换反应
B.甲处现象是黑色粉末减少,乙处现象是黑色粉末逐渐变红
C.丙装置的作用是收集二氧化碳
D.该装置的不足之处是未进行尾气处理
12.密闭容器中发生化学反应,,,的质量随着反应时间的变化如图所示。下列判断错误的是( )
A.的数值为12
B.该反应是化合反应
C.反应后容器内一定有两种物质
D.该反应的化学方程式一定为
13.为提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,微观示意图如图所示,下列说法错误的是( )
A.生成的两种物质都属于单质
B.生成物的分子个数比为1∶1
C.分子是由原子结合而成的
D.在化学变化中原子不可分
14.将一定量的乙醇(C2H5OH)和O2放入一密闭容器中引燃,测得反应前后各物质的质量如下表:
物质
乙醇
氧气
水
二氧化碳
一氧化碳
反应前的质量/g
4.6
X
0
0
0
反应后的质量/g
0
0
Y
4.4
2.8
下列判断错误的是
A.表中Y的值为5.4
B.在该反应中,生成水和二氧化碳的分子个数比为3:2
C.该反应是氧化反应
D.若起始时氧气的质量为9.6g,则无CO生成
二、填空题
15.清洁、高效的能源是人类永恒的追求。
(1)下列环境问题与燃煤有直接关系的是_____(填字母)
A.酸雨
B.温室效应
C.臭氧层破坏
D.可吸入颗粒物增加
(2)车用乙醇汽油是新型汽车燃料,可以节省化石燃料,减少汽车尾气排放。写出乙醇完
全燃烧的化学方程式_____。
(3)2016
年
11
月,我国新一代长征五号运载火箭首飞成功,长征五号是大推力无毒无污
染绿色环保型运载火箭,全面大量使用液氢/液氧低温推进剂代替有腐蚀性和污染的偏二甲肼/液氧推进剂。氢气作为驱动火箭的理想燃料的原因是_____(填序号)
A.获得氢气的成本低
B.氢气燃烧放出的热量高
C.氢气便于贮存和运输
D.氢气燃烧的产物不污染环境
16.构建知识网络是一种重要的学习方法.
(1)将“分子”、“原子”、“元素”填入如图序号所对应的横线上.
①
②
③
(2)蔗糖是贮藏在某些植物(如蔗糖、甜菜等)中的糖,其化学式为C12H22O11,它由
种元素组成,每个蔗糖分子由
原子构成.
17.化学与我们的生活息息相关。
(1)目前,人类以化石燃料为主要能源。煤、__________和天然气是常见的化石燃料。天然气充分燃烧的化学方程式为__________。
(2)洁净的空气对人类非常重要。下列做法不利于保护大气的是__________(填字母序号)。
A.燃煤取暖改为天然气供暖
B.积极植树造林
C.工业废气处理后排放
D.焚烧落叶和垃圾
(3)为减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。下图为该反应的微观示意图,根据图示回答下列问题。
反应前
反应后
A
B
C
D
以上4种质中不属于氧化物的是__________(填字母序号)。
18.在下列转化关系中,各物质均是初中化学常见物质,其中甲、乙、丙属于单质,A为黑色固体(一种金属氧化物),C属于盐。
回答下列问题:
(1)用化学式表示:A________B________
(2)写出甲单质在生活中的一个用途______________________________________
(3)反应③的化学方程式___________________________________________
19.质量守恒定律对科学发展具有重大意义。
(1)用如图1所示的3个实验验证质量守恒定律,其中不能达到实验目的的是_____(填写字母)。
(2)由质量守恒定律可知,化学反应前后一定不变的是_________(填序号)
①原子种类
②原子数目
③分子种类
④分子数目
⑤元素种类
⑥物质种类
(3)图2是某反应的微观示意图(其中“”和“”分别表示不同的原子),反应后方框内应再填入_____个“
”微粒。
三、推断题
20.A、B、C、D是初中化学中常见的物质。其中A为大理石的主要成分,B、D为氧化物且D为气体。它们之间的相互关系如图所示(图中反应条件及部分反应物和生成物已略去.“一”表示能反应,“→”表示能转化)。
(1)A转化为D的化学方程式_______________。
(2)A转化为B的反应属于______________(填基本反应类型)。
(3)利用物质B转化为C的反应过程中会_______________,常用于自热食品的发热。
(4)既能与B反应,又能与D反应的氧化物是__________________。
21.甲、乙、丙、丁均为初中化学常见物质,它们之间的部分转化关系如图所示。
(1)若甲和丁均为单质,丙和乙是组成的元素相同且含有氧元素,则乙的名称为__________,甲的用途是___________。
(2)若甲、乙、丙、丁均含有同一种元素,且甲中含有三种元素,其中一种为金属元素,乙、丙、丁均为氧化物,且丙为黑色固体,则丙→乙的化学方程式为__________,乙→丁的化学方程式为___________。
四、实验题
22.某校化学学习小组设计了如图所示装置,并进行白磷燃烧实验。
(1)当烧杯内的水受热,温度计显示30℃时,打开活塞,锥形瓶内反应的化学方程式是:______,化学反应基本类型是______;白磷未燃烧的原因是______。
(2)随着水温升高,温度计显示45℃时,再次打开活塞,白磷在水里燃烧。常言道,水火不相容。水能灭火的原因是______,而本实验中白磷在水里还能燃烧的原因是______;白磷燃烧的化学方程式是:______。
23.“对比试验”是化学学习中行之有效的思维方法.某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下试验,请你参与并回答问题.
(1)通过试验A,可以说明燃烧的条件之一是
,实验中使用铜片,是利用了铜的
性(填一条物理性质).
(2)对于实验B,一段时间观察试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是由于铁与水和
直接接触.欲除去铁锈可用加
浸洗的方法,铁制品除锈时
(填“能”或“不能”)长时间浸在酸溶液中.
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2和NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的.当烧杯①中液体时浓氨水时,烧杯②中的酚酞溶液由无色变为
色;当烧杯①中液体换成浓盐酸,且烧杯②中液体换成滴有酚酞NaOH溶液时,一段时间后,溶液颜色的变化是
。
五、计算题
24.CO2是一种宝贵的碳氧资源。一定条件下,将CO2转变成燃烧甲醇(CH3OH)的原理如下:CO2+3H2CH3OH+H2O。请计算:
(1)甲醇中氢元素的质量分数______________。
(2)生产64吨甲醇可消耗多少吨的CO2______________?
25.某同学要用含CaCO380%的大理石与足量的稀盐酸反应制备1000
mL标准状况下的二氧化碳气体。已知标准状况下的二氧化碳气体的密度为1.98
g/L。假设大理石中的杂质不与稀盐酸反应,计算该同学最少需要准备多少克大理石。
参考答案
1.A
2.C
3.C
4.C
5.A
6.C
7.B
8.A
9.B
10.A
11.B
12.D
13.A
14.B
15.
ABD
C2H5OH+3O2点燃3H2O+2CO2
BD
16.(1)元素,原子,分子;
(2)3,45.
17.
石油
CH4
+2O2
CO2
+2H2O
D
BD
18.
CuO
H2O
供给呼吸或支持燃烧
CuO
+
2HCl
=
CuCl2
+
H2O
19.B
①②⑤
2
20.(或CaCO3
CaO+CO2↑)
分解反应.
放出热量
H2O
(或水)
21.水
做燃料等
或
22.2H2O22H2O+O2↑
分解反应
温度未达到白磷的着火点
可以使可燃物温度降至着火点以下和隔绝氧气
温度达到着火点,同时又与氧气充分接触
4P+5O22P2O5
23.(1)温度达到可燃物的着火点,导热.(2)空气,盐酸或稀硫酸,不能.
(3)2NaOH+CO2═Na2CO3+H2O(4)红色;红色逐渐褪去变为无色.
24.12.5%
88吨
25.5.625g
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
