一轮复习 第四单元 我们周围的空气
文档属性
| 名称 | 一轮复习 第四单元 我们周围的空气 |  | |
| 格式 | zip | ||
| 文件大小 | 526.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2011-09-24 19:47:58 | ||
图片预览



文档简介
复习 第四单元 我们周围的空气
烟台华侨学校 于梅
复习目标导航
空气的污染和防治2.化学式和化合价及进行化学式的计算3.氧气的性质和实验室制法和原理装置
知识回顾
第一课空气的成分
知识点1:空气的成分
1. 法国化学家______通过实验得出了空气主要是由_____和_______组成的结论。
2. 空气的成分一般来说是比较固定的,按体积分数计算,大约是____占78%,___占21%,稀有气体占_____,二氧化碳占____,其它气体和杂质占______.
(1)氮气:①性质:____色____气味的气体,_____溶于水通常化学性质______.②用途:作____、麻醉剂等。
(2)稀有气体(_________________等气体的总称)①性质:通常都是____色____气味的气体,____________任何物质发生化学反应.②用途:作保护气(因为________________);作电光源(因为其在通电时___________________)。
3.空气中氧气的含量测定实验
(1)铜与氧气
实验前在一侧针管内留20ml空气,然后给装有铜丝的硬质玻璃管加热,同时____交替推拉两个注射器的活塞,玻璃管内的铜丝_____,且装置内气体的量不再进一步变化。停止加热后,待冷却至_____,将气体全部推至一个注射器中,记录下注射器内_____气体的体积。
1.实验结束后,注射器内的气体体积理论上应该减少_______ml ,这是因为:____________________。这个实验说明了___________________。
2.试验的加热过程中,多次缓慢交替推动两个注射器活塞的目的:_______________________________________________________________。
3.误差分析:a如果该小组测得的空气中氧气的含量大于理论值,请你帮助该小组的同学分析出现的误差的原因:_____________________、_______________________、______________________
b.如果该小组测得的空气中氧气的含量小于理论值,请你帮助该小组的同学分析出现的误差的原因。_____________________、__________、____________________________________
(2) 红磷和氧气
1.实验装置如图:
实验现象:红磷剧烈_____,产生______色火焰,
放出大量______,产生大量的_______;冷却至室温后,打开弹簧夹,烧杯中的水沿导气管进入集气瓶中,至约占集气瓶内空间的________.
实验结论:空气中氧气的体积约占_______.
实验原理:红磷燃烧后生成______五氧化二磷,使集气瓶中空气的压强_____,
,______外界大气压。在外界大气压的作用下,烧杯中的水进入集气瓶。
实验推论:a氮气不能_____也不支持燃烧;b集气瓶内水面上升一定高度后,不能继续上升,可以说明氮气____溶于水。
注意事项:a.伸入集气瓶内的速度要快,b.红磷要_____,足以使钟罩中密封的氧气反应完,使测得氧气的体积更接近空气中氧气的实际体积;一定在冷却到室温后打开止水夹。C.不能用镁、铁代替磷,因为___________________;也不能用碳和硫代替红磷,因为_______________.
误差分析:通过实验得出的结论是氧气约占空气总体积的1/5,而在这个实验中,为什么有时气体减少的体积小于1/5呢?导致结果偏低的原因可能有: (1)__________;
___________________,使进入瓶内的水的体积减少;(3)________(如塞子未塞紧、燃烧匙与橡皮塞之间有缝隙等),使外界空气进入瓶内。
该实验中有时气体减少的体积大于1/5,又是为什么呢?原因可能是(1)点燃红磷后,插入燃烧匙时,瓶塞子塞得太慢,使得瓶中空气受热膨胀,部分空气溢出。(2)实验开始时,____或______止水夹。
注意:测定空气中氧气的含量时要选用一种只与____________________________不与_________________,消耗掉氧气而且生成__________,对容器内的气压无影响,使容器内的气压小于外界大气压。
知识点2:关注空气质量
主要是排放到空气中的____和_____。其中计入空气污染指标的项目为_____、______、_____、________等。
危害:严重损害人体健康,影响农作物生长、破坏生态环境,其中全球气候_____,______破坏,和______等都与空气污染有关。
防治措施
改善燃料结构;(2)对_____回收处理,达标排放(3)使用_____燃料,减少化石燃料的使用(4)植树造林,增大绿树面积。
第二节:物质组成的表示
知识点1:化学式
定义:用___________表示物质组成的式子。
写法:
单质化学式:①用元素符号来表示,如:___________②双原子构成的分子,如:______________________。
化合物:_____在前_______在后。NH3、CH4除外。
含义:
表示一种_______
宏观 表示组成物质的________
表示这种物质的一个__
微观 表示分子的______(有数的对有数,无数对无数)
周位数字的含义:
化学式前面的数字表示_______
化学式中元素符号右下角的数字表示________.
知识点2:化合价与化学式
定义:一种元素一定数目的原子根其他元素一定数目的原子化合时的性质,叫做这种元素的化合价。
元素的化合价有_____价和_______价之分。
2.化合价规则:在化合物中,其正、负化合价的代数和均为_____。
3.表示方法:通常在元素符号 ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网" \t "_blank )或原子团的正上方用+n、-n表示,n为1时不省略,如
表示________.
4.一般规律:
(1)常用化合价口诀:________正一价 ,_________正二价 ,铝是正____氧____,
氯____价最常见 ,硫有负____正_____ , 正二正三___可变 ,正__、__铜_____、_____碳,单质零价永不变,其他元素有变价,先死后活来计算.
(2) 常用根的化合价口诀:负一硝酸____根,负二____碳酸根, 负三记住_____,
正一价是____。
(3) 通常氧元素通常显___价,氢元素通常显___价。
(4金属元素跟非金属元素化合时,金属元素显__价,非金属元素显__价(一般来说正价写在前面,负价写后面)
(5) 一些元素在同种物质中可显不同的化合价。如NH4NO3氮元素的化合价为___.
(6) 元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为_____.
(7) 化合价取决于该元素原子的最外层电子数,金属元素的最高正价=________,非金属元素的最高正价=_______________,非金属元素的负价数=______________。
知识点3. 物质组成的表示
相对分子质量:化学式中各原子的_____________的总和,就是相对分子质量。
计算物质组成元素的质量比是_________________________________的乘积之比。
计算物质中某元素的质量分数
原子个数×( )
物质中某元素的质量分数=---------------------------×100%
相对分子质量
计算一定量某化合物中某一元素的质量
某元素质量=化合物质量×化合物中该元素的_______.
例题:一、有关化合价
1、冶炼金属钛的钛铁矿主要成分的化学式为FeTiOx,其中铁元素和钛元素的化合价均显+3价。则x为( )
A、2 B、3 C、4 D、6
2、已知铝的化合价为+3价,硫酸根的化合价为-2价,试写出硫酸铝的化学式。
二、有关化学式
蛋白质在人体肠胃内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸分子中C H O N各原子个数比为 ,质量比_____________
(2)丙氨酸的相对分子质量是 ,氮元素的质量分数为 (计算结果精确到0.1%)
(3)合格奶粉每100g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%。现测定某奶粉每100g中含有氮元素的质量为2g。请通过计算多该奶粉是否属于合格奶粉。
第三节:活泼的氧气
知识点1. 物理性质:
通常情况下,氧气是一种__色_____味的气体。______溶于水,比空气_____,在降温加压情况下,氧气可变为____色液体或_____色雪花状固体。
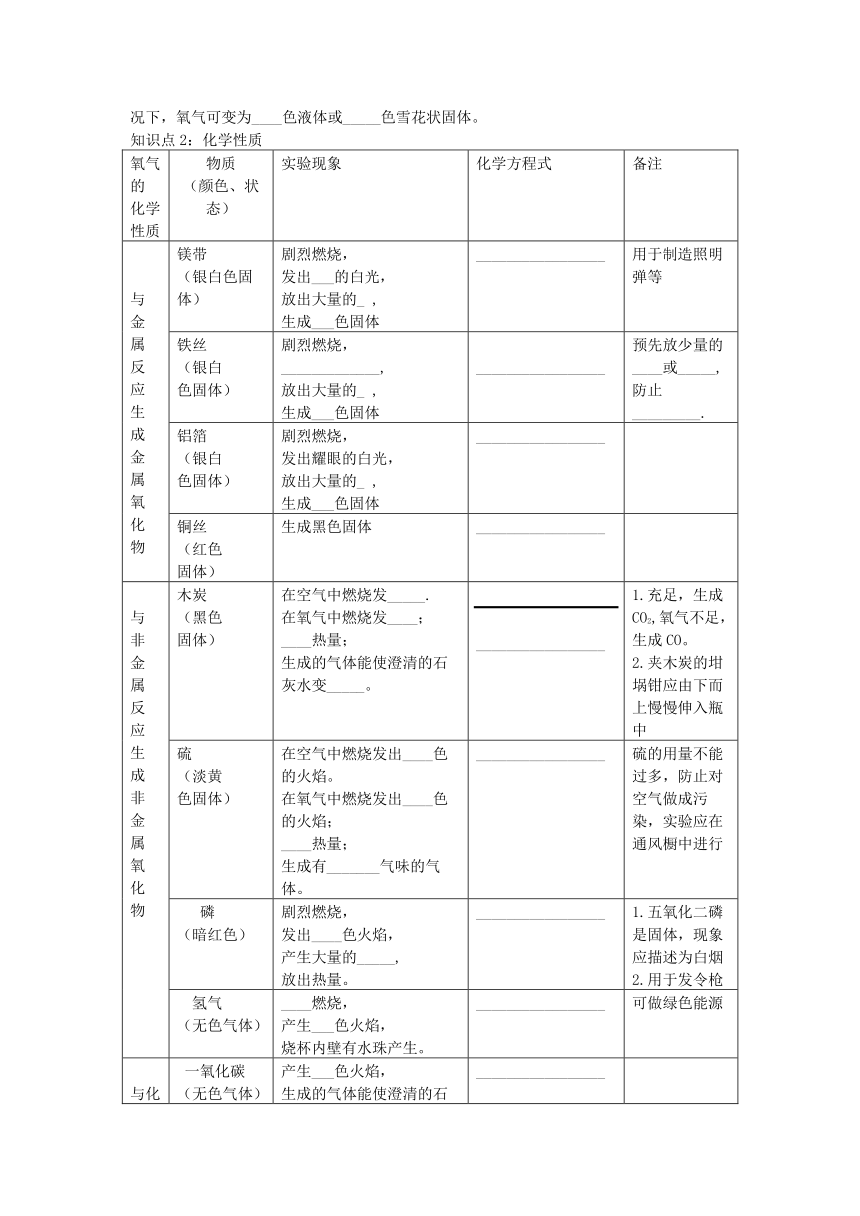
知识点2:化学性质
氧气的化学性质 物质(颜色、状态) 实验现象 化学方程式 备注
与金属反应生成金属氧化物 镁带(银白色固体) 剧烈燃烧,发出___的白光,放出大量的_ ,生成___色固体 _________________ 用于制造照明弹等
铁丝(银白色固体) 剧烈燃烧,_____________,放出大量的_ ,生成___色固体 _________________ 预先放少量的____或_____,防止_________.
铝箔(银白色固体) 剧烈燃烧,发出耀眼的白光,放出大量的_ ,生成___色固体 _________________
铜丝(红色固体) 生成黑色固体 _________________
与非金属反应生成非金属氧化物 木炭(黑色固体) 在空气中燃烧发_____.在氧气中燃烧发____;____热量;生成的气体能使澄清的石灰水变_____。 _________________ 1.充足,生成CO2,氧气不足,生成CO。2.夹木炭的坩埚钳应由下而上慢慢伸入瓶中
硫(淡黄色固体) 在空气中燃烧发出____色的火焰。在氧气中燃烧发出____色的火焰;____热量;生成有_______气味的气体。 _________________ 硫的用量不能过多,防止对空气做成污染,实验应在通风橱中进行
磷(暗红色) 剧烈燃烧,发出____色火焰,产生大量的_____,放出热量。 _________________ 1.五氧化二磷是固体,现象应描述为白烟2.用于发令枪
氢气(无色气体) ____燃烧,产生___色火焰,烧杯内壁有水珠产生。 _________________ 可做绿色能源
与化合物反应 一氧化碳(无色气体) 产生___色火焰,生成的气体能使澄清的石灰水变_____。 _________________
甲烷(无色气体) 产生___色火焰______________,___________________. _________________
酒精(无色液体) 产生___色火焰______________,___________________. _________________
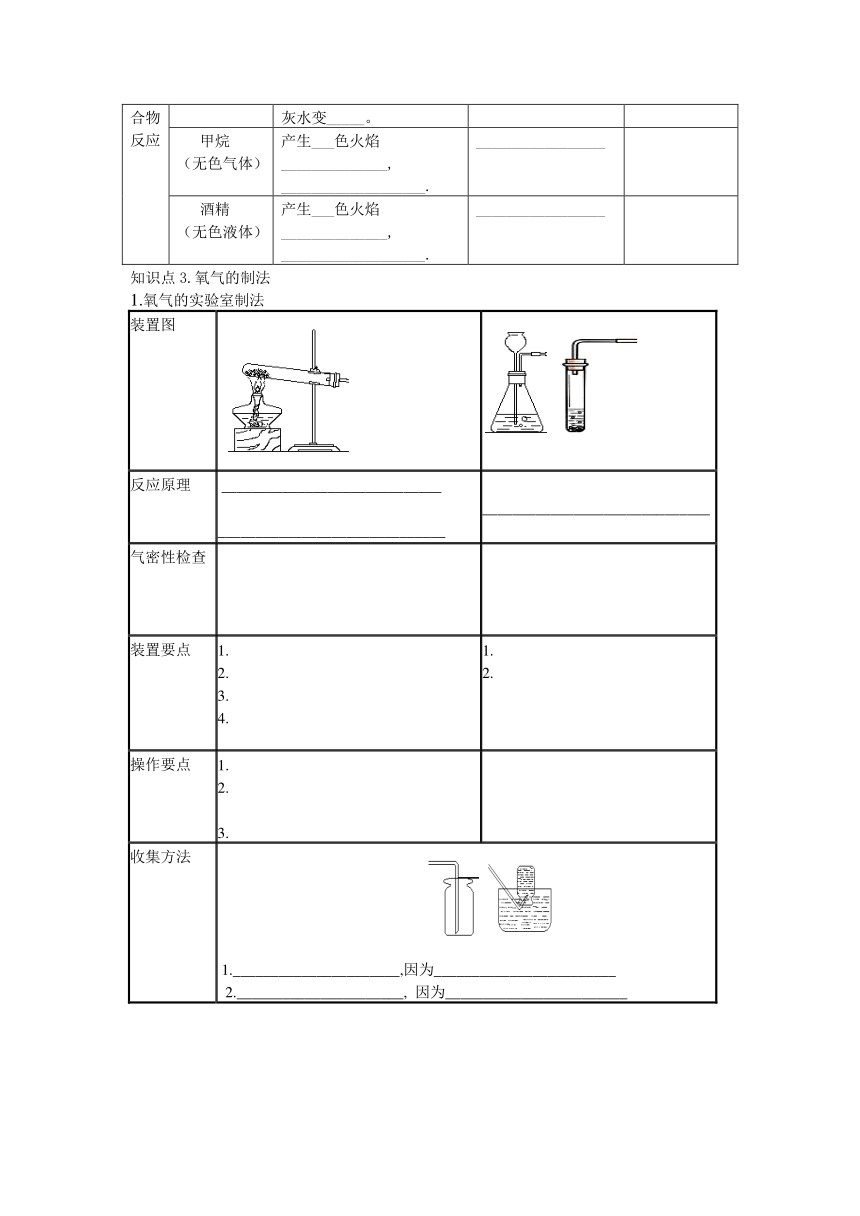
知识点3.氧气的制法
1.氧气的实验室制法
装置图
反应原理 ___________________________________________________________ ______________________________
气密性检查
装置要点 1.2. 3.4. 1.2.
操作要点 1.2.3.
收集方法 1.______________________,因为________________________2.______________________, 因为________________________
验满方法 1._____________________________________________________2._________________________________________________________
2.工业制法
①方法:_______________________________
②步骤:空气 液态空气 氮气 氧气
知识点四:催化剂
1.定义:在化学反应中能_____其他化学反应速率,而本身的____和________在反应前后都没有改变的物质。
2.注意:(1)催化剂只能改变化学反应速率,不能增大或减少______的质量;(2)对于指定的化学反应,没有催化剂,并不意味着该反应不能发生,只是反应速率_____.(3)催化剂在反应中一般参入了反应。
知识点5:氧气的用途
1.___________________________
2.____________________________
基础训练:
1.人们对空气污染程度的关注不断加强,我市也是空气
污染较严重的城市之一。下列气体中可造成空气污染的有:①NO2、②NO、③CO、④CO2、⑤SO2
A.①②③⑤ B.②③④⑤ C.①②③④ D.①②④⑤
2.人类需要洁净的空气。目前我国城市空气质量日报中的污染物不包括( )
A、可吸入颗粒物 B、二氧化碳 C、二氧化氮 D、二氧化硫
3. 北京奥运会若用大型遥控飞艇作广告。为了安全,艇内充入的气体最好是 ( )
A.氢气 B.氧气 C.氦气 D.二氧化碳
4.一氧化氮(NO)虽然有毒,但由于其在医疗上有重要用途而享有“明星分子”的美誉。下列有关一氧化氮的叙述正确的是
A.一氧化氮的相对分子质量为30g
B.一氧化氮由氮元素和氧元素组成
C.一氧化氮由一个氮原子和一个氧原子构成
D.一氧化氮中氮元素和氧元素的质量比为1:1
5.用化学符号填空:(1)2个氢原子______;3个二氧化氮分子______;带两个单位负电荷的硫离子______;镁单质______;硝酸钾中氮元素的化合价____________1个钠离子 ;两个氢分子 ;氧化铝 ;空气中体积分数最大的物质 ;两个硝酸根离子 ;保持氢气化学性质的最小微粒 ;世界年产量第一位的金属 ;亚铁离子_______;氢氧根离子
(2)写成下列化学符合中数字“3”的含义:
3Cu表示 NH3(氨气)表示
6.(苏州)氧气是空气的主要成分之一,有关氧气说法错误的是( )
A.用带火星的木条可以检验氧气 B.用加热高锰酸钾的方法可以制取氧气
C.鱼类能在水中生活,证明氧气易溶于水 D.铁丝能在氧气中燃烧,火星四溅,产生黑色固体
7.1777年舍勒在《火与空气》一书中指出:空气由两种性质不同的“火空气”和“浊空气”组成,其中“火空气”可以帮助燃烧,维持生命。下列物质不能与“火空气”发生反应的是( )
A.木炭 B.石蜡 C.烧碱 D.乙醇
8.科学家发现,从红豆杉中提取的紫杉醇(C47H51NO14)是一种抗癌新药;1994年之后,科学家在实验室里人工合成了紫杉醇。假如人工合成的紫杉醇与天然紫杉醇的成分和结构完全相同,你认为使用天然紫杉醇的疗效是否比人工合成的紫杉醇更好? (填“是”或“不是”),据此计算紫杉醇中的碳、氢、氮、氧元素的质量比是 。
9.食盐的主要成分是氯化钠,请回答下列问题:
(1)氯化钠的化学式为 。氯化钠中氯元素的化合价为 价,
(2)图A为元素周期表中提供的有关钠元素的信息,钠原子的质子数为; ;
(3)氯化钠是由钠离子和氯离子构成的,右图中能用来表示钠离子结构的是 (填序号),符号钠离子符号表示为 。
10.(广东)双氧水常用于消毒、漂白等,它是过氧化氢(H2O2)的水溶液。在盛有少量MnO2的容器中,加入含H2O2 30%的双氧水,在常温下即可迅速分解放出氧气:2H2O2 MnO2 2H2O+O2↑ 。实验室可用此方法制取氧气。
试回答下列问题:
(1)反应的发生装置应选用 (A或B)装置。
(2)欲分离反应后混合物中的。MnO2用到的玻璃仪器有: 。
(3)与加热氯酸钾和二氧化锰混合物制取氧气的方法相比较,实验室用双氧水制取氧气的优点是(写出一种就行) 。
11.四氟乙烯(化学式为C2F4)是常见的一种物质,可用于制家用不粘锅的保护膜,它还可能成为未来的人造血液,作为血液的替代品。
(1)四氟乙烯中碳元素的质量分数为 。
(2)根据四氟乙烯的化学式,你还能得到哪些信息 (请写出两条)
_______________ 、_____________ 。
热点导练
1、(10乐山20)不少中小学生喜食油炸薯条。但是,油炸薯条易产生一种叫丙烯酰胺的致癌物,长期摄入易引发多种疾病,其结构为:,据此,不能推断出丙烯酰胺的
A.组成元素 B.密度、状态 C.化学式 D.相对分子质量
2.豆浆被成为“植物奶”,其中还有异黄酮(C15H10O2)具有防癌功能,下列关于异黄酮说法正确的是
A.异黄酮中共含有27个原子 B.异黄酮中碳元素的质量分数最大
C.一个异黄酮分子中含有一个氧分子 D.异黄酮中C、H、O三种元素的质量比为15:10:2
3.2010年4月玉树地震后,防疫人员使用各种消毒剂对环境进行消毒。亚氯酸钠(NaClO2)是一种重要的消毒剂。下列说法不正确的是
A 闻到消毒剂气味是因为微粒在不断运动 B NaClO2是由NaCl和O2构成的
C NaClO2中钠元素质量分数为25.4% D NaClO2中氯元素的化合价为+3
4. 从C、H、O、N、S、P、Na、Fe、Ba、Cu等10种元素中选择恰当的元素,用离子符号、化学式或化学方程式按下列要求填空:
(1)用于制造电线电缆的是 ;(2)天然气的主要成分是
(3)会形成酸雨的气体是 ;(4)中学化学实验室中最常用的溶剂是
(5)能溶于水形成蓝色溶液的盐是 (6)硫酸钠中的阴离子 ;氯化亚铁中的阳离子 ;能使木材、纸张变黑的酸 ;溶于水后显碱性的气体 ;用于造纸、洗涤剂的盐 。(7)一种暗红色的固体燃烧生成大量的白烟 。(8)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理 。(9)有沉淀生成的中和反应 。
(10)在人体组织里,葡萄糖在酶的作用下发生缓慢氧化 。
5.纽扣电池常用于手表等精密电子产品。下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg
(1)该反应中,Zn的化合价由__________变为___________.
(2)将该反应中的反应物进行简单分类,则下面横线上的物质是(填名称):
单质:_____________
纯净物
金属氧化物:_____________
(3)该电池中通常还加入炭粉,是因为炭具有良好的___________性。
(4)废旧的纽扣电池不能随意丢弃,应__________________________进行回收。
6.小明和小红对市场上销售的一种真空充气包装的形如小枕头“蛋黄派”发生了兴趣,如下图所示。他们查阅资料获知:这种真空充气包装技术,即将食品装入包装袋,抽出包装袋内空气,再充入某种气体,然后封口。它能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形。那么,这是什么气体呢?小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出操作步骤(方法、现象和结论):______________________________________________________。
(2)你认为食品充气包装,对所充气体的要求是:_______、________、__________、________。
7.小红同学利用如图所示装置测定空气中氧气的体积分数。硬质玻璃管内装有细铜丝,且两个注射器组成的密闭系统内留有30mL室温下的空气。回答下列问题:
(1)小红在实验中出现的现象是:细铜丝由__色变为____色;冷却后,密闭容器内气体的体积约为___mL
(2)小红在实验过程中,交替推动两注射器的目的是______________。
(3)最后小红发现自己测出的氧气的体积分数偏小,请你帮他分析一下原因_______。
(4)小明用B装置测定空气中氧气的含量,反应原理是_________________,实验前在集气瓶内加入少量的水,并做上记号。下列说法中,不正确的是________________。
A.实验时红磷一定过量 B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹 D.最终进入瓶中水的体积约为
氧气的体积
(5)集气瓶中剩余的气体主要是哪种气体?该实验说明这种气体
具有哪些性质?_______,__________________________________.
(6)通过上面的两个实验,你学到的测量混合物中某成分含量的方法是
。
8.下表是国家对“饮酒驾车”和“醉酒驾车”的界定标准:
饮酒驾车 20毫克/100毫升≤血液中的酒精含量<80毫克/100毫升
醉酒驾车 血液中的酒精含量≥80毫克/100毫升
白酒、红酒和啤酒中均含有乙醇(俗称酒精,化学式为C2H5OH),饮酒后酒精可进入人体血液中。请回答下列问题:
(1)乙醇(C2H5OH)中碳、氢、氧元素的质量比是C﹕H﹕O= ;
(2)饮酒会使人的 系统过度兴奋或麻痹抑制,容易引发交通事故。某人饮酒后驾车,被交警发现,经测定其每100毫升血液中酒精含量为93毫克,属于 驾车;
(3)在治理酒后驾车中,酒精检测仪发挥了重要作用。如图甲是酒精检测仪,图乙是检测仪的简化电路图,R0为定值电阻,R为气敏电阻,该电阻阻值与酒精气体含量的关系如图丙,如果图乙中电流表示数越大,说明司机吹出的气体中酒精含量就 。
9、(10汕头24)(8分)右图是某品牌补铁剂的标签。
请回答:(1)富马酸亚铁中含有 种元素, C、H、Fe、O原子个数比为 。(2)富马酸亚铁的相对分子质量为 。(3)若每次服用1包该补铁剂,摄入铁元素的质量为 mg(计算结果取整数)。
10.CuSO4溶液对过氧化氢的分解具有催化作用。有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。
(1)请你帮助他们完成实验报告:
实验过程 实验现象 实验结论
在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。 FeCl3溶液可以催化分解H2O2
(2)已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是 同学的猜想, 理由是
(3)同学们对余下的两个猜想,用实验进行了探究。请你仔细分析后填表:
实验过程 实验现象 结论
向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管。 无明显现象
向盛有5ml5%的H2O2溶液的试管中加入少量的 ,并把带火星的木条伸入试管。
11.小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种叫过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙来制取氧气。
[提出问题]过氧化钙可否用于制取氧气?
[查阅资料]部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,可作增氧剂、杀菌剂等。
[猜想与验证]
(1)小明依据___________________________________________,提出猜想Ⅰ。
猜想Ⅰ:加热过氧化钙可制取氧气。
实验装置 实验主要过程
①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到_________,松开手后,有液体进入导管。②加入过氧化钙,加热,导管口有大量气泡昌出。③收集满一瓶气体。④停止加热。熄灭酒精灯前,应______________ 。⑤检验气体,方法是________________________ 。
实验结论:加热过氧化钙可制取氧气。
分析与反思:
①虽然没有快速收集到大量氧气,由此实验现象,小明认为农民用过氧化钙作增氧剂的主要原因是_________________________ 。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议是 _________________ 。
以上建议是否可行,还需进一步通过实验验证。
H2O
+1
-183℃
-196℃
降温加压
B装置
烟台华侨学校 于梅
复习目标导航
空气的污染和防治2.化学式和化合价及进行化学式的计算3.氧气的性质和实验室制法和原理装置
知识回顾
第一课空气的成分
知识点1:空气的成分
1. 法国化学家______通过实验得出了空气主要是由_____和_______组成的结论。
2. 空气的成分一般来说是比较固定的,按体积分数计算,大约是____占78%,___占21%,稀有气体占_____,二氧化碳占____,其它气体和杂质占______.
(1)氮气:①性质:____色____气味的气体,_____溶于水通常化学性质______.②用途:作____、麻醉剂等。
(2)稀有气体(_________________等气体的总称)①性质:通常都是____色____气味的气体,____________任何物质发生化学反应.②用途:作保护气(因为________________);作电光源(因为其在通电时___________________)。
3.空气中氧气的含量测定实验
(1)铜与氧气
实验前在一侧针管内留20ml空气,然后给装有铜丝的硬质玻璃管加热,同时____交替推拉两个注射器的活塞,玻璃管内的铜丝_____,且装置内气体的量不再进一步变化。停止加热后,待冷却至_____,将气体全部推至一个注射器中,记录下注射器内_____气体的体积。
1.实验结束后,注射器内的气体体积理论上应该减少_______ml ,这是因为:____________________。这个实验说明了___________________。
2.试验的加热过程中,多次缓慢交替推动两个注射器活塞的目的:_______________________________________________________________。
3.误差分析:a如果该小组测得的空气中氧气的含量大于理论值,请你帮助该小组的同学分析出现的误差的原因:_____________________、_______________________、______________________
b.如果该小组测得的空气中氧气的含量小于理论值,请你帮助该小组的同学分析出现的误差的原因。_____________________、__________、____________________________________
(2) 红磷和氧气
1.实验装置如图:
实验现象:红磷剧烈_____,产生______色火焰,
放出大量______,产生大量的_______;冷却至室温后,打开弹簧夹,烧杯中的水沿导气管进入集气瓶中,至约占集气瓶内空间的________.
实验结论:空气中氧气的体积约占_______.
实验原理:红磷燃烧后生成______五氧化二磷,使集气瓶中空气的压强_____,
,______外界大气压。在外界大气压的作用下,烧杯中的水进入集气瓶。
实验推论:a氮气不能_____也不支持燃烧;b集气瓶内水面上升一定高度后,不能继续上升,可以说明氮气____溶于水。
注意事项:a.伸入集气瓶内的速度要快,b.红磷要_____,足以使钟罩中密封的氧气反应完,使测得氧气的体积更接近空气中氧气的实际体积;一定在冷却到室温后打开止水夹。C.不能用镁、铁代替磷,因为___________________;也不能用碳和硫代替红磷,因为_______________.
误差分析:通过实验得出的结论是氧气约占空气总体积的1/5,而在这个实验中,为什么有时气体减少的体积小于1/5呢?导致结果偏低的原因可能有: (1)__________;
___________________,使进入瓶内的水的体积减少;(3)________(如塞子未塞紧、燃烧匙与橡皮塞之间有缝隙等),使外界空气进入瓶内。
该实验中有时气体减少的体积大于1/5,又是为什么呢?原因可能是(1)点燃红磷后,插入燃烧匙时,瓶塞子塞得太慢,使得瓶中空气受热膨胀,部分空气溢出。(2)实验开始时,____或______止水夹。
注意:测定空气中氧气的含量时要选用一种只与____________________________不与_________________,消耗掉氧气而且生成__________,对容器内的气压无影响,使容器内的气压小于外界大气压。
知识点2:关注空气质量
主要是排放到空气中的____和_____。其中计入空气污染指标的项目为_____、______、_____、________等。
危害:严重损害人体健康,影响农作物生长、破坏生态环境,其中全球气候_____,______破坏,和______等都与空气污染有关。
防治措施
改善燃料结构;(2)对_____回收处理,达标排放(3)使用_____燃料,减少化石燃料的使用(4)植树造林,增大绿树面积。
第二节:物质组成的表示
知识点1:化学式
定义:用___________表示物质组成的式子。
写法:
单质化学式:①用元素符号来表示,如:___________②双原子构成的分子,如:______________________。
化合物:_____在前_______在后。NH3、CH4除外。
含义:
表示一种_______
宏观 表示组成物质的________
表示这种物质的一个__
微观 表示分子的______(有数的对有数,无数对无数)
周位数字的含义:
化学式前面的数字表示_______
化学式中元素符号右下角的数字表示________.
知识点2:化合价与化学式
定义:一种元素一定数目的原子根其他元素一定数目的原子化合时的性质,叫做这种元素的化合价。
元素的化合价有_____价和_______价之分。
2.化合价规则:在化合物中,其正、负化合价的代数和均为_____。
3.表示方法:通常在元素符号 ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网" \t "_blank )或原子团的正上方用+n、-n表示,n为1时不省略,如
表示________.
4.一般规律:
(1)常用化合价口诀:________正一价 ,_________正二价 ,铝是正____氧____,
氯____价最常见 ,硫有负____正_____ , 正二正三___可变 ,正__、__铜_____、_____碳,单质零价永不变,其他元素有变价,先死后活来计算.
(2) 常用根的化合价口诀:负一硝酸____根,负二____碳酸根, 负三记住_____,
正一价是____。
(3) 通常氧元素通常显___价,氢元素通常显___价。
(4金属元素跟非金属元素化合时,金属元素显__价,非金属元素显__价(一般来说正价写在前面,负价写后面)
(5) 一些元素在同种物质中可显不同的化合价。如NH4NO3氮元素的化合价为___.
(6) 元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为_____.
(7) 化合价取决于该元素原子的最外层电子数,金属元素的最高正价=________,非金属元素的最高正价=_______________,非金属元素的负价数=______________。
知识点3. 物质组成的表示
相对分子质量:化学式中各原子的_____________的总和,就是相对分子质量。
计算物质组成元素的质量比是_________________________________的乘积之比。
计算物质中某元素的质量分数
原子个数×( )
物质中某元素的质量分数=---------------------------×100%
相对分子质量
计算一定量某化合物中某一元素的质量
某元素质量=化合物质量×化合物中该元素的_______.
例题:一、有关化合价
1、冶炼金属钛的钛铁矿主要成分的化学式为FeTiOx,其中铁元素和钛元素的化合价均显+3价。则x为( )
A、2 B、3 C、4 D、6
2、已知铝的化合价为+3价,硫酸根的化合价为-2价,试写出硫酸铝的化学式。
二、有关化学式
蛋白质在人体肠胃内与水反应,最终生成氨基酸被人体吸收。丙氨酸(化学式为C3H7O2N)就是其中的一种。请回答下列问题:
(1)丙氨酸分子中C H O N各原子个数比为 ,质量比_____________
(2)丙氨酸的相对分子质量是 ,氮元素的质量分数为 (计算结果精确到0.1%)
(3)合格奶粉每100g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%。现测定某奶粉每100g中含有氮元素的质量为2g。请通过计算多该奶粉是否属于合格奶粉。
第三节:活泼的氧气
知识点1. 物理性质:
通常情况下,氧气是一种__色_____味的气体。______溶于水,比空气_____,在降温加压情况下,氧气可变为____色液体或_____色雪花状固体。
知识点2:化学性质
氧气的化学性质 物质(颜色、状态) 实验现象 化学方程式 备注
与金属反应生成金属氧化物 镁带(银白色固体) 剧烈燃烧,发出___的白光,放出大量的_ ,生成___色固体 _________________ 用于制造照明弹等
铁丝(银白色固体) 剧烈燃烧,_____________,放出大量的_ ,生成___色固体 _________________ 预先放少量的____或_____,防止_________.
铝箔(银白色固体) 剧烈燃烧,发出耀眼的白光,放出大量的_ ,生成___色固体 _________________
铜丝(红色固体) 生成黑色固体 _________________
与非金属反应生成非金属氧化物 木炭(黑色固体) 在空气中燃烧发_____.在氧气中燃烧发____;____热量;生成的气体能使澄清的石灰水变_____。 _________________ 1.充足,生成CO2,氧气不足,生成CO。2.夹木炭的坩埚钳应由下而上慢慢伸入瓶中
硫(淡黄色固体) 在空气中燃烧发出____色的火焰。在氧气中燃烧发出____色的火焰;____热量;生成有_______气味的气体。 _________________ 硫的用量不能过多,防止对空气做成污染,实验应在通风橱中进行
磷(暗红色) 剧烈燃烧,发出____色火焰,产生大量的_____,放出热量。 _________________ 1.五氧化二磷是固体,现象应描述为白烟2.用于发令枪
氢气(无色气体) ____燃烧,产生___色火焰,烧杯内壁有水珠产生。 _________________ 可做绿色能源
与化合物反应 一氧化碳(无色气体) 产生___色火焰,生成的气体能使澄清的石灰水变_____。 _________________
甲烷(无色气体) 产生___色火焰______________,___________________. _________________
酒精(无色液体) 产生___色火焰______________,___________________. _________________
知识点3.氧气的制法
1.氧气的实验室制法
装置图
反应原理 ___________________________________________________________ ______________________________
气密性检查
装置要点 1.2. 3.4. 1.2.
操作要点 1.2.3.
收集方法 1.______________________,因为________________________2.______________________, 因为________________________
验满方法 1._____________________________________________________2._________________________________________________________
2.工业制法
①方法:_______________________________
②步骤:空气 液态空气 氮气 氧气
知识点四:催化剂
1.定义:在化学反应中能_____其他化学反应速率,而本身的____和________在反应前后都没有改变的物质。
2.注意:(1)催化剂只能改变化学反应速率,不能增大或减少______的质量;(2)对于指定的化学反应,没有催化剂,并不意味着该反应不能发生,只是反应速率_____.(3)催化剂在反应中一般参入了反应。
知识点5:氧气的用途
1.___________________________
2.____________________________
基础训练:
1.人们对空气污染程度的关注不断加强,我市也是空气
污染较严重的城市之一。下列气体中可造成空气污染的有:①NO2、②NO、③CO、④CO2、⑤SO2
A.①②③⑤ B.②③④⑤ C.①②③④ D.①②④⑤
2.人类需要洁净的空气。目前我国城市空气质量日报中的污染物不包括( )
A、可吸入颗粒物 B、二氧化碳 C、二氧化氮 D、二氧化硫
3. 北京奥运会若用大型遥控飞艇作广告。为了安全,艇内充入的气体最好是 ( )
A.氢气 B.氧气 C.氦气 D.二氧化碳
4.一氧化氮(NO)虽然有毒,但由于其在医疗上有重要用途而享有“明星分子”的美誉。下列有关一氧化氮的叙述正确的是
A.一氧化氮的相对分子质量为30g
B.一氧化氮由氮元素和氧元素组成
C.一氧化氮由一个氮原子和一个氧原子构成
D.一氧化氮中氮元素和氧元素的质量比为1:1
5.用化学符号填空:(1)2个氢原子______;3个二氧化氮分子______;带两个单位负电荷的硫离子______;镁单质______;硝酸钾中氮元素的化合价____________1个钠离子 ;两个氢分子 ;氧化铝 ;空气中体积分数最大的物质 ;两个硝酸根离子 ;保持氢气化学性质的最小微粒 ;世界年产量第一位的金属 ;亚铁离子_______;氢氧根离子
(2)写成下列化学符合中数字“3”的含义:
3Cu表示 NH3(氨气)表示
6.(苏州)氧气是空气的主要成分之一,有关氧气说法错误的是( )
A.用带火星的木条可以检验氧气 B.用加热高锰酸钾的方法可以制取氧气
C.鱼类能在水中生活,证明氧气易溶于水 D.铁丝能在氧气中燃烧,火星四溅,产生黑色固体
7.1777年舍勒在《火与空气》一书中指出:空气由两种性质不同的“火空气”和“浊空气”组成,其中“火空气”可以帮助燃烧,维持生命。下列物质不能与“火空气”发生反应的是( )
A.木炭 B.石蜡 C.烧碱 D.乙醇
8.科学家发现,从红豆杉中提取的紫杉醇(C47H51NO14)是一种抗癌新药;1994年之后,科学家在实验室里人工合成了紫杉醇。假如人工合成的紫杉醇与天然紫杉醇的成分和结构完全相同,你认为使用天然紫杉醇的疗效是否比人工合成的紫杉醇更好? (填“是”或“不是”),据此计算紫杉醇中的碳、氢、氮、氧元素的质量比是 。
9.食盐的主要成分是氯化钠,请回答下列问题:
(1)氯化钠的化学式为 。氯化钠中氯元素的化合价为 价,
(2)图A为元素周期表中提供的有关钠元素的信息,钠原子的质子数为; ;
(3)氯化钠是由钠离子和氯离子构成的,右图中能用来表示钠离子结构的是 (填序号),符号钠离子符号表示为 。
10.(广东)双氧水常用于消毒、漂白等,它是过氧化氢(H2O2)的水溶液。在盛有少量MnO2的容器中,加入含H2O2 30%的双氧水,在常温下即可迅速分解放出氧气:2H2O2 MnO2 2H2O+O2↑ 。实验室可用此方法制取氧气。
试回答下列问题:
(1)反应的发生装置应选用 (A或B)装置。
(2)欲分离反应后混合物中的。MnO2用到的玻璃仪器有: 。
(3)与加热氯酸钾和二氧化锰混合物制取氧气的方法相比较,实验室用双氧水制取氧气的优点是(写出一种就行) 。
11.四氟乙烯(化学式为C2F4)是常见的一种物质,可用于制家用不粘锅的保护膜,它还可能成为未来的人造血液,作为血液的替代品。
(1)四氟乙烯中碳元素的质量分数为 。
(2)根据四氟乙烯的化学式,你还能得到哪些信息 (请写出两条)
_______________ 、_____________ 。
热点导练
1、(10乐山20)不少中小学生喜食油炸薯条。但是,油炸薯条易产生一种叫丙烯酰胺的致癌物,长期摄入易引发多种疾病,其结构为:,据此,不能推断出丙烯酰胺的
A.组成元素 B.密度、状态 C.化学式 D.相对分子质量
2.豆浆被成为“植物奶”,其中还有异黄酮(C15H10O2)具有防癌功能,下列关于异黄酮说法正确的是
A.异黄酮中共含有27个原子 B.异黄酮中碳元素的质量分数最大
C.一个异黄酮分子中含有一个氧分子 D.异黄酮中C、H、O三种元素的质量比为15:10:2
3.2010年4月玉树地震后,防疫人员使用各种消毒剂对环境进行消毒。亚氯酸钠(NaClO2)是一种重要的消毒剂。下列说法不正确的是
A 闻到消毒剂气味是因为微粒在不断运动 B NaClO2是由NaCl和O2构成的
C NaClO2中钠元素质量分数为25.4% D NaClO2中氯元素的化合价为+3
4. 从C、H、O、N、S、P、Na、Fe、Ba、Cu等10种元素中选择恰当的元素,用离子符号、化学式或化学方程式按下列要求填空:
(1)用于制造电线电缆的是 ;(2)天然气的主要成分是
(3)会形成酸雨的气体是 ;(4)中学化学实验室中最常用的溶剂是
(5)能溶于水形成蓝色溶液的盐是 (6)硫酸钠中的阴离子 ;氯化亚铁中的阳离子 ;能使木材、纸张变黑的酸 ;溶于水后显碱性的气体 ;用于造纸、洗涤剂的盐 。(7)一种暗红色的固体燃烧生成大量的白烟 。(8)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理 。(9)有沉淀生成的中和反应 。
(10)在人体组织里,葡萄糖在酶的作用下发生缓慢氧化 。
5.纽扣电池常用于手表等精密电子产品。下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg
(1)该反应中,Zn的化合价由__________变为___________.
(2)将该反应中的反应物进行简单分类,则下面横线上的物质是(填名称):
单质:_____________
纯净物
金属氧化物:_____________
(3)该电池中通常还加入炭粉,是因为炭具有良好的___________性。
(4)废旧的纽扣电池不能随意丢弃,应__________________________进行回收。
6.小明和小红对市场上销售的一种真空充气包装的形如小枕头“蛋黄派”发生了兴趣,如下图所示。他们查阅资料获知:这种真空充气包装技术,即将食品装入包装袋,抽出包装袋内空气,再充入某种气体,然后封口。它能使食品保持原有的色、香、味及营养价值,防止食品受压而破碎变形。那么,这是什么气体呢?小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,来判断小明的猜想是否正确,简要写出操作步骤(方法、现象和结论):______________________________________________________。
(2)你认为食品充气包装,对所充气体的要求是:_______、________、__________、________。
7.小红同学利用如图所示装置测定空气中氧气的体积分数。硬质玻璃管内装有细铜丝,且两个注射器组成的密闭系统内留有30mL室温下的空气。回答下列问题:
(1)小红在实验中出现的现象是:细铜丝由__色变为____色;冷却后,密闭容器内气体的体积约为___mL
(2)小红在实验过程中,交替推动两注射器的目的是______________。
(3)最后小红发现自己测出的氧气的体积分数偏小,请你帮他分析一下原因_______。
(4)小明用B装置测定空气中氧气的含量,反应原理是_________________,实验前在集气瓶内加入少量的水,并做上记号。下列说法中,不正确的是________________。
A.实验时红磷一定过量 B.点燃红磷前先用弹簧夹夹紧乳胶管
C.红磷熄灭后立刻打开弹簧夹 D.最终进入瓶中水的体积约为
氧气的体积
(5)集气瓶中剩余的气体主要是哪种气体?该实验说明这种气体
具有哪些性质?_______,__________________________________.
(6)通过上面的两个实验,你学到的测量混合物中某成分含量的方法是
。
8.下表是国家对“饮酒驾车”和“醉酒驾车”的界定标准:
饮酒驾车 20毫克/100毫升≤血液中的酒精含量<80毫克/100毫升
醉酒驾车 血液中的酒精含量≥80毫克/100毫升
白酒、红酒和啤酒中均含有乙醇(俗称酒精,化学式为C2H5OH),饮酒后酒精可进入人体血液中。请回答下列问题:
(1)乙醇(C2H5OH)中碳、氢、氧元素的质量比是C﹕H﹕O= ;
(2)饮酒会使人的 系统过度兴奋或麻痹抑制,容易引发交通事故。某人饮酒后驾车,被交警发现,经测定其每100毫升血液中酒精含量为93毫克,属于 驾车;
(3)在治理酒后驾车中,酒精检测仪发挥了重要作用。如图甲是酒精检测仪,图乙是检测仪的简化电路图,R0为定值电阻,R为气敏电阻,该电阻阻值与酒精气体含量的关系如图丙,如果图乙中电流表示数越大,说明司机吹出的气体中酒精含量就 。
9、(10汕头24)(8分)右图是某品牌补铁剂的标签。
请回答:(1)富马酸亚铁中含有 种元素, C、H、Fe、O原子个数比为 。(2)富马酸亚铁的相对分子质量为 。(3)若每次服用1包该补铁剂,摄入铁元素的质量为 mg(计算结果取整数)。
10.CuSO4溶液对过氧化氢的分解具有催化作用。有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。
(1)请你帮助他们完成实验报告:
实验过程 实验现象 实验结论
在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。 FeCl3溶液可以催化分解H2O2
(2)已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是 同学的猜想, 理由是
(3)同学们对余下的两个猜想,用实验进行了探究。请你仔细分析后填表:
实验过程 实验现象 结论
向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管。 无明显现象
向盛有5ml5%的H2O2溶液的试管中加入少量的 ,并把带火星的木条伸入试管。
11.小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种叫过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙来制取氧气。
[提出问题]过氧化钙可否用于制取氧气?
[查阅资料]部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,可作增氧剂、杀菌剂等。
[猜想与验证]
(1)小明依据___________________________________________,提出猜想Ⅰ。
猜想Ⅰ:加热过氧化钙可制取氧气。
实验装置 实验主要过程
①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到_________,松开手后,有液体进入导管。②加入过氧化钙,加热,导管口有大量气泡昌出。③收集满一瓶气体。④停止加热。熄灭酒精灯前,应______________ 。⑤检验气体,方法是________________________ 。
实验结论:加热过氧化钙可制取氧气。
分析与反思:
①虽然没有快速收集到大量氧气,由此实验现象,小明认为农民用过氧化钙作增氧剂的主要原因是_________________________ 。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议是 _________________ 。
以上建议是否可行,还需进一步通过实验验证。
H2O
+1
-183℃
-196℃
降温加压
B装置
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
