人教版高三化学必修一复习课:第十讲 氯及其化合物复习 课件(共31张ppt)
文档属性
| 名称 | 人教版高三化学必修一复习课:第十讲 氯及其化合物复习 课件(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 395.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-09 19:36:36 | ||
图片预览










文档简介
(共31张PPT)
欢迎各位领导专家
莅临指导
第十讲
氯及其化合物
会考专题复习系列
考纲说明:
1、了解氯及其重要化合物的主要物理化学性质;
2、知道氯单质的主要用途;
3、能写出氯原子、氯离子的结构示意图;
4、了解氯气的氧化性及与水、碱的反应;
5、知道氯水的消毒和漂白作用;
6、了解次氯酸的强氧化性。
考点1
了解氯及其重要化合物的主要物理化学性质(B)
微启玻璃片,用手
轻轻扇动,使极少
量气体进入鼻孔。
氯气的物理性质:
液氯是氯气单质的液体形式
是纯净物中的单质
色,
有
气味的气体,
密度
空气,
有
,
易
,
黄绿
刺激性
大于
毒
液化
刺激性、有毒气体
1、下列气体有颜色且具有刺激性气味的是(
)
A、SO2
B、NH3
C、Cl2
D、HCl
真题训练:
C
四种气体都有刺激性气味但只有氯气是有色其他是无色
1、Cl2可用来消灭田鼠,使用时可将Cl2通过管子
灌入洞中,这是利用Cl2下列性质中的( )
A.黄绿色
B.密度比空气小
C.有毒 D.较易液化
变式训练:
C
利用的是密度比空气大、有毒
2、下列关于液氯和氯水的叙述中正确的是
(
)
A.液氯是纯净物,而氯水是混合物
B.液氯是混合物,氯水也是混合物
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
A
变式训练:
液氯是由氯气液化而来,属于纯净物的单质
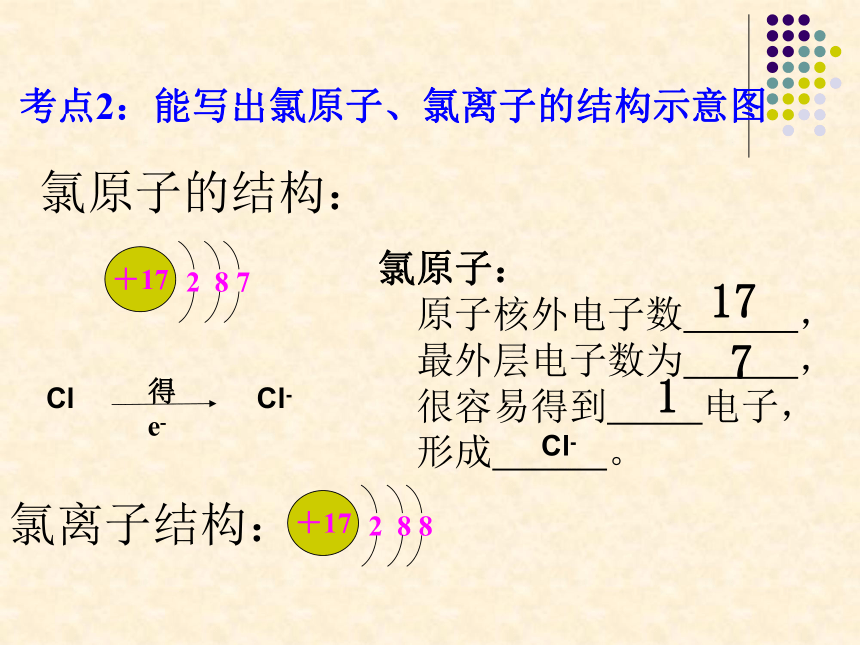
氯原子的结构:
氯原子:
原子核外电子数
,
最外层电子数为
,
很容易得到
电子,
形成
。
+17
2
8
7
Cl
得
e-
Cl-
17
7
1
Cl-
+17
2
8
8
考点2:能写出氯原子、氯离子的结构示意图
氯离子结构:
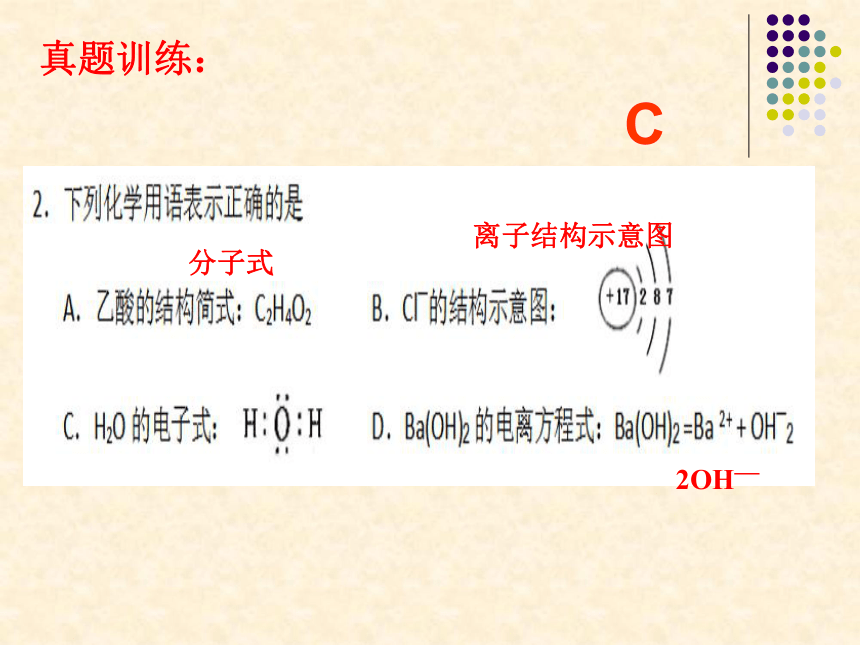
真题训练:
C
1、
非非组合
氯离子结构示意图
分子式
真题训练:
C
分子式
离子结构示意图
2OH—
真题训练:
D
离子结构示意图
考点3
了解氯气的氧化性(与钠、铁、铜、氢气
的反应)及其与水、与碱的反应。(B)
知道氯水的消毒和漂白原理(A)
1、与金属单质Na
、Fe
、Cu
反应
2Na
+
Cl2
2NaCl
点燃
Cu
+
Cl2
CuCl2
点燃
(燃烧黄色火焰,产生白烟)
铁、铜单质被Cl2氧化为较高价态。
(燃烧,产生棕褐色烟)
(燃烧,产生棕黄色烟)
+3
+2
2Fe
+
3
Cl2
2FeCl3
点燃
2、与非金属单质H2
反应
H2
+
Cl2
2HCl
点燃
(燃烧,产生苍白色火焰)
H2
+
Cl2
2HCl
光照
(爆炸)
3、与碱
NaOH、Ca(OH)2
反应
Cl2+2NaOH
=
NaCl+
NaClO
+
H2O
(工业和实验室吸收氯气尾气;生产漂白液)
2Cl2+2Ca(OH)2=
CaCl2+Ca(ClO)2+2H2O
(应用:生产漂白粉)
漂白原理:
Ca(ClO)2+CO2+H2O
=
CaCO3↓+2HClO
漂白粉有效成分:
漂白粉主要成分:
漂白液有效成分:
漂白液主要成分:
CaCl2、Ca(ClO)2
Ca(ClO)2
NaCl、NaClO
NaClO
4、与水反应(氯气溶于水称为氯水)
Cl2+H2O
HCl+
HClO
(次氯酸)
(可逆反应)
新制氯水注意:现配现用,保持在棕色瓶中
新制氯水具有强氧化性:能杀菌、消毒,具有漂白作用
实验操作
实验现象
结论
有色布条
.
氯水
漂白作用
有色布条
.
久置的氯气
漂白作用
褪色
不褪色
有
没有
HClO
考点4
了解次氯酸的强氧化性(B)
氯离子的检验
1、次氯酸是一元弱酸,酸性比碳酸弱。
2、次氯酸不稳定,容易分解放出氧气。当氯水受到日光照射时,次氯酸的分解速率加快。
3、次氯酸具有强氧化性,因此可用来杀菌消毒和漂白有色物质。
2HClO=====2HCl+O2↑
光
照
或
△
4、Cl-离子的检验:
Cl-
+
Ag+
=
AgCl↓(白色)
离子方程式:
化学方程式:
如:
NaCl
+
AgNO3
=
AgCl↓(白色)+NaNO3
向某溶液中
先用稀硝酸酸化,
再滴入AgNO3溶液,
若产生白色沉淀,
说明溶液中有Cl-离子
真题训练:
1、漂白粉的有效成分是
(
)
A.Ca(ClO)2
B.CaCl2
C.Ca(OH)2
D.CaCO3
A
2、下列关于氯气性质的说法正确的是(
)
A.密度比空气小
B.是无色无味的气体
C.能使干燥的有色布条褪色
D.可与氢氧化钠溶液反应
D
大
黄绿色刺激性气味
湿润
1、下列有关氯气的叙述中,正确的是(
)
A.Cl2是无色无味的气体
B.液氯和氯水是同一物质
C.点燃是H2和Cl2化合的惟一条件
D.Cl2跟变价金属反应生成高价金属氯化物
D
变式训练:
Cl2跟Fe反应生成+3价铁离子
2、Cl2用来消毒生活用水的原因是(
)
A.Cl2能杀灭细菌
B.Cl2有毒
C.Cl2是氧化性很强的气体
D.Cl2与水反应生成HClO有强氧化性,可杀灭水中的细菌
变式训练:
D
HClO有强氧化性,杀菌消毒作用
3、下列无水氯化物中不能用氯气和该元素的单质直接化合制取的是(
)
A、AlCl3
B、CuCl2
C、FeCl2
D、HCl
变式训练:
C
Fe与Cl2反应生成FeCl3
4、某学生用氯气消毒的自来水配制下列物质溶液,会产生明显药品变质问题的是(
)
A、NaNO3
B、FeCl2
C、Na2SO4
D、AlCl3
B
变式训练:
自来水有氯气残余,FeCl2被氧化
5、能使干燥的蓝色布条褪色的是
(
)
A、氯气
B、久制氯水
C、新制氯水
D、液氯
C
Cl2+H2O
HCl+
HClO
漂白性
(次氯酸)
变式训练:
6、当周围有大量Cl2逸出时,可用含有某种物质的水溶液的毛巾捂住鼻子,该物质最好是:(
)
A、NaOH
B、NaCl
C、Ca(OH)2
D、Na2CO3
变式训练:
D
Na2CO3的碱性比较弱
综合应用
7、有关物质的转化关系如下图所示(部分物质和条件已略去)。
A是海水中含量最多的盐,
B、E、F是气体单质,
C是金属单质;
X是能使湿润红色石蕊试纸变蓝的气体,
Y是最常见的无色液体。
A是海水中含量最多的盐,
NaCl
Na单质
和
Cl2
C是金属单质
Na
Cl2
X是能使湿润红色石蕊试纸变蓝的气体
NH3
NH3
NH3
Y是最常见的无色液体
H2O
NaOH
和
H2
B、E、F是气体单质,
H2
N2
NaOH
NaCl
D?
NaOH
NaCl
+
NH3
…………
NH4Cl
+
=====
NH4Cl
(1)X的化学式为
。
(2)E的化学式为
。
(3)写出C与Y反应的化学方程式
(4)写出D溶液与G溶液反应的离子方程式:
NH3
N2
2Na
+
2H2O
===
2NaOH
+
H2
↑
化学方程式:NaOH
+
NH4Cl
===
NaCl
+
NH3
↑
+
H2O
离子方程式:OH—
+
NH4+
===
NH3
↑
+
H2O
1、氯气的制备:
工业制备氯气:
实验室制备氯气:
2NaCl
+
2H2O
==
Cl2↑
+
H2↑
+
2NaOH
通电
MnO2+4HCl(浓)=
MnCl2+Cl2↑
+2H2O
Δ
了解
2、演示实验
发生装置
产生氯气
氯化氢、氯气、水蒸气
净化装置
吸收氯化氢
净化装置
吸收水蒸气
收集装置
收集氯气
MnO2+4HCl(浓)==
MnCl2+Cl2↑
+2H2O
Δ
尾气吸收装置
吸收多余的氯气
a.
向上排空气法
密度比空气大
b.
排饱和食盐水法
3、收集装置
本节小结
1、氯气的物理性质
2、氯原子、氯离子的结构示意图
3、氯气、氯水的氧化性、杀菌消毒和漂白原理
4、次氯酸的强氧化性
5、氯离子的检验
各位领导专家
辛苦了!
欢迎各位领导专家
莅临指导
第十讲
氯及其化合物
会考专题复习系列
考纲说明:
1、了解氯及其重要化合物的主要物理化学性质;
2、知道氯单质的主要用途;
3、能写出氯原子、氯离子的结构示意图;
4、了解氯气的氧化性及与水、碱的反应;
5、知道氯水的消毒和漂白作用;
6、了解次氯酸的强氧化性。
考点1
了解氯及其重要化合物的主要物理化学性质(B)
微启玻璃片,用手
轻轻扇动,使极少
量气体进入鼻孔。
氯气的物理性质:
液氯是氯气单质的液体形式
是纯净物中的单质
色,
有
气味的气体,
密度
空气,
有
,
易
,
黄绿
刺激性
大于
毒
液化
刺激性、有毒气体
1、下列气体有颜色且具有刺激性气味的是(
)
A、SO2
B、NH3
C、Cl2
D、HCl
真题训练:
C
四种气体都有刺激性气味但只有氯气是有色其他是无色
1、Cl2可用来消灭田鼠,使用时可将Cl2通过管子
灌入洞中,这是利用Cl2下列性质中的( )
A.黄绿色
B.密度比空气小
C.有毒 D.较易液化
变式训练:
C
利用的是密度比空气大、有毒
2、下列关于液氯和氯水的叙述中正确的是
(
)
A.液氯是纯净物,而氯水是混合物
B.液氯是混合物,氯水也是混合物
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
A
变式训练:
液氯是由氯气液化而来,属于纯净物的单质
氯原子的结构:
氯原子:
原子核外电子数
,
最外层电子数为
,
很容易得到
电子,
形成
。
+17
2
8
7
Cl
得
e-
Cl-
17
7
1
Cl-
+17
2
8
8
考点2:能写出氯原子、氯离子的结构示意图
氯离子结构:
真题训练:
C
1、
非非组合
氯离子结构示意图
分子式
真题训练:
C
分子式
离子结构示意图
2OH—
真题训练:
D
离子结构示意图
考点3
了解氯气的氧化性(与钠、铁、铜、氢气
的反应)及其与水、与碱的反应。(B)
知道氯水的消毒和漂白原理(A)
1、与金属单质Na
、Fe
、Cu
反应
2Na
+
Cl2
2NaCl
点燃
Cu
+
Cl2
CuCl2
点燃
(燃烧黄色火焰,产生白烟)
铁、铜单质被Cl2氧化为较高价态。
(燃烧,产生棕褐色烟)
(燃烧,产生棕黄色烟)
+3
+2
2Fe
+
3
Cl2
2FeCl3
点燃
2、与非金属单质H2
反应
H2
+
Cl2
2HCl
点燃
(燃烧,产生苍白色火焰)
H2
+
Cl2
2HCl
光照
(爆炸)
3、与碱
NaOH、Ca(OH)2
反应
Cl2+2NaOH
=
NaCl+
NaClO
+
H2O
(工业和实验室吸收氯气尾气;生产漂白液)
2Cl2+2Ca(OH)2=
CaCl2+Ca(ClO)2+2H2O
(应用:生产漂白粉)
漂白原理:
Ca(ClO)2+CO2+H2O
=
CaCO3↓+2HClO
漂白粉有效成分:
漂白粉主要成分:
漂白液有效成分:
漂白液主要成分:
CaCl2、Ca(ClO)2
Ca(ClO)2
NaCl、NaClO
NaClO
4、与水反应(氯气溶于水称为氯水)
Cl2+H2O
HCl+
HClO
(次氯酸)
(可逆反应)
新制氯水注意:现配现用,保持在棕色瓶中
新制氯水具有强氧化性:能杀菌、消毒,具有漂白作用
实验操作
实验现象
结论
有色布条
.
氯水
漂白作用
有色布条
.
久置的氯气
漂白作用
褪色
不褪色
有
没有
HClO
考点4
了解次氯酸的强氧化性(B)
氯离子的检验
1、次氯酸是一元弱酸,酸性比碳酸弱。
2、次氯酸不稳定,容易分解放出氧气。当氯水受到日光照射时,次氯酸的分解速率加快。
3、次氯酸具有强氧化性,因此可用来杀菌消毒和漂白有色物质。
2HClO=====2HCl+O2↑
光
照
或
△
4、Cl-离子的检验:
Cl-
+
Ag+
=
AgCl↓(白色)
离子方程式:
化学方程式:
如:
NaCl
+
AgNO3
=
AgCl↓(白色)+NaNO3
向某溶液中
先用稀硝酸酸化,
再滴入AgNO3溶液,
若产生白色沉淀,
说明溶液中有Cl-离子
真题训练:
1、漂白粉的有效成分是
(
)
A.Ca(ClO)2
B.CaCl2
C.Ca(OH)2
D.CaCO3
A
2、下列关于氯气性质的说法正确的是(
)
A.密度比空气小
B.是无色无味的气体
C.能使干燥的有色布条褪色
D.可与氢氧化钠溶液反应
D
大
黄绿色刺激性气味
湿润
1、下列有关氯气的叙述中,正确的是(
)
A.Cl2是无色无味的气体
B.液氯和氯水是同一物质
C.点燃是H2和Cl2化合的惟一条件
D.Cl2跟变价金属反应生成高价金属氯化物
D
变式训练:
Cl2跟Fe反应生成+3价铁离子
2、Cl2用来消毒生活用水的原因是(
)
A.Cl2能杀灭细菌
B.Cl2有毒
C.Cl2是氧化性很强的气体
D.Cl2与水反应生成HClO有强氧化性,可杀灭水中的细菌
变式训练:
D
HClO有强氧化性,杀菌消毒作用
3、下列无水氯化物中不能用氯气和该元素的单质直接化合制取的是(
)
A、AlCl3
B、CuCl2
C、FeCl2
D、HCl
变式训练:
C
Fe与Cl2反应生成FeCl3
4、某学生用氯气消毒的自来水配制下列物质溶液,会产生明显药品变质问题的是(
)
A、NaNO3
B、FeCl2
C、Na2SO4
D、AlCl3
B
变式训练:
自来水有氯气残余,FeCl2被氧化
5、能使干燥的蓝色布条褪色的是
(
)
A、氯气
B、久制氯水
C、新制氯水
D、液氯
C
Cl2+H2O
HCl+
HClO
漂白性
(次氯酸)
变式训练:
6、当周围有大量Cl2逸出时,可用含有某种物质的水溶液的毛巾捂住鼻子,该物质最好是:(
)
A、NaOH
B、NaCl
C、Ca(OH)2
D、Na2CO3
变式训练:
D
Na2CO3的碱性比较弱
综合应用
7、有关物质的转化关系如下图所示(部分物质和条件已略去)。
A是海水中含量最多的盐,
B、E、F是气体单质,
C是金属单质;
X是能使湿润红色石蕊试纸变蓝的气体,
Y是最常见的无色液体。
A是海水中含量最多的盐,
NaCl
Na单质
和
Cl2
C是金属单质
Na
Cl2
X是能使湿润红色石蕊试纸变蓝的气体
NH3
NH3
NH3
Y是最常见的无色液体
H2O
NaOH
和
H2
B、E、F是气体单质,
H2
N2
NaOH
NaCl
D?
NaOH
NaCl
+
NH3
…………
NH4Cl
+
=====
NH4Cl
(1)X的化学式为
。
(2)E的化学式为
。
(3)写出C与Y反应的化学方程式
(4)写出D溶液与G溶液反应的离子方程式:
NH3
N2
2Na
+
2H2O
===
2NaOH
+
H2
↑
化学方程式:NaOH
+
NH4Cl
===
NaCl
+
NH3
↑
+
H2O
离子方程式:OH—
+
NH4+
===
NH3
↑
+
H2O
1、氯气的制备:
工业制备氯气:
实验室制备氯气:
2NaCl
+
2H2O
==
Cl2↑
+
H2↑
+
2NaOH
通电
MnO2+4HCl(浓)=
MnCl2+Cl2↑
+2H2O
Δ
了解
2、演示实验
发生装置
产生氯气
氯化氢、氯气、水蒸气
净化装置
吸收氯化氢
净化装置
吸收水蒸气
收集装置
收集氯气
MnO2+4HCl(浓)==
MnCl2+Cl2↑
+2H2O
Δ
尾气吸收装置
吸收多余的氯气
a.
向上排空气法
密度比空气大
b.
排饱和食盐水法
3、收集装置
本节小结
1、氯气的物理性质
2、氯原子、氯离子的结构示意图
3、氯气、氯水的氧化性、杀菌消毒和漂白原理
4、次氯酸的强氧化性
5、氯离子的检验
各位领导专家
辛苦了!
