江苏省徐州市2020-2021学年高二上学期期初检测化学试卷
文档属性
| 名称 | 江苏省徐州市2020-2021学年高二上学期期初检测化学试卷 |  | |
| 格式 | doc | ||
| 文件大小 | 570.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-10 16:29:20 | ||
图片预览


文档简介
徐州市2020-2021学年高二上学期期初检测
化学试卷
本卷可能用到的原子量: C-12 H-1 O-16 Fe-56 Ag-108
一、单项选择题(本题包10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1. 下列说法正确的是( )
A. 化学反应的热效应的大小与参加反应的物质的多少无关
B. 由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D. 反应物的总能量大于生成物的总能量的反应一定是放热反应
2. 下列描述中,符合生产实际的是( )
A. 电解食盐水制得金属钠
B. 电解熔融的氧化铝制取金属铝,用铁作阳极
C. 一氧化碳高温还原铁矿石制得铁
D. 电解法精炼粗铜,用纯铜作阳极
3.下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)??2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为
H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
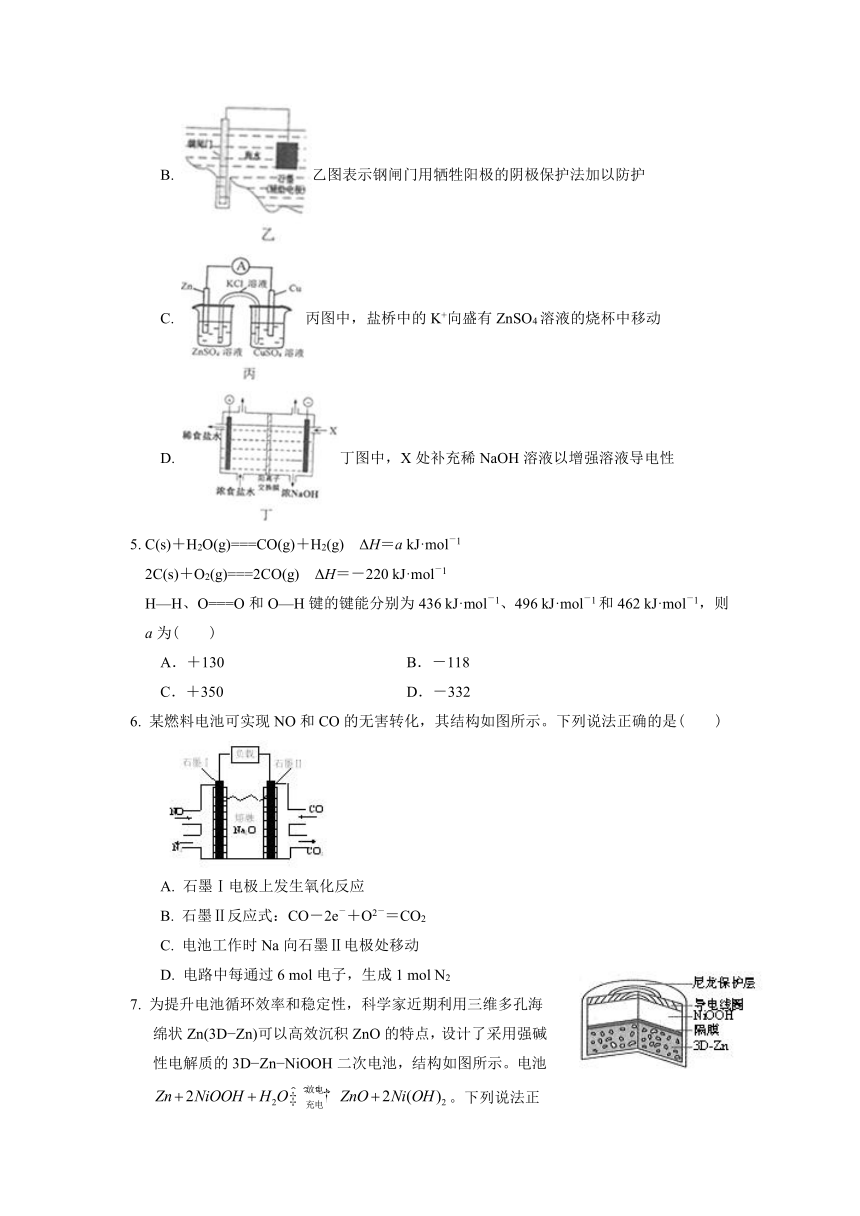
4. 下列有关电化学装置的说法正确的是( )
A. 正极的电极反应式为Ag2O+2e?+2H+2Ag+2H2O
B. 乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
C. 丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
D. 丁图中,X处补充稀NaOH溶液以增强溶液导电性
5. C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、O===O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.+130 B.-118
C.+350 D.-332
6. 某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是( )
A. 石墨Ⅰ电极上发生氧化反应
B. 石墨Ⅱ反应式:CO-2e-+O2-=CO2
C. 电池工作时Na向石墨Ⅱ电极处移动
D. 电路中每通过6 mol电子,生成1 mol N2
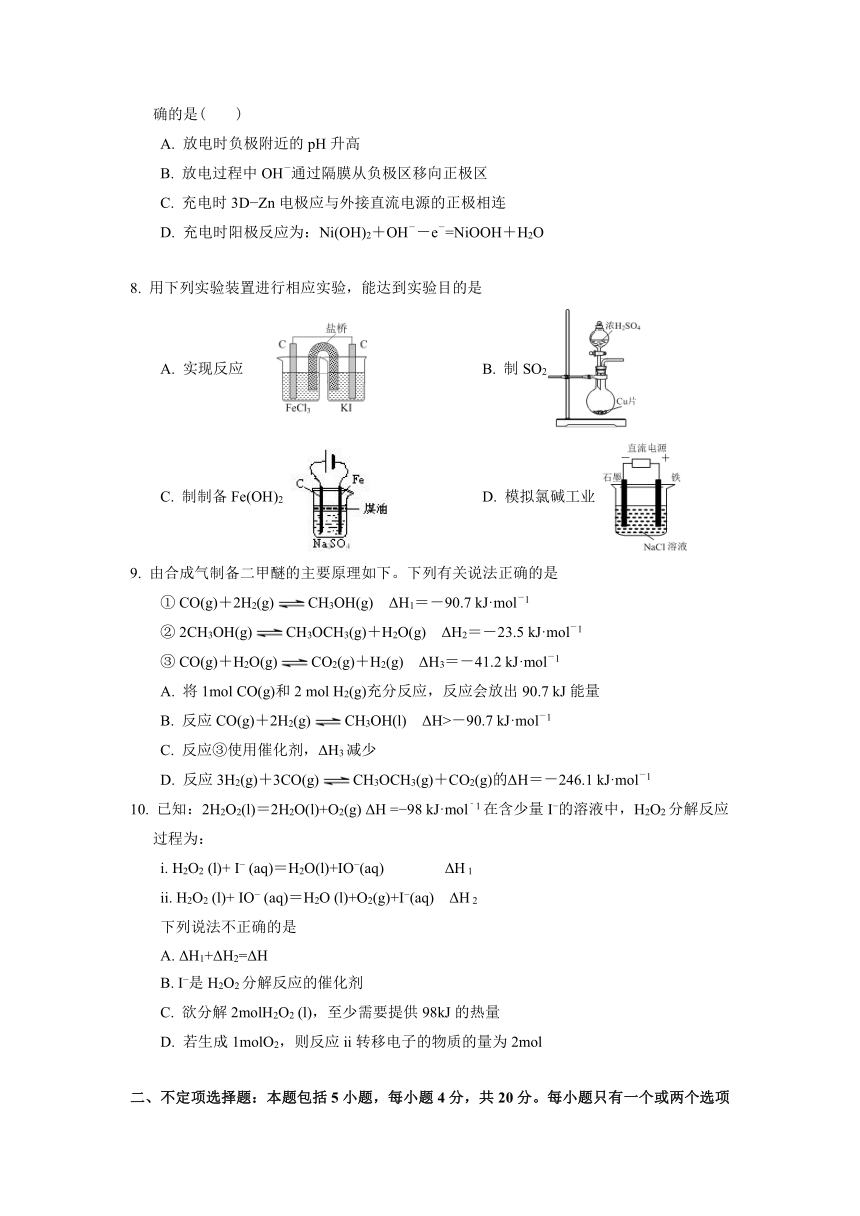
7. 为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D?Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D?Zn?NiOOH二次电池,结构如图所示。电池。下列说法正确的是( )
A. 放电时负极附近的pH升高
B. 放电过程中OH-通过隔膜从负极区移向正极区
C. 充电时3D?Zn电极应与外接直流电源的正极相连
D. 充电时阳极反应为:Ni(OH)2+OH--e-=NiOOH+H2O
8. 用下列实验装置进行相应实验,能达到实验目的是
A. 实现反应 B. 制SO2
C. 制制备Fe(OH)2 D. 模拟氯碱工业
9. 由合成气制备二甲醚的主要原理如下。下列有关说法正确的是
① CO(g)+2H2(g)CH3OH(g) ΔH1=-90.7 kJ·mol-1
② 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
A. 将1mol CO(g)和2 mol H2(g)充分反应,反应会放出90.7 kJ能量
B. 反应CO(g)+2H2(g)CH3OH(l) ΔH>-90.7 kJ·mol-1
C. 反应③使用催化剂,ΔH3减少
D. 反应3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
10. 已知:2H2O2(l)=2H2O(l)+O2(g) ΔH =?98 kJ·mol﹣1在含少量I?的溶液中,H2O2分解反应过程为:
i. H2O2 (l)+ I? (aq)=H2O(l)+IO?(aq) ΔH 1
ii. H2O2 (l)+ IO? (aq)=H2O (l)+O2(g)+I?(aq) ΔH 2
下列说法不正确的是
A. ΔH1+ΔH2=ΔH
B. I?是H2O2分解反应的催化剂
C. 欲分解2molH2O2 (l),至少需要提供98kJ的热量
D. 若生成1molO2,则反应ii转移电子的物质的量为2mol
二、不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列指定反应的离子方程式正确的是( )
A. 用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO2↑+H2O
B. Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2+ +OH-= CaCO3↓+H2O
C. 电解氯化镁溶液:2Cl-+2H2OCl2↑+H2↑+2OH-
D. NaClO将污水中的NH3氧化成N2:3ClO-+2NH3 =N2↑+3C1-+3H2O
12.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 向Na2SiO3溶液中通入CO2,溶液变浑浊 非金属性:C>Si
B 向淀粉溶液中加入稀硫酸,加热一段时间后,再滴加银氨溶液,水浴加热,未出现银镜 淀粉未水解
C 向酸性高锰酸钾溶液中通入SO2,溶液颜色褪去 SO2具有漂白性
D 将铜棒和碳棒用导线连接后插入稀硫酸中,碳棒表面无气泡产生 导线内无电流产生
13. 下列有关说法正确的是( )
A.若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
B. 工业上用石墨电极电解熔融 Al2O3冶炼金属铝时,阳极因被氧气氧化须定期更换
C. 铅蓄电池充电时,阳极区溶液的pH和阳极质量均减小
D. 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
14.下列图示与对应的叙述相符的是
A. 如图表示反应2SO2(g)+O2(g)2SO3(g) ΔH<0在有无催化剂时的能量变化
B. 如图表示电解精炼铜时纯铜和粗铜的质量随时间的变化
如图表示铅蓄电池放电时负极质量随转移电子物质的量的变化
D. 如图表示反应2NO2(g)N2O4(g)和2NO2(g)N2O4(l)的能量变化
15. 某微生物脱盐池的装置如图所示,下列说法正确的是
A. 电子由石墨电极流出
B. 生物膜电极反应式为:CH3COO-+2H2O+8e-=2CO2↑+7H+
C. 该装置可以将电能转化为化学能
D. X、Y依次为阴离子、阳离子选择性交换膜
Ⅱ卷(非选择题)
16.某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电高效燃料电池,充一次电可连续使用一个月.下图是一个电化学过程的示意图.
请填空:
(1)充电时:①原电池的负极与电源______极相连.
②B极的电极反应式为__________________________________________________.
(2)放电时,负极的电极反应式为_____________________________________________.
(3)在此过程中若完全反应,乙池中A极的质量升高648 g,则甲池中理论上消耗O2______L(标准状况下).
(4)若在常温常压下,1 g CH3OH燃烧生成CO2和液态H2O时放出热量22.68 kJ,则表示该反应的热化学方程式为______________________________________________.
17. 钢铁是用途最广泛的金属材料。
(1)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。写出正极反应式:______。
(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,装置如图所示。阳极的电极反应式为______;若消耗11.2g铁,则通过离子交换膜的Na+物质的量为______。
(3)如图所示装置为利用甲烷燃料电池实现在铁质材料上镀锌的一部分,燃料电池的负极反应式为______;在如图所示虚线框内补充完整在铁质材料上镀锌的装置图(注明电极材料和电解质溶液的成分)。_____
18.(1)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3—还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为____。
②电化学降解NO3—的原理如图所示,电源正极为________(填“A”或 B”),若总反应4NO3-+4H+=5O2+2N2+2H2O,则阴极反应式为_______。
③能否把质子交换膜改为阴离子交换膜____________(填“能“或”不能”)。
(2)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
①CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为______。
②测量汽车尾气中的CO浓度常用电化学气敏传感器,可用图简单表示,则阳极发生的电极反应为_____________________。
19. 燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______g。
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式________________;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为______________________。
20.常用CH3CHO+NaOH+2Cu(OH)2CH3COONa+Cu2O↓+3H2O检验醛类。
(1)Cu2+基态核外电子排布式为____________________。
(2)CH3COONa中碳原子轨道的杂化类型是___________,1molCH3COONa中含有σ键的数目为_______。
(3)与OH-离子互为等电子体的阴离子为_______________。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为_________________________。
(5)Cu2O晶体结构可能是_________(填字母)。
(6)SO32-的空间构型为____________。
化学试卷参考答案
一、单选1-10 DCCDA BDADC
二、多选11-15 D AD BC C BD
16. 最后一空3分,其余每空2分,计11分
(1)①负
②4OH--4e-===2H2O+O2↑
(2)CH3OH-6e-+8OH-===CO+6H2O
(3)33.6
(4)CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ/mol
17. 最后一空3分,其余每空2分 计11分
(1). O2+4e-+2H2O=4OH- (2). Fe+8OH--6e-=FeO+4H2O (3). 1.2mol
(4). CH4-8e-+10OH-=CO+7H2O (5).
18. 最后两空各3分,其余每空2分 计14分
(1). 5H2+2NO3-==N2↑+2OH-+4H2O (2). A (3). 4NO3-+20e-+24H+=2N2↑+12H2O
(4). 不能 (5). CO-2e-+4OH-=CO32-+2H2O (6). CO-2e-+H2O=CO2+2H+
19. 每空2分,计10分
(1). SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1
(2). 3 (3). 8
(4). SO2+2H2O+Cu2+4H++SO+Cu
(5). CH4-8e-+10OH-=CO+7H2O
20. 每空2分 计14分
(1). [Ar]3d9 (2). sp3、sp2 (3). 6mol (4). HS-
(5). 乙酸钠是离子晶体,乙酸和乙醛是分子晶体,乙酸分子间存在氢键 (6). C (7). 三角锥形
化学试卷
本卷可能用到的原子量: C-12 H-1 O-16 Fe-56 Ag-108
一、单项选择题(本题包10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1. 下列说法正确的是( )
A. 化学反应的热效应的大小与参加反应的物质的多少无关
B. 由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D. 反应物的总能量大于生成物的总能量的反应一定是放热反应
2. 下列描述中,符合生产实际的是( )
A. 电解食盐水制得金属钠
B. 电解熔融的氧化铝制取金属铝,用铁作阳极
C. 一氧化碳高温还原铁矿石制得铁
D. 电解法精炼粗铜,用纯铜作阳极
3.下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)??2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为
H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
4. 下列有关电化学装置的说法正确的是( )
A. 正极的电极反应式为Ag2O+2e?+2H+2Ag+2H2O
B. 乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
C. 丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
D. 丁图中,X处补充稀NaOH溶液以增强溶液导电性
5. C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、O===O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.+130 B.-118
C.+350 D.-332
6. 某燃料电池可实现NO和CO的无害转化,其结构如图所示。下列说法正确的是( )
A. 石墨Ⅰ电极上发生氧化反应
B. 石墨Ⅱ反应式:CO-2e-+O2-=CO2
C. 电池工作时Na向石墨Ⅱ电极处移动
D. 电路中每通过6 mol电子,生成1 mol N2
7. 为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D?Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D?Zn?NiOOH二次电池,结构如图所示。电池。下列说法正确的是( )
A. 放电时负极附近的pH升高
B. 放电过程中OH-通过隔膜从负极区移向正极区
C. 充电时3D?Zn电极应与外接直流电源的正极相连
D. 充电时阳极反应为:Ni(OH)2+OH--e-=NiOOH+H2O
8. 用下列实验装置进行相应实验,能达到实验目的是
A. 实现反应 B. 制SO2
C. 制制备Fe(OH)2 D. 模拟氯碱工业
9. 由合成气制备二甲醚的主要原理如下。下列有关说法正确的是
① CO(g)+2H2(g)CH3OH(g) ΔH1=-90.7 kJ·mol-1
② 2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1
A. 将1mol CO(g)和2 mol H2(g)充分反应,反应会放出90.7 kJ能量
B. 反应CO(g)+2H2(g)CH3OH(l) ΔH>-90.7 kJ·mol-1
C. 反应③使用催化剂,ΔH3减少
D. 反应3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)的ΔH=-246.1 kJ·mol-1
10. 已知:2H2O2(l)=2H2O(l)+O2(g) ΔH =?98 kJ·mol﹣1在含少量I?的溶液中,H2O2分解反应过程为:
i. H2O2 (l)+ I? (aq)=H2O(l)+IO?(aq) ΔH 1
ii. H2O2 (l)+ IO? (aq)=H2O (l)+O2(g)+I?(aq) ΔH 2
下列说法不正确的是
A. ΔH1+ΔH2=ΔH
B. I?是H2O2分解反应的催化剂
C. 欲分解2molH2O2 (l),至少需要提供98kJ的热量
D. 若生成1molO2,则反应ii转移电子的物质的量为2mol
二、不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列指定反应的离子方程式正确的是( )
A. 用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO2↑+H2O
B. Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2+ +OH-= CaCO3↓+H2O
C. 电解氯化镁溶液:2Cl-+2H2OCl2↑+H2↑+2OH-
D. NaClO将污水中的NH3氧化成N2:3ClO-+2NH3 =N2↑+3C1-+3H2O
12.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 结论
A 向Na2SiO3溶液中通入CO2,溶液变浑浊 非金属性:C>Si
B 向淀粉溶液中加入稀硫酸,加热一段时间后,再滴加银氨溶液,水浴加热,未出现银镜 淀粉未水解
C 向酸性高锰酸钾溶液中通入SO2,溶液颜色褪去 SO2具有漂白性
D 将铜棒和碳棒用导线连接后插入稀硫酸中,碳棒表面无气泡产生 导线内无电流产生
13. 下列有关说法正确的是( )
A.若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
B. 工业上用石墨电极电解熔融 Al2O3冶炼金属铝时,阳极因被氧气氧化须定期更换
C. 铅蓄电池充电时,阳极区溶液的pH和阳极质量均减小
D. 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
14.下列图示与对应的叙述相符的是
A. 如图表示反应2SO2(g)+O2(g)2SO3(g) ΔH<0在有无催化剂时的能量变化
B. 如图表示电解精炼铜时纯铜和粗铜的质量随时间的变化
如图表示铅蓄电池放电时负极质量随转移电子物质的量的变化
D. 如图表示反应2NO2(g)N2O4(g)和2NO2(g)N2O4(l)的能量变化
15. 某微生物脱盐池的装置如图所示,下列说法正确的是
A. 电子由石墨电极流出
B. 生物膜电极反应式为:CH3COO-+2H2O+8e-=2CO2↑+7H+
C. 该装置可以将电能转化为化学能
D. X、Y依次为阴离子、阳离子选择性交换膜
Ⅱ卷(非选择题)
16.某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电高效燃料电池,充一次电可连续使用一个月.下图是一个电化学过程的示意图.
请填空:
(1)充电时:①原电池的负极与电源______极相连.
②B极的电极反应式为__________________________________________________.
(2)放电时,负极的电极反应式为_____________________________________________.
(3)在此过程中若完全反应,乙池中A极的质量升高648 g,则甲池中理论上消耗O2______L(标准状况下).
(4)若在常温常压下,1 g CH3OH燃烧生成CO2和液态H2O时放出热量22.68 kJ,则表示该反应的热化学方程式为______________________________________________.
17. 钢铁是用途最广泛的金属材料。
(1)将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。写出正极反应式:______。
(2)纯铁作电极插入浓的NaOH溶液电解可制得Na2FeO4,装置如图所示。阳极的电极反应式为______;若消耗11.2g铁,则通过离子交换膜的Na+物质的量为______。
(3)如图所示装置为利用甲烷燃料电池实现在铁质材料上镀锌的一部分,燃料电池的负极反应式为______;在如图所示虚线框内补充完整在铁质材料上镀锌的装置图(注明电极材料和电解质溶液的成分)。_____
18.(1)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3—还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为____。
②电化学降解NO3—的原理如图所示,电源正极为________(填“A”或 B”),若总反应4NO3-+4H+=5O2+2N2+2H2O,则阴极反应式为_______。
③能否把质子交换膜改为阴离子交换膜____________(填“能“或”不能”)。
(2)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
①CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为______。
②测量汽车尾气中的CO浓度常用电化学气敏传感器,可用图简单表示,则阳极发生的电极反应为_____________________。
19. 燃煤烟气中含有大量的二氧化硫,进行脱硫处理可以减少环境污染,变废为宝。
(1)H2还原法是处理燃煤烟气中SO2的方法之一。已知:2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol-1;H2S(g)=H2(g)+S(s) ΔH=b kJ·mol-1;H2O(l)=H2O(g) ΔH=c kJ·mol-1;写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_______。
(2)新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能使工业废气中酸性氧化物分解除去,若2 mol ZnFe2Ox与足量SO2可生成2 mol ZnFe2O4和1.0 mol S,则x=_______。
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n)H2O=2n CuSO4+(2-2n) H2SO4,吸收标准状况下11.2L SO2,被SO2还原的O2的质量为______g。
②利用如所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式________________;若用甲烷燃料电池作电源(电解质溶液呈碱性),负极的反应式为______________________。
20.常用CH3CHO+NaOH+2Cu(OH)2CH3COONa+Cu2O↓+3H2O检验醛类。
(1)Cu2+基态核外电子排布式为____________________。
(2)CH3COONa中碳原子轨道的杂化类型是___________,1molCH3COONa中含有σ键的数目为_______。
(3)与OH-离子互为等电子体的阴离子为_______________。
(4)沸点高低:乙酸钠>乙酸>乙醛,这是因为_________________________。
(5)Cu2O晶体结构可能是_________(填字母)。
(6)SO32-的空间构型为____________。
化学试卷参考答案
一、单选1-10 DCCDA BDADC
二、多选11-15 D AD BC C BD
16. 最后一空3分,其余每空2分,计11分
(1)①负
②4OH--4e-===2H2O+O2↑
(2)CH3OH-6e-+8OH-===CO+6H2O
(3)33.6
(4)CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ/mol
17. 最后一空3分,其余每空2分 计11分
(1). O2+4e-+2H2O=4OH- (2). Fe+8OH--6e-=FeO+4H2O (3). 1.2mol
(4). CH4-8e-+10OH-=CO+7H2O (5).
18. 最后两空各3分,其余每空2分 计14分
(1). 5H2+2NO3-==N2↑+2OH-+4H2O (2). A (3). 4NO3-+20e-+24H+=2N2↑+12H2O
(4). 不能 (5). CO-2e-+4OH-=CO32-+2H2O (6). CO-2e-+H2O=CO2+2H+
19. 每空2分,计10分
(1). SO2(g)+2H2(g)=S(s)+2H2O(g) ΔH=(a-2b+2c) kJ·mol—1
(2). 3 (3). 8
(4). SO2+2H2O+Cu2+4H++SO+Cu
(5). CH4-8e-+10OH-=CO+7H2O
20. 每空2分 计14分
(1). [Ar]3d9 (2). sp3、sp2 (3). 6mol (4). HS-
(5). 乙酸钠是离子晶体,乙酸和乙醛是分子晶体,乙酸分子间存在氢键 (6). C (7). 三角锥形
同课章节目录
