人教版九年级化学 上册 第六单元 实验活动2 二氧化碳的实验室制取与性质 课件(共35张PPT)
文档属性
| 名称 | 人教版九年级化学 上册 第六单元 实验活动2 二氧化碳的实验室制取与性质 课件(共35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-11 00:00:00 | ||
图片预览








文档简介
(共35张PPT)
名言欣赏:
人一定要足够优秀或足够强大,如果你只是弱酸或者弱碱,那即使是滥情如Al(OH)3者也不会要你!
导入新课
经过前一阶段的学习,我们已经知道了氧气的实验室制取方法,今天,我们来尝试设计二氧化碳的实验室制法。
实验活动2
二氧化碳的实验室制取与性质
第六单元
碳和碳的氧化物
导入新课
讲授新课
课堂小结
随堂训练
学习目标
1.学会实验室制取二氧化碳和用向上排空气法
收集气体的方法;
2.理解并认识二氧化碳的性质。
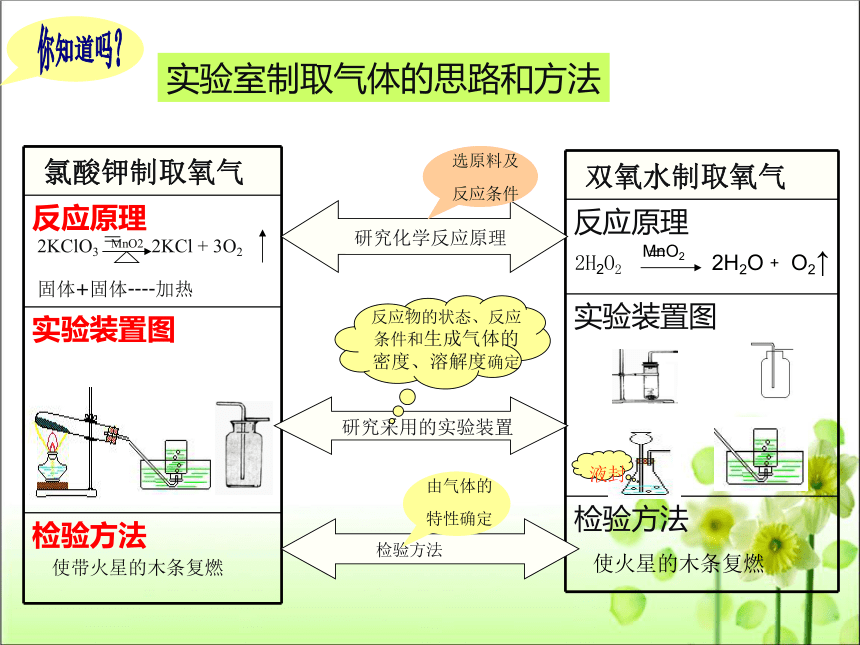
使带火星的木条复燃
2KClO3
MnO2
2KCl
+
3O2
固体+固体----加热
氯酸钾制取氧气
反应原理
实验装置图
检验方法
双氧水制取氧气
反应原理
实验装置图
检验方法
实验室制取气体的思路和方法
研究化学反应原理
选原料及
反应条件
研究采用的实验装置
反应物的状态、反应条件和生成气体的密度、溶解度确定
检验方法
由气体的特性确定
你知道吗?
2H2O2
MnO2
2H2O﹢
O2↑
使火星的木条复燃
液封
=
=
前面几节课中我们学习了二氧化碳的制取与二氧化碳的性质,请同学们回忆一下,实验室制取二氧化碳的实验用品是什么,实验原理是什么?
石灰石(或大理石)和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
目标导学一:二氧化碳的实验室制取
实验目的
1.练习实验室制取二氧化碳和用向上排空气法收集气体。
2.加深对二氧化碳性质的认识。
实验用品
烧杯、集气瓶、量筒、胶头滴管、玻璃导管、胶皮管、单孔橡胶塞、铁架台(带铁夹)、试管、试管夹、玻璃片、酒精灯。大理石(或石灰石)、稀盐酸(1∶2)、澄清石灰水、紫色石蕊溶液。
蜡烛、木条、蒸馏水、火柴
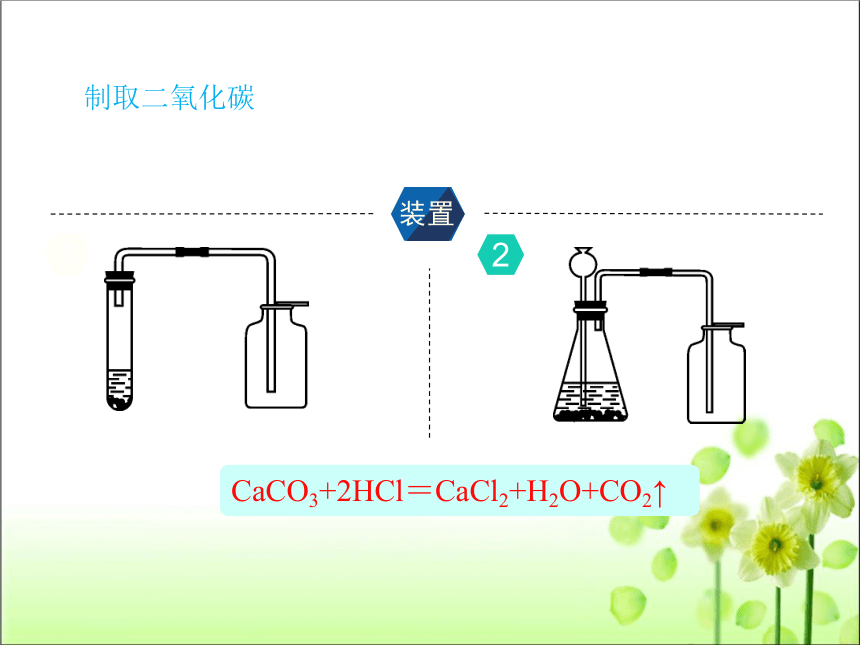
制取二氧化碳
装置
CaCO3+2HCl=CaCl2+H2O+CO2↑
1
2
问
答
①发生装置:由于该反应是用块状的大理石(或石灰石)与稀盐酸反应,且不需要加热,其发生装置应选用“固液不加热型”。
②收集装置:CO2能溶于水,且部分与水反应生成碳酸,故不能用排水法收集。因为CO2的密度比空气的密度大,故选用向上排空气法收集。
为什么要选择上述实验装置?
问题与交流
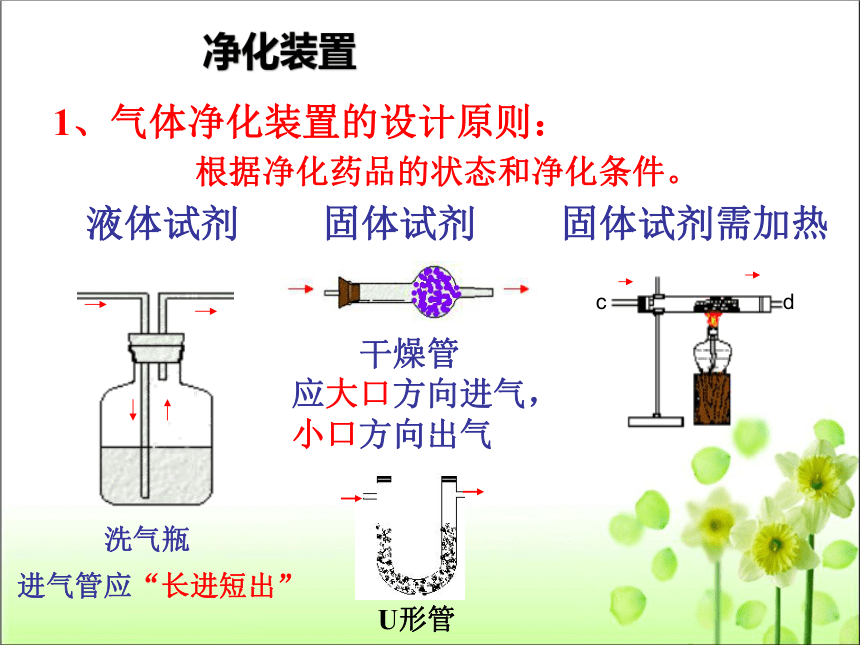
1、气体净化装置的设计原则:
净化装置
根据净化药品的状态和净化条件。
洗气瓶
进气管应“长进短出”
干燥管
应大口方向进气,
小口方向出气
液体试剂
固体试剂
固体试剂需加热
c
d
U形管
?
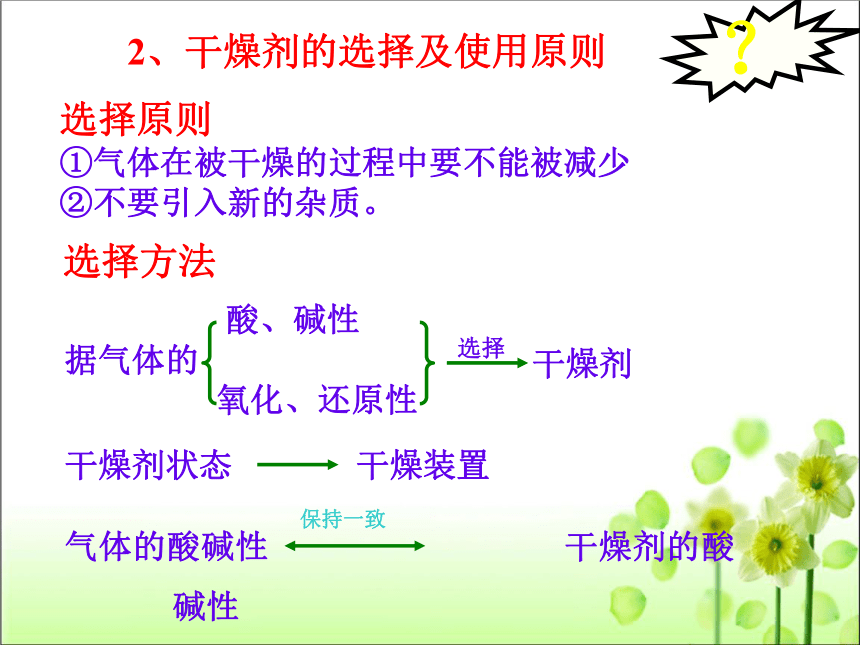
气体的酸碱性
干燥剂的酸碱性
保持一致
2、干燥剂的选择及使用原则
选择原则
①气体在被干燥的过程中要不能被减少
②不要引入新的杂质。
选择方法
干燥剂状态
干燥装置
酸、碱性
据气体的
氧化、还原性
干燥剂
选择
酸性干燥剂(如:浓硫酸、P2O5、硅胶等)
碱性干燥剂
(如碱石灰、生石灰、固体NaOH等)
有氧化性的干燥剂(如浓硫酸)
3、常见干燥剂
中性干燥剂(如:CaCl2固体)只不能干燥氨气。
不能用干燥碱
性气体。
不能用来干燥酸性气体如Cl2。
不能干燥有还原性气体(如H2S、HI等)。
4、常见干燥剂及使用装置
液态干燥剂
固态干燥剂
装
置
常见干燥剂
可干燥
气体
不可干燥
气体
→
→
浓硫酸
无水CaCl2
碱石灰
H2,O2,Cl2,SO2,
CO,N2,CH4
O2,Cl2,HCl,SO2,
H2,
CO,N2,CH4
H2,O2,
N2,
CH4,
NH3
H2S,NH3,HBr,
HI,C2H4
HX,H2S,SO2,CO2,NO2,
Cl2
NH3
实验步骤
1
2
3
4
5
连接仪器
检查气密性
加药品(先固体后液体)
收集气体
验满
实验步骤
1.制取二氧化碳
(1)按照如图所示连接装置,并检
查装置的气密性。
问
答
检查装置气密性的具体步骤是什么?
如图所示,组装好仪器后,先把导气管的一端浸入水里,然后用手掌紧贴容器外壁,如果导气管口有气泡冒出,或者松开手,导气管口浸水的一端形成一段高于水面的水柱,则表明装置气密性良好。
问题与交流
实验步骤
(2)在试管里放入几小块大理石(或石灰石),然后小心地注入15
mL稀盐酸。立即用带有导管的橡胶塞塞住管口,观察试管里发生的现象,以及反应中产生气体的颜色。过一会儿,检查集气瓶中是否已收集满二氧化碳。用玻璃片盖住已收集满二氧化碳的集气瓶,备用。
实验现象
发生剧烈反应,产生大量气泡。
将燃着的木条放在瓶口,木条熄灭,则证明已满。
将气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明是二氧化碳。
问
答
如何检验收集到的气体就是二氧化碳?
问题与交流
问
答
如何验证二氧化碳已收集满?
取用大理石时,先将锥形瓶横放,把大理石放入瓶口使其缓慢滑到瓶底。
导管不能伸入瓶内太长,以刚露出胶塞为宜。
收集二氧化碳时导管口应接近集气瓶底部,以利于排净空气。
1
2
3
注意事项
(1)把一支短蜡烛固定在烧杯内,点燃。拿起收集满二氧化碳的集气瓶,向烧杯内缓慢倾倒二氧化碳,观察现象。
实验现象
燃着的蜡烛熄灭
实验结论
二氧化碳不燃烧,也不支持燃烧;密度比空气大。
目标导学二:二氧化碳的性质
注意:开始加热试管里的液体时,要不时移动试管,使受热均匀。
(2)向两支试管中分别加入2mL蒸馏水,然后各滴入1~2滴石蕊溶液,观察试管中溶液的颜色。将其中一支试管静置。向另一支试管中通入二氧化碳,观察现象,并与静置的试管中溶液的颜色进行对比。将通入二氧化碳的试管放在酒精灯火焰上加热,观察现象。
滴加石蕊试液后溶液变为紫色;向试管通入CO2后,溶液逐渐变成红色;将试管加热后,溶液又变回紫色。
二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,而碳酸不稳定,在加热条件下又会分解生成二氧化碳和水,所以溶液又恢复为紫色。
原因
现象
取一支试管,向其中注入少量澄清石灰水,然后通入二氧化碳。
Ca(OH)2+CO2=CaCO3↓+H2O
实验内容
澄清石灰水变浑浊。
操作
现象
分析
归纳与小结
1.二氧化碳不燃烧,也不支持燃烧。
2.二氧化碳能溶于水,且能与水反应生成能使紫色石蕊溶液变红的碳酸,CO2+H2O
H2CO3;
碳酸不稳定,受热易分解,H2CO3
H2O+CO2↑。
3.二氧化碳能使澄清石灰水变浑浊,
Ca(OH)2+CO2
CaCO3↓+H2O
。
实验室制取CO2时,为什么最好选用石灰石(或大理石)和稀盐酸?
所有的碳酸盐都能与盐酸反应产生二氧化碳。常见的Na2CO3、K2CO3与盐酸反应时速率太快,不易控制。块状的碳酸镁(MgCO3)跟盐酸反应时速率适中,但来源不广泛。石灰石与大理石的主要成分都是碳酸钙,它们与盐酸反应时速率适中,易于控制,且来源广泛,容易得到。使用时应把大理石或石灰石砸成大小适当的块状,以便于在气体发生装置中使用。
选用药品相互反应制取气体时,应尽量避免混入杂质气体。盐酸是挥发性酸,浓度越大时挥发性越强,制取二氧化碳时不用浓盐酸而用稀盐酸,就是为了尽量减少挥发出来的氯化氢气混入盐酸。
一、实验室制取二氧化碳
收集、检验、验满的方法
二、二氧化碳的性质
1.二氧化碳不燃烧,也不支持燃烧;
2.二氧化碳能溶于水,碳酸不稳定易分解;
3.二氧化碳能使澄清石灰水变浑浊。
课堂小结
1、同学们设计了如图所示装置来探究二氧化碳的制取和性质,下列关于该实验的叙述正确的是(
)
A.移动粗铜丝能控制反应的发生和停止
B.该实验能证明二氧化碳的密度比空气大
C.浸有紫色石蕊试液的棉花会变蓝
D.产生的二氧化碳可用生石灰干燥
检测目标
A
2、下列关于CO2性质的描述中,正确的是(
)
A.CO2能溶于水生成H2CO3
B.
CO2具有酸性
C.
CO2在一定条件下具有可燃性
D.
CO2有毒性
A
检测目标
3、某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是(
)
B
检测目标
4、实验室制取CO2应选择的装置是(
)
A.①③
B.②③
C.②④
D.②⑤
B
检测目标
5、实验室制取CO2有以下步骤:①连接好装置;②向试管中小心放入几小块石灰石;③向试管中小心注入适量稀盐酸;④检查装置的气密性;⑤收集产生的气体;⑥用燃烧的木条检验集气瓶是否收集满CO2。以上操作按由先至后的顺序排列正确的是(
)
A.①②③④⑤⑥ B.①④②③⑤⑥
C.①③②④⑤⑥
D.③①②④⑤⑥
B
检测目标
通过本课学习,你收获了什么?
课后作业:
1.整理本课知识点
2.完成同步练习题
名言欣赏:
人一定要足够优秀或足够强大,如果你只是弱酸或者弱碱,那即使是滥情如Al(OH)3者也不会要你!
导入新课
经过前一阶段的学习,我们已经知道了氧气的实验室制取方法,今天,我们来尝试设计二氧化碳的实验室制法。
实验活动2
二氧化碳的实验室制取与性质
第六单元
碳和碳的氧化物
导入新课
讲授新课
课堂小结
随堂训练
学习目标
1.学会实验室制取二氧化碳和用向上排空气法
收集气体的方法;
2.理解并认识二氧化碳的性质。
使带火星的木条复燃
2KClO3
MnO2
2KCl
+
3O2
固体+固体----加热
氯酸钾制取氧气
反应原理
实验装置图
检验方法
双氧水制取氧气
反应原理
实验装置图
检验方法
实验室制取气体的思路和方法
研究化学反应原理
选原料及
反应条件
研究采用的实验装置
反应物的状态、反应条件和生成气体的密度、溶解度确定
检验方法
由气体的特性确定
你知道吗?
2H2O2
MnO2
2H2O﹢
O2↑
使火星的木条复燃
液封
=
=
前面几节课中我们学习了二氧化碳的制取与二氧化碳的性质,请同学们回忆一下,实验室制取二氧化碳的实验用品是什么,实验原理是什么?
石灰石(或大理石)和稀盐酸
CaCO3+2HCl=CaCl2+H2O+CO2↑
目标导学一:二氧化碳的实验室制取
实验目的
1.练习实验室制取二氧化碳和用向上排空气法收集气体。
2.加深对二氧化碳性质的认识。
实验用品
烧杯、集气瓶、量筒、胶头滴管、玻璃导管、胶皮管、单孔橡胶塞、铁架台(带铁夹)、试管、试管夹、玻璃片、酒精灯。大理石(或石灰石)、稀盐酸(1∶2)、澄清石灰水、紫色石蕊溶液。
蜡烛、木条、蒸馏水、火柴
制取二氧化碳
装置
CaCO3+2HCl=CaCl2+H2O+CO2↑
1
2
问
答
①发生装置:由于该反应是用块状的大理石(或石灰石)与稀盐酸反应,且不需要加热,其发生装置应选用“固液不加热型”。
②收集装置:CO2能溶于水,且部分与水反应生成碳酸,故不能用排水法收集。因为CO2的密度比空气的密度大,故选用向上排空气法收集。
为什么要选择上述实验装置?
问题与交流
1、气体净化装置的设计原则:
净化装置
根据净化药品的状态和净化条件。
洗气瓶
进气管应“长进短出”
干燥管
应大口方向进气,
小口方向出气
液体试剂
固体试剂
固体试剂需加热
c
d
U形管
?
气体的酸碱性
干燥剂的酸碱性
保持一致
2、干燥剂的选择及使用原则
选择原则
①气体在被干燥的过程中要不能被减少
②不要引入新的杂质。
选择方法
干燥剂状态
干燥装置
酸、碱性
据气体的
氧化、还原性
干燥剂
选择
酸性干燥剂(如:浓硫酸、P2O5、硅胶等)
碱性干燥剂
(如碱石灰、生石灰、固体NaOH等)
有氧化性的干燥剂(如浓硫酸)
3、常见干燥剂
中性干燥剂(如:CaCl2固体)只不能干燥氨气。
不能用干燥碱
性气体。
不能用来干燥酸性气体如Cl2。
不能干燥有还原性气体(如H2S、HI等)。
4、常见干燥剂及使用装置
液态干燥剂
固态干燥剂
装
置
常见干燥剂
可干燥
气体
不可干燥
气体
→
→
浓硫酸
无水CaCl2
碱石灰
H2,O2,Cl2,SO2,
CO,N2,CH4
O2,Cl2,HCl,SO2,
H2,
CO,N2,CH4
H2,O2,
N2,
CH4,
NH3
H2S,NH3,HBr,
HI,C2H4
HX,H2S,SO2,CO2,NO2,
Cl2
NH3
实验步骤
1
2
3
4
5
连接仪器
检查气密性
加药品(先固体后液体)
收集气体
验满
实验步骤
1.制取二氧化碳
(1)按照如图所示连接装置,并检
查装置的气密性。
问
答
检查装置气密性的具体步骤是什么?
如图所示,组装好仪器后,先把导气管的一端浸入水里,然后用手掌紧贴容器外壁,如果导气管口有气泡冒出,或者松开手,导气管口浸水的一端形成一段高于水面的水柱,则表明装置气密性良好。
问题与交流
实验步骤
(2)在试管里放入几小块大理石(或石灰石),然后小心地注入15
mL稀盐酸。立即用带有导管的橡胶塞塞住管口,观察试管里发生的现象,以及反应中产生气体的颜色。过一会儿,检查集气瓶中是否已收集满二氧化碳。用玻璃片盖住已收集满二氧化碳的集气瓶,备用。
实验现象
发生剧烈反应,产生大量气泡。
将燃着的木条放在瓶口,木条熄灭,则证明已满。
将气体通入澄清石灰水中,若澄清石灰水变浑浊,则证明是二氧化碳。
问
答
如何检验收集到的气体就是二氧化碳?
问题与交流
问
答
如何验证二氧化碳已收集满?
取用大理石时,先将锥形瓶横放,把大理石放入瓶口使其缓慢滑到瓶底。
导管不能伸入瓶内太长,以刚露出胶塞为宜。
收集二氧化碳时导管口应接近集气瓶底部,以利于排净空气。
1
2
3
注意事项
(1)把一支短蜡烛固定在烧杯内,点燃。拿起收集满二氧化碳的集气瓶,向烧杯内缓慢倾倒二氧化碳,观察现象。
实验现象
燃着的蜡烛熄灭
实验结论
二氧化碳不燃烧,也不支持燃烧;密度比空气大。
目标导学二:二氧化碳的性质
注意:开始加热试管里的液体时,要不时移动试管,使受热均匀。
(2)向两支试管中分别加入2mL蒸馏水,然后各滴入1~2滴石蕊溶液,观察试管中溶液的颜色。将其中一支试管静置。向另一支试管中通入二氧化碳,观察现象,并与静置的试管中溶液的颜色进行对比。将通入二氧化碳的试管放在酒精灯火焰上加热,观察现象。
滴加石蕊试液后溶液变为紫色;向试管通入CO2后,溶液逐渐变成红色;将试管加热后,溶液又变回紫色。
二氧化碳与水反应生成碳酸,碳酸能使紫色石蕊溶液变红,而碳酸不稳定,在加热条件下又会分解生成二氧化碳和水,所以溶液又恢复为紫色。
原因
现象
取一支试管,向其中注入少量澄清石灰水,然后通入二氧化碳。
Ca(OH)2+CO2=CaCO3↓+H2O
实验内容
澄清石灰水变浑浊。
操作
现象
分析
归纳与小结
1.二氧化碳不燃烧,也不支持燃烧。
2.二氧化碳能溶于水,且能与水反应生成能使紫色石蕊溶液变红的碳酸,CO2+H2O
H2CO3;
碳酸不稳定,受热易分解,H2CO3
H2O+CO2↑。
3.二氧化碳能使澄清石灰水变浑浊,
Ca(OH)2+CO2
CaCO3↓+H2O
。
实验室制取CO2时,为什么最好选用石灰石(或大理石)和稀盐酸?
所有的碳酸盐都能与盐酸反应产生二氧化碳。常见的Na2CO3、K2CO3与盐酸反应时速率太快,不易控制。块状的碳酸镁(MgCO3)跟盐酸反应时速率适中,但来源不广泛。石灰石与大理石的主要成分都是碳酸钙,它们与盐酸反应时速率适中,易于控制,且来源广泛,容易得到。使用时应把大理石或石灰石砸成大小适当的块状,以便于在气体发生装置中使用。
选用药品相互反应制取气体时,应尽量避免混入杂质气体。盐酸是挥发性酸,浓度越大时挥发性越强,制取二氧化碳时不用浓盐酸而用稀盐酸,就是为了尽量减少挥发出来的氯化氢气混入盐酸。
一、实验室制取二氧化碳
收集、检验、验满的方法
二、二氧化碳的性质
1.二氧化碳不燃烧,也不支持燃烧;
2.二氧化碳能溶于水,碳酸不稳定易分解;
3.二氧化碳能使澄清石灰水变浑浊。
课堂小结
1、同学们设计了如图所示装置来探究二氧化碳的制取和性质,下列关于该实验的叙述正确的是(
)
A.移动粗铜丝能控制反应的发生和停止
B.该实验能证明二氧化碳的密度比空气大
C.浸有紫色石蕊试液的棉花会变蓝
D.产生的二氧化碳可用生石灰干燥
检测目标
A
2、下列关于CO2性质的描述中,正确的是(
)
A.CO2能溶于水生成H2CO3
B.
CO2具有酸性
C.
CO2在一定条件下具有可燃性
D.
CO2有毒性
A
检测目标
3、某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是(
)
B
检测目标
4、实验室制取CO2应选择的装置是(
)
A.①③
B.②③
C.②④
D.②⑤
B
检测目标
5、实验室制取CO2有以下步骤:①连接好装置;②向试管中小心放入几小块石灰石;③向试管中小心注入适量稀盐酸;④检查装置的气密性;⑤收集产生的气体;⑥用燃烧的木条检验集气瓶是否收集满CO2。以上操作按由先至后的顺序排列正确的是(
)
A.①②③④⑤⑥ B.①④②③⑤⑥
C.①③②④⑤⑥
D.③①②④⑤⑥
B
检测目标
通过本课学习,你收获了什么?
课后作业:
1.整理本课知识点
2.完成同步练习题
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
