高一化学鲁科版必修一第一章第三节化学中常用的物理量——物质的量(31张PPT)
文档属性
| 名称 | 高一化学鲁科版必修一第一章第三节化学中常用的物理量——物质的量(31张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 839.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-10-11 00:00:00 | ||
图片预览










文档简介
(共32张PPT)
普通高中课程标准实验教科书
化学1(必修)
第一章
第三节
化学中常用的物理量
——物质的量
联想·质疑
思考讨论
一谷仓的谷子,假定每一粒谷子的形状、体积、质量是相同的,我们通过哪些方法或途径可以知道这个谷仓中的谷子的个数?
序号
方法或途径
1
2
3
4
5
…
…
直接数数
先称量出一粒谷子的质量,再用谷仓中谷子的总质量除以一粒谷子的质量。
先称量出100粒谷子的质量,用谷子的总质量除以
100粒谷子的质量,再乘以100
。
先测量出一粒谷子的体积,再用仓库中谷子的总体积除以一粒谷子的体积
。
先用一个容器(升、斗或担),先数出一升(斗或担)中谷子的粒数,再用升(斗或担)去量谷仓库中谷子,用升数乘以一升中谷子的粒数,就为谷仓库中谷子的粒数。
建立模型
模型一:——直接计量(方法一)
模型二:——引入中间物理量换算
(方法二~五)
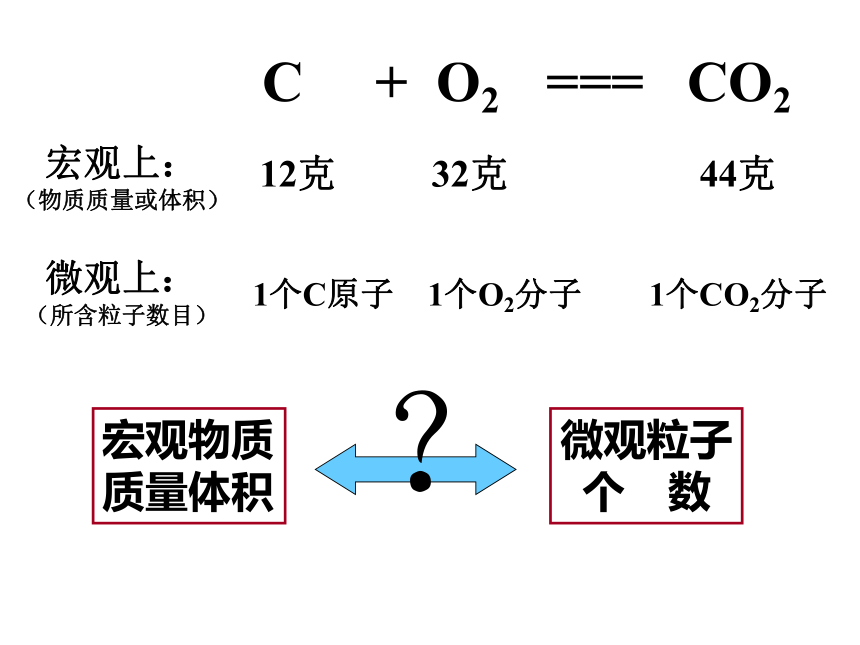
C
+
O2
===
CO2
宏观上:
(物质质量或体积)
微观上:
(所含粒子数目)
12克
32克
44克
1个C原子
1个O2分子
1个CO2分子
宏观物质
质量体积
微观粒子
个
数
?
思考探究
结合前面解决一个仓库中谷子粒数的方法模型,尽可能多地列举出解决一定质量或体积的宏观物质中所含粒子数的方法或途径。
序号
方法或途径
1
2
3
4
5
一个一个地数
先称量出1个微观粒子的质量,然后再用宏观物质的
质量除以1个微观粒子的质量,计算出微观粒子个数
先称量出由某一数目的微观粒子所组成的微粒集体
的质量,然后再用宏观物质的质量除以微粒集体的
质量,再乘以微粒集体所含有的微粒数,计算出碳原
子个数。
先数出1cm3宏观物质所含有的微观粒子个数,然后
再根据宏观物质的总体积,计算出微观粒子个数
先测量出1个微观粒子的体积,然后再用宏观物质的
体积除以1个微观粒子的体积,计算出微观粒子个数
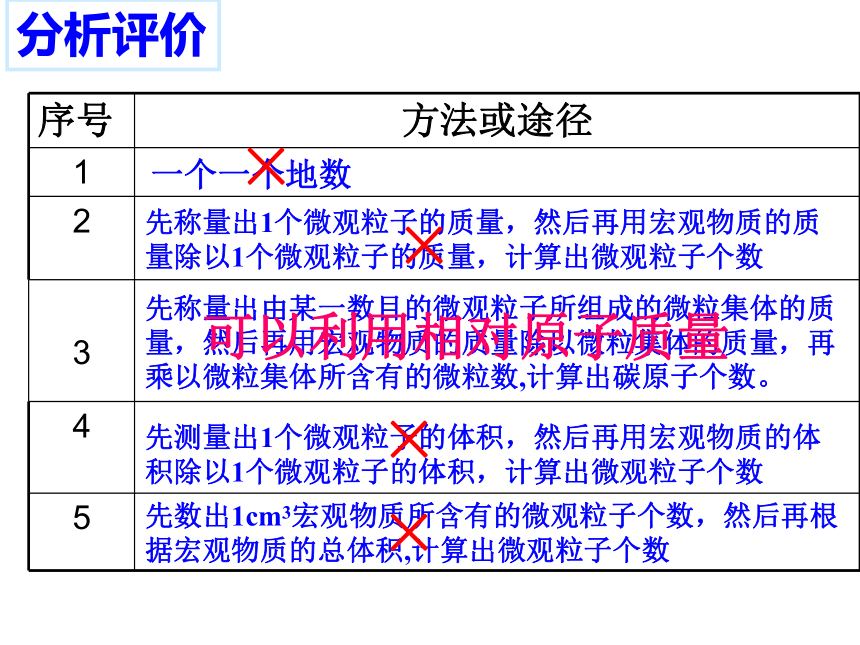
分析评价
序号
方法或途径
1
2
3
4
5
一个一个地数
先称量出1个微观粒子的质量,然后再用宏观物质的质量除以1个微观粒子的质量,计算出微观粒子个数
先称量出由某一数目的微观粒子所组成的微粒集体的质量,然后再用宏观物质的质量除以微粒集体的质量,再乘以微粒集体所含有的微粒数,计算出碳原子个数。
先数出1cm3宏观物质所含有的微观粒子个数,然后再根据宏观物质的总体积,计算出微观粒子个数
先测量出1个微观粒子的体积,然后再用宏观物质的体积除以1个微观粒子的体积,计算出微观粒子个数
×
×
×
×
可以利用相对原子质量
建立模型
根据方法3,我们把这一微观粒子集体所含
微粒数目暂定为NA个,建立下列数学模型:
物质所含微粒数=
×NA
一、物质的量及其单位---------摩尔
1、物质的量(n):是一种物理量,是宏观的数量与微观的粒子联系起来的物理量
如长度、时间、质量、电流、温度等物理量相似
既然是物理量就有单位,正如长度----米,质量-----千克等相似,那么,物质的量的单位又是如何规定的呢?
2、物质的量的单位:摩尔,符号mol
1
mol
任何粒子所含有的粒子数同0.012kg12C所含碳原子数目相等
这样规定有什么好处?
3、阿伏加德罗常数(NA):
0.012kg
12C所含碳原子数目为6.02×1023
,
6.02×1023
mol--1称为阿伏加德罗常数。
①
NA个微观粒子所形成的微粒集体的质量在几克
到几百克之间,质量大小适宜,可以称量,便于换算。
②
有利于借助相对原子质量,确定不同种类粒子集体的质量。
=
物质的量(mol)
当物质的量等于1mol时:
物质所含微粒数=阿佛加德常数
物质的质量=阿佛加德罗常数个微粒的质量
=
1
mol
12C
含有6.02×1023个12C
1
mol
H2O
含有6.02×1023个H2O
1
mol
NO3-
含有6.02×1023个NO3-
思考
物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)之间有什么关系?
小结:物质的量与物质所含微粒数的关系
物质的量=
(mol)
n=
N
NA
物质的量:用0.012kg
12C中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的物理量
使用摩尔概念时的注意事项
⑴适用范围:
⑵使用准则:
⑶大:
⑷小:
⑸广:
微观粒子或它们的特定组合
必须指明微粒符号或化学式
1mol物质所含微粒数巨大
摩尔计量的是肉眼无法看到的微观粒子
应用范围极广,是联系微粒个体与微粒集体、不可称量的反应微粒与可称量的宏观物质的桥梁。
迁移·应用
学习了物质的量之后,某同学想用下图表示自己三氧化硫的组成的进一步认识。请你协助他完成这幅关系图,并说明这幅图的含义:
微粒数(
)硫原子
氧原子(
)微粒数
6.02×1023个三氧化硫分子
1mol的SO3
物质的量(
)S
O(
)物质的量
6.02×1023个
1.806×1024个
1mol
3mol
练习、计算并填空:
⑴
3.01×1024个硫酸分子的物质的量为
mol;
⑵2
mol
H2O中含
mol
H和
mol
O,
含有
个H2O。
⑶9.03×1023个甲烷分子含
mol
C原子、
mol
H原子,
mol质子、
mol电子。
⑷
molCO2中含有的氧原子数跟1.806×1024个
H2O分子中含有的氧原子数相同。
5
4
2
1.
204×1024
1.5
6
15
15
1.5
问题探究
摩尔质量和气体摩尔体积
〖讨论〗阅读P21表1-3-1,组内研讨
问题
结论
1mol物质的质量在数值上有什么特点?
相同的温度、压强下,1mol的不同物质的体积在数值上有什么特点?
数值上等于其相对原子质量或
相对分子质量,单位为克
固体、液体物质体积无明显规
律,气体物质体积基本相同
小结:摩尔质量
1mol物质(即单位物质的量的物质)的质量叫摩尔质量(单位:g/mol),符号为M。
n=
〖问题〗
1、1mol不同物质的质量为什么不同?
2、Na和
Na
+的摩尔质量是否相同?为什么?
物质的量与物质的质量、
摩尔质量的关系:
定义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积。
符号:
Vm
单位:
L·
mol-1
理解:
(1)它只适用于气体(单一或混合气体都可以)。
(2)标准状况下(0
℃,1.01×105Pa)气体摩尔体积约为22.4
L·
mol-1
。
小结:气体摩尔体积
n=
V
Vm
例题1
下列说法是否正确?
⑴在标准状况下,1mol水的体积约是22.4L
(
)
⑵
1mol
H2的体积约是22.4L
(
)
⑶
1mol
CO2和1mol
CO所含的分子数和体积都相同(
)
⑷
1mol
O2在20℃时的体积一定大于22.4L
(
)
⑸在标准状况下,0.5mol
N2和1mol
O2
的混合气体的
体积约是33.6L
(
)
×
×
×
×
√
在标准状况下,CO和CO2的混合气体共39.2L,质量为61g,求两种气体的物质的量和各自的体积
例题2
VCO=
1
mol×22.4
mol/L=
22.4
L
VCO2=
0.75
mol×22.4
mol/L=
16.8
L
概括·整合1
÷摩尔质量
×摩尔质量
物质的质量
(g)
物质的量
(mol)
微粒数
(个)
×阿伏加德罗常数
÷阿伏伽德罗常数
STP时气
体体积
×气体摩
尔体积
÷气体摩
尔体积
以阿伏伽德罗常数个微粒所组成的微粒集体作标准,表示一定量的物质中含有多少个这样的微粒集体的物理量
物质的量的单位,任何1mol物质中都含有阿伏伽德罗常数个微粒
每摩尔物质的质量,单位为g/mol
12g碳12C中所含碳原子的个数,大约为6.02×1023
概括·整合2
n=
N
NA
n=
n=
V
Vm
任何物质所含的微粒数
任何物质的质量
气体物质在STP时的体积
适用于任何物质
只适用于STP时的气体
问题探究
一定体积溶液的组成
探究:配制0.1
L
NaCl溶液,其中溶质的物质的量为0.04
mol。
实验步骤:
计算
准备仪器
称量
溶解
转移
定容摇匀
装瓶贴签
基本步骤:
算—称—溶—转—定—装
1.需要哪些仪器?容量瓶上有哪些标识?
2.如何洗涤仪器?
3.称量时要注意什么?
4.什么操作可以加速溶解?
5.溶解后若有明显的温度改变,能否立即转移溶液?如何保证尽可能将溶质全部转移到容量瓶中?
6.至容量瓶容积的2/3时,为什么要轻轻振荡容量瓶?定容时要注意什么?
问题探究
〖讨论〗上述配得的溶液怎样表示它的组成?
物质的量浓度:
以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度(CB)。单位为mol
·
L-1
、或mol
·
m-3
CB=
溶质的
物质的量
溶液的体积
溶质的
物质的量浓度
〖讨论与练习〗
2、1mol/L的H2SO4溶液中CH+、
CSO42-分别是多少?
1、将53gNa2CO3固体溶于水配成0.5升溶液,所得
Na2CO3溶液物质的量浓度是多少?
3、将1mol
NaCl和1mol
CaCl2溶于水配成1升溶液,
所得溶液中各离子物质的量浓度是多少?
CNa2CO3
=1
mol
·
L-1
CH+
=
2mol
·
L-1
、
CSO42-
=
1mol
·
L-1
CNa+
=
1mol
·
L-1
、CCa2+
=1
mol
·
L-1
、
CCl-
=3
mol
·
L-1
概括·整合3
×溶液体积(L)
÷溶液体积(L)
÷22.4L/mol
×22.4L/mol
物质的质量M
(g)
物质的量
n
(mol)
微粒数N(个)
÷摩尔质量(g/mol)
×摩尔质量(g/mol)
×阿伏伽德罗常数
÷阿伏伽德罗常数
标况下气体体积V
(L)
溶液的物质的量浓度CB(mol/L)
问题探究
物质的量与化学反应
2H2
+
O2
===
2H2O
点燃
4g
(
)
(
)
2NA
个
(
)
(
)
2mol
(
)
(
)
(
)
22.4L
从物质的量角度:
从质量角度:
从微粒数角度:
从标况下气体
体积角度:
从任意相同条件
气体体积比角度:
2体积
:1体积
32g
36g
NA个
2NA个
1mol
2mol
44.8L
[交流研讨]
1、在标准状况下。CH4气体0.224升,充分燃烧时消耗O2多少摩尔?生成水多少克?如果将生成的CO2气体用2mol/L的NaOH溶液吸收,需要多少毫升的NaOH溶液?
2、如何用质量分数为98%,密度为1.84g/ml的浓硫酸配制250ml
2mol/L的稀硫酸?
普通高中课程标准实验教科书
化学1(必修)
第一章
第三节
化学中常用的物理量
——物质的量
联想·质疑
思考讨论
一谷仓的谷子,假定每一粒谷子的形状、体积、质量是相同的,我们通过哪些方法或途径可以知道这个谷仓中的谷子的个数?
序号
方法或途径
1
2
3
4
5
…
…
直接数数
先称量出一粒谷子的质量,再用谷仓中谷子的总质量除以一粒谷子的质量。
先称量出100粒谷子的质量,用谷子的总质量除以
100粒谷子的质量,再乘以100
。
先测量出一粒谷子的体积,再用仓库中谷子的总体积除以一粒谷子的体积
。
先用一个容器(升、斗或担),先数出一升(斗或担)中谷子的粒数,再用升(斗或担)去量谷仓库中谷子,用升数乘以一升中谷子的粒数,就为谷仓库中谷子的粒数。
建立模型
模型一:——直接计量(方法一)
模型二:——引入中间物理量换算
(方法二~五)
C
+
O2
===
CO2
宏观上:
(物质质量或体积)
微观上:
(所含粒子数目)
12克
32克
44克
1个C原子
1个O2分子
1个CO2分子
宏观物质
质量体积
微观粒子
个
数
?
思考探究
结合前面解决一个仓库中谷子粒数的方法模型,尽可能多地列举出解决一定质量或体积的宏观物质中所含粒子数的方法或途径。
序号
方法或途径
1
2
3
4
5
一个一个地数
先称量出1个微观粒子的质量,然后再用宏观物质的
质量除以1个微观粒子的质量,计算出微观粒子个数
先称量出由某一数目的微观粒子所组成的微粒集体
的质量,然后再用宏观物质的质量除以微粒集体的
质量,再乘以微粒集体所含有的微粒数,计算出碳原
子个数。
先数出1cm3宏观物质所含有的微观粒子个数,然后
再根据宏观物质的总体积,计算出微观粒子个数
先测量出1个微观粒子的体积,然后再用宏观物质的
体积除以1个微观粒子的体积,计算出微观粒子个数
分析评价
序号
方法或途径
1
2
3
4
5
一个一个地数
先称量出1个微观粒子的质量,然后再用宏观物质的质量除以1个微观粒子的质量,计算出微观粒子个数
先称量出由某一数目的微观粒子所组成的微粒集体的质量,然后再用宏观物质的质量除以微粒集体的质量,再乘以微粒集体所含有的微粒数,计算出碳原子个数。
先数出1cm3宏观物质所含有的微观粒子个数,然后再根据宏观物质的总体积,计算出微观粒子个数
先测量出1个微观粒子的体积,然后再用宏观物质的体积除以1个微观粒子的体积,计算出微观粒子个数
×
×
×
×
可以利用相对原子质量
建立模型
根据方法3,我们把这一微观粒子集体所含
微粒数目暂定为NA个,建立下列数学模型:
物质所含微粒数=
×NA
一、物质的量及其单位---------摩尔
1、物质的量(n):是一种物理量,是宏观的数量与微观的粒子联系起来的物理量
如长度、时间、质量、电流、温度等物理量相似
既然是物理量就有单位,正如长度----米,质量-----千克等相似,那么,物质的量的单位又是如何规定的呢?
2、物质的量的单位:摩尔,符号mol
1
mol
任何粒子所含有的粒子数同0.012kg12C所含碳原子数目相等
这样规定有什么好处?
3、阿伏加德罗常数(NA):
0.012kg
12C所含碳原子数目为6.02×1023
,
6.02×1023
mol--1称为阿伏加德罗常数。
①
NA个微观粒子所形成的微粒集体的质量在几克
到几百克之间,质量大小适宜,可以称量,便于换算。
②
有利于借助相对原子质量,确定不同种类粒子集体的质量。
=
物质的量(mol)
当物质的量等于1mol时:
物质所含微粒数=阿佛加德常数
物质的质量=阿佛加德罗常数个微粒的质量
=
1
mol
12C
含有6.02×1023个12C
1
mol
H2O
含有6.02×1023个H2O
1
mol
NO3-
含有6.02×1023个NO3-
思考
物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)之间有什么关系?
小结:物质的量与物质所含微粒数的关系
物质的量=
(mol)
n=
N
NA
物质的量:用0.012kg
12C中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的物理量
使用摩尔概念时的注意事项
⑴适用范围:
⑵使用准则:
⑶大:
⑷小:
⑸广:
微观粒子或它们的特定组合
必须指明微粒符号或化学式
1mol物质所含微粒数巨大
摩尔计量的是肉眼无法看到的微观粒子
应用范围极广,是联系微粒个体与微粒集体、不可称量的反应微粒与可称量的宏观物质的桥梁。
迁移·应用
学习了物质的量之后,某同学想用下图表示自己三氧化硫的组成的进一步认识。请你协助他完成这幅关系图,并说明这幅图的含义:
微粒数(
)硫原子
氧原子(
)微粒数
6.02×1023个三氧化硫分子
1mol的SO3
物质的量(
)S
O(
)物质的量
6.02×1023个
1.806×1024个
1mol
3mol
练习、计算并填空:
⑴
3.01×1024个硫酸分子的物质的量为
mol;
⑵2
mol
H2O中含
mol
H和
mol
O,
含有
个H2O。
⑶9.03×1023个甲烷分子含
mol
C原子、
mol
H原子,
mol质子、
mol电子。
⑷
molCO2中含有的氧原子数跟1.806×1024个
H2O分子中含有的氧原子数相同。
5
4
2
1.
204×1024
1.5
6
15
15
1.5
问题探究
摩尔质量和气体摩尔体积
〖讨论〗阅读P21表1-3-1,组内研讨
问题
结论
1mol物质的质量在数值上有什么特点?
相同的温度、压强下,1mol的不同物质的体积在数值上有什么特点?
数值上等于其相对原子质量或
相对分子质量,单位为克
固体、液体物质体积无明显规
律,气体物质体积基本相同
小结:摩尔质量
1mol物质(即单位物质的量的物质)的质量叫摩尔质量(单位:g/mol),符号为M。
n=
〖问题〗
1、1mol不同物质的质量为什么不同?
2、Na和
Na
+的摩尔质量是否相同?为什么?
物质的量与物质的质量、
摩尔质量的关系:
定义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积。
符号:
Vm
单位:
L·
mol-1
理解:
(1)它只适用于气体(单一或混合气体都可以)。
(2)标准状况下(0
℃,1.01×105Pa)气体摩尔体积约为22.4
L·
mol-1
。
小结:气体摩尔体积
n=
V
Vm
例题1
下列说法是否正确?
⑴在标准状况下,1mol水的体积约是22.4L
(
)
⑵
1mol
H2的体积约是22.4L
(
)
⑶
1mol
CO2和1mol
CO所含的分子数和体积都相同(
)
⑷
1mol
O2在20℃时的体积一定大于22.4L
(
)
⑸在标准状况下,0.5mol
N2和1mol
O2
的混合气体的
体积约是33.6L
(
)
×
×
×
×
√
在标准状况下,CO和CO2的混合气体共39.2L,质量为61g,求两种气体的物质的量和各自的体积
例题2
VCO=
1
mol×22.4
mol/L=
22.4
L
VCO2=
0.75
mol×22.4
mol/L=
16.8
L
概括·整合1
÷摩尔质量
×摩尔质量
物质的质量
(g)
物质的量
(mol)
微粒数
(个)
×阿伏加德罗常数
÷阿伏伽德罗常数
STP时气
体体积
×气体摩
尔体积
÷气体摩
尔体积
以阿伏伽德罗常数个微粒所组成的微粒集体作标准,表示一定量的物质中含有多少个这样的微粒集体的物理量
物质的量的单位,任何1mol物质中都含有阿伏伽德罗常数个微粒
每摩尔物质的质量,单位为g/mol
12g碳12C中所含碳原子的个数,大约为6.02×1023
概括·整合2
n=
N
NA
n=
n=
V
Vm
任何物质所含的微粒数
任何物质的质量
气体物质在STP时的体积
适用于任何物质
只适用于STP时的气体
问题探究
一定体积溶液的组成
探究:配制0.1
L
NaCl溶液,其中溶质的物质的量为0.04
mol。
实验步骤:
计算
准备仪器
称量
溶解
转移
定容摇匀
装瓶贴签
基本步骤:
算—称—溶—转—定—装
1.需要哪些仪器?容量瓶上有哪些标识?
2.如何洗涤仪器?
3.称量时要注意什么?
4.什么操作可以加速溶解?
5.溶解后若有明显的温度改变,能否立即转移溶液?如何保证尽可能将溶质全部转移到容量瓶中?
6.至容量瓶容积的2/3时,为什么要轻轻振荡容量瓶?定容时要注意什么?
问题探究
〖讨论〗上述配得的溶液怎样表示它的组成?
物质的量浓度:
以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度(CB)。单位为mol
·
L-1
、或mol
·
m-3
CB=
溶质的
物质的量
溶液的体积
溶质的
物质的量浓度
〖讨论与练习〗
2、1mol/L的H2SO4溶液中CH+、
CSO42-分别是多少?
1、将53gNa2CO3固体溶于水配成0.5升溶液,所得
Na2CO3溶液物质的量浓度是多少?
3、将1mol
NaCl和1mol
CaCl2溶于水配成1升溶液,
所得溶液中各离子物质的量浓度是多少?
CNa2CO3
=1
mol
·
L-1
CH+
=
2mol
·
L-1
、
CSO42-
=
1mol
·
L-1
CNa+
=
1mol
·
L-1
、CCa2+
=1
mol
·
L-1
、
CCl-
=3
mol
·
L-1
概括·整合3
×溶液体积(L)
÷溶液体积(L)
÷22.4L/mol
×22.4L/mol
物质的质量M
(g)
物质的量
n
(mol)
微粒数N(个)
÷摩尔质量(g/mol)
×摩尔质量(g/mol)
×阿伏伽德罗常数
÷阿伏伽德罗常数
标况下气体体积V
(L)
溶液的物质的量浓度CB(mol/L)
问题探究
物质的量与化学反应
2H2
+
O2
===
2H2O
点燃
4g
(
)
(
)
2NA
个
(
)
(
)
2mol
(
)
(
)
(
)
22.4L
从物质的量角度:
从质量角度:
从微粒数角度:
从标况下气体
体积角度:
从任意相同条件
气体体积比角度:
2体积
:1体积
32g
36g
NA个
2NA个
1mol
2mol
44.8L
[交流研讨]
1、在标准状况下。CH4气体0.224升,充分燃烧时消耗O2多少摩尔?生成水多少克?如果将生成的CO2气体用2mol/L的NaOH溶液吸收,需要多少毫升的NaOH溶液?
2、如何用质量分数为98%,密度为1.84g/ml的浓硫酸配制250ml
2mol/L的稀硫酸?
